原代培养的细胞因其接近和反映体内生长的特性,现已广泛应用于各类实验研究中 [1, 2]。然而实体肿瘤的原代培养所需时间长、细胞生长率低、实验条件要求高限制了其在肿瘤研究中的应用 [3, 4]。肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)作为肿瘤微环境的重要组成部分,参与增殖信号的持续活化、调节细胞周期及凋亡、诱导肿瘤血管生成、促进增殖及转移等诸多肿瘤特性。故而CAFs作为可能成为肿瘤靶向治疗的新位点,其作用在实验研究中地位逐年上升。
本研究综合组织块培养法及酶消化法两种常见原代培养方式,在此基础上对两种方法进行综合改良,成功地建立了一种成功率较高的宫颈癌相关成纤维细胞原代培养方法。
1 材料与方法 1.1 主要试剂DMEM(High Glucose,Hyclone),牛血清(fetal bovine serum,FBS,Gibco),Ⅰ型胶原酶(Sigma,USA)、胰蛋白酶(碧云天)、青链霉素。鼠抗α-SMA(肌动蛋白α)单克隆抗体、鼠抗Vimentin(波形蛋白)单克隆抗体、鼠抗CK-19(细胞角蛋白19)单克隆抗体(Abcam,USA)。
1.2 实验方法取2015年6月-2016年5月间武汉大学中南医院妇瘤科确诊的宫颈癌患者15例,取材前经伦理委员会同意。活检标本取材前常规消毒外阴,手术标本于于无菌状况下取材。本研究中15例标本中,仅1例为活检标本。所取标本立即置于含0.1%双抗PBS中,或直接置于冰盒中,于2 h内进行分离培养。
1.2.1 基本处理将所取标本置于超净工作台内,去除血块及表面坏死组织,用1%活力碘漂洗1遍后用含高浓度双抗的PBS液漂洗2-3遍。所取标本均分为三等分,分别用以下三种不同的原代培养方式进行处理。
1.2.2 组织块贴壁法将常规处理后的组织块用眼科剪剪碎至0.5 mm×0.5 mm×0.5 mm大小,均匀贴附于6 cm培养皿中,于37 ℃、5% CO2培养箱中自然晾干6-8 h,随后加入1 ml 50% FBS培养基继续培养1-2 d后换液。
1.2.3 酶消化法首先取1 ml 0.2%明胶加入6 cm培养皿中,置于37 ℃、5% CO2培养箱中包被培养瓶底部,1 h后取出后吸除多余明胶,用培养基洗一遍。将基本处理后的组织块以眼科剪剪碎呈糊状,加入5倍于组织块体积的0.2%(2 mg/ml)的Ⅰ型胶原酶,置于电热振荡器中37 ℃震荡消化30-60 min。取出后1 000 r/min离心5 min弃去废液,随后用PBS洗2遍,最后一次加入15%-20% FBS完全培养基,吹打后静置10 s,取上端细胞悬液种入6 cm培养皿中。
1.2.4 改良培养法用眼科剪将常规处理后的组织块剪碎呈糊状,加入5倍于组织块体积的0.2% Ⅰ型胶原酶,置于37 ℃电热振荡器中,分为3等份后分别震荡消化30,60,90 min。待组织边缘消化为絮状,停止消化。消化后取出后用巴氏吸管吹打离散2 min,吹打2 min,离心后PBS洗2遍。随后将消化后的组织碎块分成三等份分别重悬于10%胎牛血清完全培养基、20%胎牛血清完全培养基、50%胎牛血清完全培养基和80%胎牛血清完全培养基中。各组均以培养基不流动,恰好浸润组织碎片为佳,放置1-2 d,观察消化时间及培养基血清浓度对细胞生长率的影响。
1.3 肿瘤相关成纤维细胞的分离纯化细胞铺满培养瓶后,通过时间差酶消化及反复贴壁法再次传代。使胰蛋白酶流过所有细胞表面,将培养瓶放在显微镜下观察,发现成纤维细胞变圆,部分脱落,立即加入2 ml完全培养液终止消化,不经吹打直接将细胞悬液传入新的培养瓶中。随后将培养瓶置于培养箱静置30 min,镜下观察多数细胞已贴壁,吸走培养基,用PBS轻轻漂洗1-2遍,加入20%胎牛血清完全培养基继续培养。下次传代时重复上述操作步骤,通过几次传代,便可将成纤维细胞与上皮细胞分离。传代至第4代获得较纯化的成纤维细胞。
1.4 免疫荧光对肿瘤相关成纤维细胞进行鉴定常规细胞爬片后弃去培养皿中的培养液,PBS漂洗2次,4%多聚甲醛固定10 min,0.1 mol/L的PBS液漂洗,10%牛血清白蛋白封闭30 min,分别加入鼠抗人α-SMA单克隆抗体、波状蛋白及角蛋白CK19抗体工作液(分别为1∶500,1∶300,1∶300),湿盒内孵育1 h后PBS洗涤3次,滴加稀释好的荧光(Cy3)标记羊抗小鼠IgG(1∶100),湿盒中20-37 ℃孵育1 h,弃去二抗溶液后PBS冲洗3遍,后用0.1-1 μg/ml DAPI孵育细胞1 min,PBS冲洗后加入抗淬灭剂,封片后移至显微镜下观察。
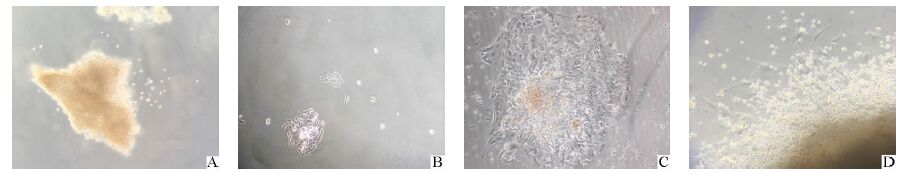
2 结果 2.1 三种原代培养方法的成功率组织块贴壁培养7-10 d未见有明显细胞爬出(图 1A)。胶原酶酶消化法,24 h后见少量贴壁细胞(图 1B),静置3 d,贴壁细胞约为5%-15%,余细胞均未贴壁。改良培养法24 h后见大量组织贴壁(图 1C),并有大量细胞爬出,静置10-14 d,6 cm培养板生长密度达80%-90%,胰酶消化后传入25 cm2培养瓶继续培养。
|
图 1 不同培养方式原代组织的初期生长状态 A:组织块贴壁法,第7天(×40);B:酶消化法,第5天(×40);C:改良培养法,第2天(×100);D:改良培养法,第4天(×100) |
宫颈癌本身为有菌环境,细胞培养污染率高,15例标本中,仅有1例活检标本污染,组织块贴壁法有8例污染,胶原酶消化法存在3例污染,改良培养法1例污染。组织块培养法见有细胞爬出4例,其中仅1例继续向外生长,另外3例生长停滞。胶原酶消化法组有8例细胞贴壁生长,但是静置2-3 d贴壁细胞数少,细胞难以存活。改良培养法中有13例细胞或组织块贴壁,2-3 d开始有细胞爬出。
2.2 不同消化时间及血清浓度的原代细胞生长率组织经过30 min的消化成为絮状,有较多黏液相连,此时镜下可见细胞较为松散,由黏液相互黏附,质稀薄,终止消化后用巴式吸管尽量将组织吹散,使其分散成碎片状,后加1 ml 20%胎牛血清完全培养基接种入6 cm培养皿,此种方法细胞生长率最高(见表 1),应用这种方法进行培养的原代细胞经过2-3周生长可爬满培养瓶底。
| 表 1 不同消化时间及血清浓度的原代细胞生长率 |
传统胶原酶消化后细胞均分离为单个,大小不等,包浆透亮,状态良好,培养2 d后呈小簇状贴壁生长(图 1B),未贴壁细胞折光增强、少数萎缩、胞质浑浊,呈现凋亡状态。
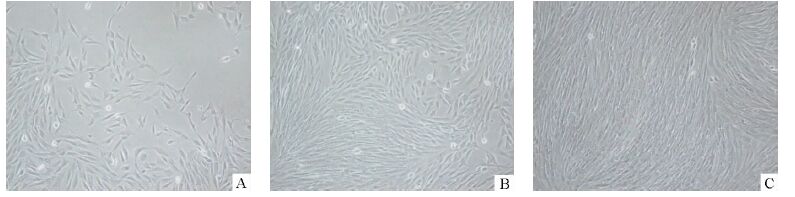
改良法接种后24 h即可见到松散组织内部及边缘较多量细胞贴壁并开始增殖(如图 1C、1D),培养2-3周细胞可长满培养瓶的底部,呈不规则铺路石样,局部细胞有融合及重叠生长,此时成纤维细胞生长迅速且与肿瘤细胞分区明显(如图 2A、B)。经时间差酶消化及反复贴壁法反复传代约3-4次后,可能到较为纯粹的肿瘤相关成纤维细胞,呈“栅栏”样生长(图 2C)。
|
图 2 宫颈癌相关成纤维细胞与肿瘤细胞后期生长状态 A、B:宫颈癌相关成纤维细胞与肿瘤细胞分区生长(×100);C:宫颈癌相关成纤维细胞呈“栅栏”样生长(×100) |
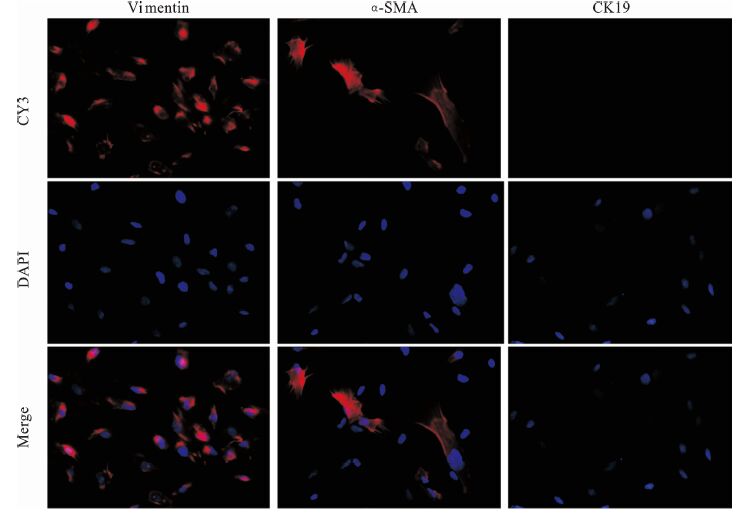
细胞特异性标记染色显示成纤维细胞角蛋白CK19染色呈阴性,波形蛋白(Vimentin)、α-SMA染色呈阳性(见图 3A),波形蛋白染色可见胞质与胞核染色呈一一对应。结合形态学、免疫细胞化学鉴定结果考虑,可得出培养的原代细胞为宫颈癌相关成纤维细胞的结论。
|
图 3 宫颈癌相关成纤维细胞Vimentin、α-SMA及CK19免疫荧光 (×200) |
目前越来越多的证据显示肿瘤相关成纤维细胞作为肿瘤微环境中重要的基质细胞,通过协调肿瘤细胞增殖、转移、生存、侵袭来促进细胞恶性发展,在肿瘤发生、浸润、转移过程中扮演着十分重要的角色。原代培养的肿瘤相关成纤维细胞能够保留其原有的遗传特性,使得其在研究肿瘤微环境乃至肿瘤发生发展过程中起基础作用。本研究综合运用并改良了组织块贴壁法和酶消化法,建立了一种成功率较高的宫颈癌相关成纤维细胞培养的方法。
传统的单一胰酶消化法可能会过度消化组织细胞,使分离下来的细胞的存活率降低。胶原酶相对于胰蛋白酶而言作用力更缓和,本研究使用的0.2%(2 mg/ml)Ⅰ型胶原酶较适于消化分离细胞间质,缓解了对组织细胞的直接作用,使细胞缓慢从组织上分离下来,更有利于保持分离下细胞的活性。故而对于需要获取成纤维细胞的本实验而言,尤其需要掌握酶消化的用量和时间,以免消化过度,经反复试验我们认为0.2% Ⅰ型胶原酶37 ℃消化30 min培养成功率最高。与此同时,保留消化后的絮状组织继续培养也是本实验成功获取成纤维细胞的重要步骤。此外,宫颈癌组织因质地疏松而培养基中容易漂浮,所以重悬液量应以培养基不流动,恰好浸润组织碎片为佳,增加组织碎片的贴附能力。
培养基的选择是肿瘤细胞原代培养成功与否的关键,目前对是否应该使用原代细胞专用培养基尚无定论。本研究认为对于宫颈癌组织标本的原代培养可使用常规DMEM培养基。不同血清浓度的DMED培养基对宫颈癌细胞原代培养有着不同程度的影响,现今胎牛血清的品质参差不齐,过高浓度的血清可能会因为血清状态不稳定或营养物质过多而导致微生物或杂质的生长,过低的血清浓度又满足不了细胞的生长增殖要求。本研究通过反复试验认为20%的血清浓度细胞存活率高、形态完整且增殖快,是比较适宜宫颈癌成纤维细胞生长的血清浓度。
经过反复实验,我们体会到在宫颈癌相关成纤维细胞的培养中还需注意的有:①首次换液时间不宜过早,以3-4 d为佳。首次换液时未贴壁细胞有离心后再次贴壁生长的可能,勿丢弃;②初始培养时血清浓度为50%,细胞大量爬出后,可更换为20%血清的完全培养基;③可提前在培养瓶底部涂布血清或明胶,增强细胞贴附能力;④为确保无菌,可将组织块置于含双抗的胶原酶中消化;⑤为提高接种细胞密度,可根据组织量首先接种入24孔板或6孔板,待长满后更换至较大的培养皿中继续培养。
目前公认鉴定CAF的蛋白表型有α-SMA、Vimentin[5]。本实验采用免疫荧光的方式较好地证实了间质标记物α-SMA、Vimentin在CAFs中的阳性表达,同时用CK19阴性排除了癌细胞存在的可能,从而得出本方法中建立的为纯度较高宫颈癌相关成纤维细胞的结论。α-SMA是肌成纤维细胞细胞收缩表型的典型标志[6],Vimentin是间充质细胞和中胚层来源细胞(如成纤维细胞)的标记物,亦说明肿瘤相关成纤维细胞同时具有成纤维细胞和肌成纤维细胞的特征。
大量研究 [7-10]表明,CAFs可通过与肿瘤细胞直接接触、分泌多种细胞因子、合成调控细胞外基质的成分以及促使肿瘤细胞发生上皮-间质转化等多种方式促进肿瘤的发生、发展,其同血管相关细胞、免疫细胞等在肿瘤的发生发展中有着举足轻重的作用,被视为肿瘤进展中极其显著的调节子[11]。本研究成功建立了一种成功率较高的宫颈癌相关成纤维细胞改良培养方法,为后期探讨CAFs在肿瘤形成、进展中的作用打好了物质基础。
| [1] | Lee MY, Chou CY, Tang MJ, et al. Epithelial-mesenchymal transitionin cervical cancer: correlation with tumor progression, epidermalgrowth factor receptor overexpression, and snail up-regulation[J]. Clin Cancer Res, 2008(15): 4743-4750. |
| [2] | Ridky TW, Chow JM, Wong DJ, et al. Invasive three-dimensionalorganotypic neoplasia from multiple normal human epithelia[J]. Nat Med, 2010, 16(12): 1450-1455. DOI: 10.1038/nm.2265. |
| [3] |
易伟, 牛洪泉, 陶胜忠, 等. 人脑胶质瘤细胞的原代培养及生长活性观察[J].
中华神经外科疾病研究杂志, 2005, 4(3): 245-247.
Yi W, Niu HQ, Tao SZ, et al. Primary culture and growth activity of human glioma cells[J]. Chinese Journal of Neurosurgical Disease Research, 2005, 4(3): 245-247. |
| [4] |
王金渊, 王斌全, 张海利. 喉鳞状细胞癌癌细胞的原代培养[J].
临床耳鼻咽喉科杂志, 2005, 19(2): 123-126.
Wang JY, Wang BQ, Zhang HL. Primary culture of laryngeal squamous cell carcinoma cell line[J]. Journal of Clinical Otorhinolaryngology, 2005, 19(2): 123-126. |
| [5] | Hawinkel LJ, Paauwe M, Verspaget HW, et al. Interaction with colon cancer cells hyperactives TGF-β signaling in cancer-associated fibroblasts[J]. Oncogene, 2014, 33(1): 97-107. DOI: 10.1038/onc.2012.536. |
| [6] | Eyden B, Banerjee SS, Shenjere P, et al. The myofibroblast and its tumours[J]. J Clin Pathol, 2009, 62(3): 236-249. DOI: 10.1136/jcp.2008.061630. |
| [7] | Powell DR, Huttenlocher A. Neutrophils in the Tumor Microenvironment[J]. Trends Immunol, 2016, 37(1): 41-52. DOI: 10.1016/j.it.2015.11.008. |
| [8] | Okabe H, Hayashi H, Nakagawa S, et al. Inducible factors for cancer-associated fibroblasts in liver cancer versus myofibroblasts in inflammatory liver disease[J]. Histol Histopathol, 2016, 31(2): 141-148. |
| [9] | Nicholas NS, Apollonio B, Ramsay AG. Tumor microenvironment (TME)-driven immune suppression in B cell malignancy[J]. Biochim Biophys Acta, 2016, 1863(3): 471-482. DOI: 10.1016/j.bbamcr.2015.11.003. |
| [10] | Yamaguchi H, Sakai R. Direct Interaction between carcinoma cells and cancer associated fibroblasts for the regulation of cancer invasion[J]. Cancers (Basel), 2015, 7(4): 2054-2062. DOI: 10.3390/cancers7040876. |
| [11] | Hui L, Chen Y. Tumor microenvironment: Sanctuary of the devil[J]. Cancer Lett, 2015, 368(1): 7-13. DOI: 10.1016/j.canlet.2015.07.039. |
 2017, Vol. 38
2017, Vol. 38

