2. 十堰市太和医院/湖北医药学院附属医院 皮肤科, 湖北 十堰 442000;
3. 武汉大学口腔医学院正畸一科/口腔基础医学省部共建国家重点培育基地/口腔生物医学教育部重点实验室 湖北 武汉 430079
2. Dept. of Dermatology, Taihe Hospital, Hubei University of Medicine, Shiyan 442000, Hubei, China;
3. Dept. of Orthodontics, 1 st Division, School of Stomatology, Wuhan University; State Key Laboratory Breeding Base of Basic Science of Stomatology & Key Laboratory of Oral Biomedicine Ministry of Education, Wuhan 430079, China
在正畸治疗过程中,托槽、颊面管、种植钉等矫治装置常常给患者带来各种不适和不便,引发不同程度的牙体、牙周、黏膜等组织疾病[1],因此,如何加快牙齿移动,缩短正畸治疗时间是医患双方共同关心的问题。
牙齿移动是牙槽骨改建的结果,因此能影响牙槽骨改建的因素都可能影响正畸牙移动[2]。目前许多研究表明影响骨代谢的药物如甲状旁腺激素[3]、双磷酸盐[4]等都能影响牙齿移动。
生长激素(growth hormone, GH)是人脑垂体前叶分泌的一种蛋白质类激素,是人出生后促进生长的最主要的激素之一,对成年后骨量的维持起着重要的作用[5]。GH既能作用于成骨细胞,也能作用于破骨细胞,从而能影响骨代谢率[5]。
本实验对正畸牙移动的大鼠模型皮下注射重组人生长激素(recombinant human growth hormone, rhGH),观察大鼠上颌第一磨牙移动的情况和第一磨牙远腭根压力侧的破骨活动,旨在为正畸医生对正在接受rhGH治疗的患者正畸治疗计划的制定、支抗的控制、治疗时间的估计提供实验依据。
1 材料与方法 1.1 主要实验材料和试剂重组人生长激素(上海联合赛尔生物工程有限公司);抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphate, TRAP)染色试剂盒(美国Sigma公司);正畸自酸蚀粘结剂(日本富士公司);50 g力镍钛拉簧(日本Tomy公司)。
1.2 实验方法 1.2.1 实验动物分组及给药40只7周龄雄性Wistar大鼠,体重180-200 g,随机分为两组:生长激素(GH)组和对照组,每组20只。从给大鼠装矫治器当天开始皮下注射生长激素或生理盐水。生长激素组按照每日2 mg/kg的总剂量,分两次等量注射(即一次1 mg/kg);对照组每次注射等量的生理盐水。为防止皮下粘连,经常更换皮下注射的部位。
1.2.2 正畸牙移动模型的建立以8%水合氯醛(0.4 g/kg)腹腔注射麻醉大鼠后,用高速金刚砂车针沿着上颌切牙的颈缘磨出深约0.4 mm的浅沟,将50 g力镍钛拉簧固定于右侧上颌第一磨牙和切牙之间,此时拉簧被拉长约5 mm。平齐下颌切牙牙龈乳头处片切下切牙。左侧上颌第一磨牙作为不加力对照侧。术后给予粉末状饲料。每天观察加力装置及下切牙萌出情况,待下切牙完全萌出至与上切牙舌面接触时(术后第6天),再次片切下切牙[6]。
1.2.3 上颌牙列模型的制作和牙齿移动距离的测量分别于加载后第1,3,7,14天从两组中随机各取5只大鼠断头处死,取上颌牙列的印模,灌注超硬石膏模型。在石膏模型上测量双侧第一磨牙近中面至第二磨牙远中面之间的距离(M1M2),右侧M1M2与左侧M1M2之间的差值则为右侧第一磨牙移动的距离(orthodontic tooth movement, OTM)。每个样本测量3次,取3次的平均值作为最终的OTM。
1.2.4 TRAP染色取模后迅速分离带上颌磨牙的上颌骨,4%多聚甲醛固定48 h后,室温下脱钙。60 d后标本完全脱钙,经脱水、包埋后,沿着水平方向与磨牙平面平行,作3 μm厚的连续切片。按照TRAP染色试剂盒说明书进行TRAP染色。
1.3 破骨细胞计数对TRAP染色后的切片进行分析,在400×的高倍镜下,随机选择第一磨牙远腭根压力侧的5个视野,用于计数牙槽骨表面TRAP阳性多核破骨细胞。每个指标都是取5个视野计数的平均值。
1.4 统计学分析实验结果以均数±标准差表示,采用SPSS 13.0统计学软件进行数据处理,采用方差分析和独立样本t检验,P<0.05为差异有统计学意义。
2 结果 2.1 一般情况所有实验动物均在装置矫治器术后1-2 h苏醒,第2天恢复自由活动,未出现进食困难,拉簧脱落,损坏等现象。右侧第一磨牙近中移动,与第二磨牙之间出现间隙。装矫治器前后生长激素组和对照组大鼠体重没有明显差异(P>0.05)。
2.2 牙齿移动距离两组大鼠未加力侧第一磨牙与第二磨牙之间未见明显间隙(图 1A)。装矫治器后第1天加力侧第一磨牙明显向近中移动;第3天牙齿移动距离与第1天相比没有明显差异;第7天和第14天牙齿移动明显加快,与第1天和第3天相比差异有统计学意义。与对照组相比,第7天和第14天GH组牙齿移动明显加快(P<0.01,图 1B、C; 表 1)。

|
图 1 大鼠上颌牙列石膏模型显示正畸牙移动 A:未受力牙齿;B:加力第14天对照组;C:加力第14天GH组 |
| 表 1 对照组和GH组正畸牙移动距离和TRAP阳性多核破骨细胞数的比较(x±s, n=5) |
未加力侧第一磨牙远腭根近中鲜见TRAP阳性多核细胞(图 2A)。受力侧牙根GH组加力第3天TRAP阳性多核破骨细胞明显多于对照组,而加力第7天和第14天则明显少于对照组(见表 1和图 2)。
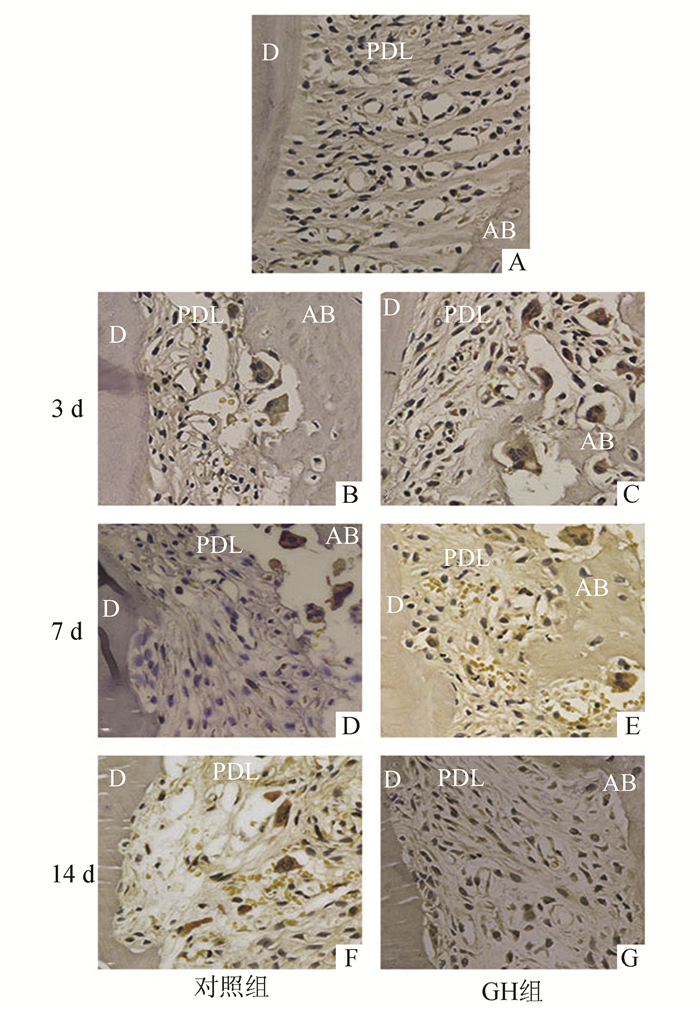
|
图 2 大鼠第一磨牙远腭根近中牙周组织TRAP染色(×400) A:未加力牙根;B,C:加力第3天对照组(B)和GH组(C);D,E:加力第7天对照组(D)和GH组(E);F,G:加力第14天对照组(F)和GH组(G);D:牙本质;PDL:牙周膜;AB:牙槽骨 |
牙齿移动的速度取决于骨转换率:高骨转换率促进牙齿的移动,低骨转换率延缓牙齿的移动[7]。近年来局部或全身应用骨代谢的药物来控制正畸牙移动的速度的研究较为广泛[8]。
GH不仅能促进成骨细胞的增殖和分化, 而且还能促进破骨细胞的分化,并通过基质细胞(包括成骨细胞)间接的激活破骨细胞,刺激破骨性骨吸收,因此GH对骨形成和骨吸收具有双重作用,能加快骨转换[5, 9]。Ku ma等[10]发现生长激素缺乏症患者经rhGH治疗(平均剂量0.35 mg/d)24个月后,腰椎和股骨的骨密度升高,骨形成标志物骨钙素和骨吸收标志物Ⅰ型胶原C端交联肽均升高。肢端肥大症患者及补充了rhGH的健康人群骨吸收和骨形成标志物均明显升高[11]。Tseng等[12]报道生长激素分泌过度的转基因小鼠的骨形成和骨吸收水平均加快。本实验结果发现与对照组相比,GH组上颌第一磨牙压力侧牙槽骨表面多核破骨细胞加力第3天明显增多,而加力第7天和第14天明显减少,说明rhGH在正畸牙移动的早期促进了骨吸收活动,而在正畸牙移动的后期则加快了骨形成活动,rhGH促进了骨代谢,与以往的研究结果一致。
正畸牙移动分为三个时期:起始期、滞后期和滞后后期。起始期牙齿受正畸力作用在牙周膜间隙内发生快速移动,移动的距离与正畸力大小有关。滞后期牙齿不发生进一步的移动,此期一直持续到牙周膜内透明样变组织基本完全被清除。滞后后期牙齿移动速度加快。在本研究中,加力第0-1天为牙齿移动的起始期,两组大鼠第一磨牙受力后在牙周膜间隙内发生快速移动;加力后第1-3天为滞后期,两组大鼠第一磨牙基本没有移动;并且对照组和GH组在加力后第1天和第3天牙齿移动距离没有明显差别,说明rhGH治疗既不会改变正畸牙移动的时相,也不会影响起始期牙齿在牙周膜内的移动距离。加力后第7天和第14天GH组第一磨牙移动的距离明显大于对照组,说明rhGH能加快滞后后期的牙齿移动,与GH组大鼠骨转换加快有关。
本实验所采用的生长激素的剂量和注射频率远高于临床剂量以克服大鼠对人GH所产生的免疫反应[6],因此,接受临床有效剂量的患者能否产生相似的结果需要进一步研究证实。尽管短期低剂量全身应用GH的副作用(注射部位红肿、疼痛,体液潴留)较轻,但全身长时间使用GH可能增加罹患癌症、糖尿病和心脏病等风险[13]。正畸治疗是一个长期的过程,正常发育的青少年患者和健康的成年患者使用GH来缩短治疗周期的安全性需要长期的临床观察和研究;能否改变用药方式,采用局部用药和缓释剂[13]来减少并发症,是我们下一步的研究方向。
| [1] | Talic NF. Adverse effects of orthodontic treatment: A clinical perspective[J]. Saudi Dent J, 2011, 23(2): 55-59. DOI: 10.1016/j.sdentj.2011.01.003. |
| [2] | Masella RS, Meister M. Current concepts in the biology of orthodontic tooth movement[J]. Am J Orthod Dentofacial Orthop, 2006, 129(4): 458-468. DOI: 10.1016/j.ajodo.2005.12.013. |
| [3] | Li F, Li G, Hu H, et al. Effect of parathyroid hormone on experimental tooth movement in rats[J]. Am J Orthod Dentofacial Orthop, 2013, 144(4): 523-532. DOI: 10.1016/j.ajodo.2013.05.010. |
| [4] |
胡亚军, 刘文韬, 徐晓明, 等. 二膦酸盐对正畸治疗过程中牙根吸收影响的系统评价[J].
临床口腔医学杂志, 2016, 32(7): 415-418.
Hu YJ, Liu WT, Xu XM, et al. The effect of bisphosphonates on root resorption during orthodontical treatment: a systematic review[J]. J Clin Stomatol, 2016, 32(7): 415-418. |
| [5] | Yakar S, Isaksson O. Regulation of skeletal growth and mineral acquisition by the GH/IGF-1 axis: Lessons from mouse models[J]. Growth Horm & IGF Res, 2016, 28: 26-42. |
| [6] | Hu Y, Liu W, Liu Z, et al. Receptor activator of nuclear factor-kappa B ligand, OPG, and IGF-Ⅰ expression during orthodontically induced inflammatory root resorption in the recombinant human growth hormone-treated rats[J]. Angle Orthod, 2015, 85(4): 562-569. DOI: 10.2319/052014-361.1. |
| [7] | Andrade I, Sousa AB dos S, da Silva GG. New therapeutic modalities to modulate orthodontic tooth movement[J]. Dental Press Journal of Orthodontics, 2014, 19(6): 123-133. DOI: 10.1590/2176-9451.19.6.123-133.sar. |
| [8] | Bartzela T, Turp JC, Motschall E, et al. Medication effects on the rate of orthodontic tooth movement: a systematic literature review[J]. Am J Orthod Dentofacial Orthop, 2009, 135(1): 16-26. DOI: 10.1016/j.ajodo.2008.08.016. |
| [9] | Locatelli V, Bianchi VE. Effect of GH/IGF-1 on bone metabolism and osteoporsosis[J]. International Journal of Endocrinology, 2014, 2014: 235060. |
| [10] | Ku ma M, Kuzmova Z, Zelinkova Z, et al. Impact of the growth hormone replacement on bone status in growth hormone deficient adults[J]. Growth Horm IGF Res, 2014, 24(1): 22-28. DOI: 10.1016/j.ghir.2013.12.001. |
| [11] | Ueland T. GH/IGF-Ⅰ and bone resorption in vivo and in vitro[J]. Eur J Endocrinol, 2005, 152(3): 327-332. DOI: 10.1530/eje.1.01874. |
| [12] | Tseng KF, Goldstein SA. Systemic over-secretion of growth hormone in transgenic mice results in a specific pattern of skeletal modeling and adaptation[J]. J Bone Miner Res, 1998, 13(4): 706-715. DOI: 10.1359/jbmr.1998.13.4.706. |
| [13] | Kim Y, Hong JW, Chung YS, et al. Efficacy andsafety of sustained-release recombinant human growth hormone in korean adults with growth hormone deficiency[J]. Yonsei Medical Journal, 2014, 55(4): 1 042-1 048. DOI: 10.3349/ymj.2014.55.4.1042. |
 2018, Vol. 39
2018, Vol. 39


