鼻咽癌是耳鼻咽喉头-颈外科最常见的恶性肿瘤之一。鼻咽癌具有非常独特的地理分布模式[1],它在中国华南地区及东南亚地区普遍发生,然而在其他地区较少出现,这一现象目前还没有发现明确的原因[2, 3]。
miRNA(或miR)是一类长度约18-25个核苷酸的小分子单链RNA具有调控功能的、内源性的、高度保守的非编码单链RNA。miRNA主要作用机制是通过与特异性靶分子mRNA序列(主要位置为3′非翻译区,3′-UTR)结合,引起特异性靶分子mRNA的降解或者抑制基因转录后翻译等,从而调控多种细胞生物学过程[4]。miRNA的生物合成过程及作用机制主要为:核内转录生成长度约为300-1 000 bp的初级miRNA,初级miRNA进一步由RNA酶Drosha加工成长度约为70-90 bp的miRNA前体,转运蛋白Exportin5主动将miRNA前体运输至细胞质,RNA核酸内切酶Dicer识别miRNA前体,并将其剪切成约22 bp的双链RNA,解链后生成成熟的单链miRNA,成熟的miRNA与RNA沉默诱导复合体结合并作用于靶mRNA的3′或5′非翻译区。当miRNA与特异性靶分子mRNA序列完全互补配对时,miRNA会导致靶mRNA的降解。当miRNA与特异性靶分子mRNA序列配对不完全时,miRNA会抑制靶mRNA的蛋白翻译[5, 6]。
我们前期筛选得到了在鼻咽癌癌组织和癌旁组织表达差异显著的miR-1275,本研究旨在初步探讨miR-1275在鼻咽癌中的作用。
1 材料与方法 1.1 鼻咽癌细胞系培养用含10%胎牛血清的RPMI 1640培养基培养正常鼻咽上皮细胞系NP69及鼻咽癌细胞系CNE-1细胞,置于37 ℃恒温培养箱培养。依实验要求对NP69及CNE-1细胞进行处理。
1.2 主要试剂及来源2×PCRMIX(北京康为世纪生物科技有限公司);2×实时荧光定量PCRMIX(日本TaKaRa公司);DEPC水(碧云天生物技术公司);HiFiScriptcDNA第一链合成试剂盒(北京康为世纪生物科技有限公司);PCR引物(武汉擎科创新生物科技有限公司);TRIzol(美国Invitrogen公司)。
1.3 方法 1.3.1 Real-time PCR检测技术提取新鲜组织或者鼻咽癌细胞系RNA后运用HiFiScriptcDNA第一链合成试剂盒逆转录成cDNA,miR-1275采用All-in-oneTMmiRNA qPCR检测试剂盒进行反应,以U6作为内参照。靶基因采用SYBR-GreenPCRMasterMix进行反应,以GAPDH作为内参照。靶基因HOXB5引物序列,上游引物:5′-TCAGCCATGATATGACCGGG-3′,下游引物:5′-AGATCTTGATCTGGCGCTCG-3′。
1.3.2 靶基因预测本研究选择常用的miRNA靶基因在线预测网站TargetScan(www.targetscan.org)预测miR-1275-3p的靶基因。TargetScan通过查找mer位点与miRNA的种子区域的匹配来预测靶基因,故只有保守的位点可以被预测到。在哺乳动物中,通过位点的累积加权分数对预测出来的靶基因的靶向性进行排序[7]。
1.3.3 双荧光素酶报告分析双荧光素酶报告分析操作依照luciferase检测操作手册进行。
1.3.4 细胞增殖实验将CNE1细胞依据分组分别接种在96孔板中,每孔接种浓度约1×104个细胞,置于含5%CO2,37 ℃恒温箱中进行正常培养。每组中的实验重复进行3次,并且设立空白对照。各组中依实验要求加入miR-1275模拟物,HOXB5 siRNA。分别培养0, 24, 48和72 h后,加入10 ml CCK-8,37 ℃孵育1 h,450 nm处检测吸光度值。
1.3.5 统计学方法实验数据以均数±标准差表示,采用SPSS 16.0统计软件对数据进行检验,以P<0.05视为具有统计学差异。
2 结果 2.1 miR-1275在鼻咽癌细胞系中低表达提取正常鼻咽上皮细胞系NP-69细胞及鼻咽癌细胞系CNE-1细胞RNA,检测两组细胞中miR-1275中的表达水平。以miR-1275在NP-69细胞中的表达水平为标准,miR-1275在CNE-1中的相对表达量为0.37±0.01,且具有统计学意义(P<0.05,图 1)。结果提示,在鼻咽癌细胞系中miR-1275表达下调。
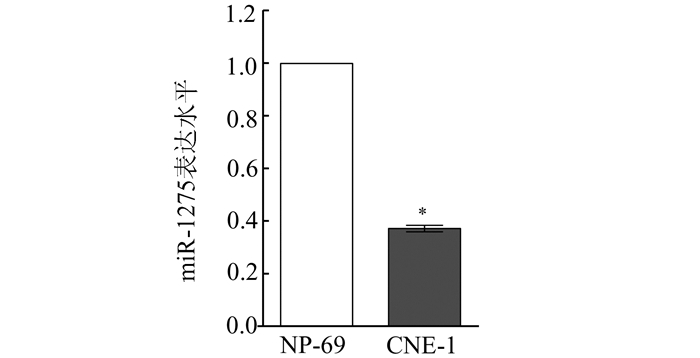
|
图 1 miRNA在NP-69及CNE-1细胞中的表达水平 *与NP-69相比,P<0.05 |
我们在几个数据库,包括PicTar,microRNA.org和TargetScan中寻找miR-1275的靶基因,其中HOXB5 3′-UTR的929-947处含有保守的miR-1275同源位点(图 2A),因此最终选择了在多种肿瘤细胞中高表达的癌基因HOXB5作为miR-1275的靶基因。随后的双荧光素酶报告分析实验结果显示,质粒转染HOXB5野生型3′-UTR载体在miR-1275模拟物刺激下萤火虫荧光素与海肾荧光素的比值明显下降,而转染HOXB5突变型3′-UTR组在miR-1275模拟物刺激下萤火虫荧光素与海肾荧光素的比值无明显变化(图 2B)。提示HOXB5为miR-1275的靶基因。
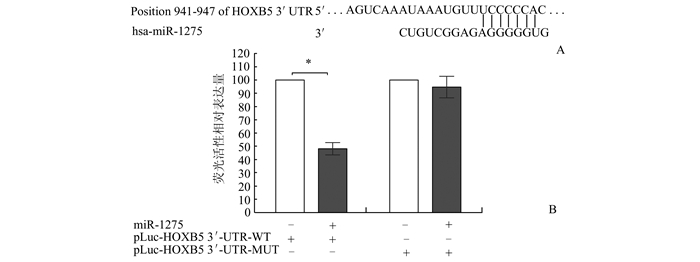
|
图 2 miR-1275与靶基因HOXB5相互作用的双荧光酶素检测结果 A: miRNA-1275与预测靶点HOXB5的结合位点; B:双荧光素酶法检测miRNA-1275与预测靶点HOXB5能靶向结合,*P<0.05 |
为了进一步验证鼻咽癌细胞中miR-1275的肿瘤抑制效率,我们用空白对照,miR-1275模拟物,HOXB5 siRNA(si-HOXB5)对CNE-1细胞的作用,我们用CCK8法检测不同时间点处理CNE-1细胞的活力。与空白对照组相比较,miR-1275模拟物和si-HOXB5的处理显著减弱CNE-1细胞增殖能力(图 3)。
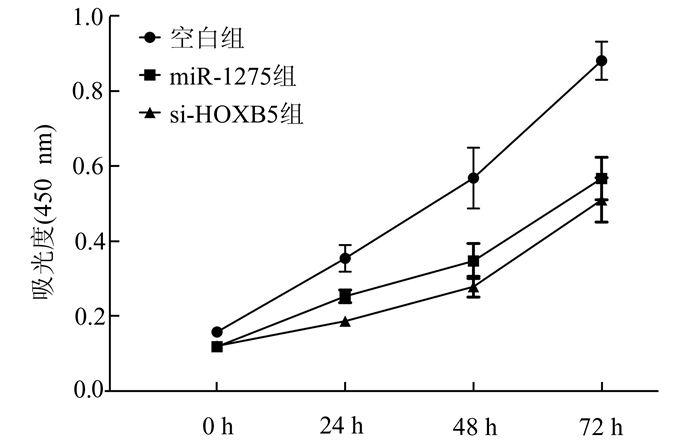
|
图 3 不同时间点不同方法处理CNE-1细胞后细胞增殖能力情况 |
综上所述,鼻咽癌中miR-1275低表达,HOXB5高表达,且HOXB5是miR-1275的靶基因。
3 讨论越来越多的研究表明,大量miRNA在鼻咽癌的发生发展中起到关键作用。Luo[8]发现在鼻咽癌中有48个miRNA异常表达,而这些miRNA大多与细胞增殖、细胞基质黏附和细胞迁移有关。同时这48个miRNA的靶基因参与细胞黏附和p53信号通路等。miR-135b-5p、miR-205-5p、miR-93-5p、miR-650以及miR-183-5p可以作为初发鼻咽癌的新的诊断指标[9]。然而不同miRNA在鼻咽癌发生发展中的作用不尽相同。例如miR-233可以靶向MAFB来抑制鼻咽癌细胞的增殖和迁移[10];miR-4649-3p可以靶向蛋白质酪氨酸磷酸酶SHP-1抑制鼻咽癌细胞的增殖[11];而miR-142-3p可以抑制SOCS6的表达来促进鼻咽癌细胞的增殖[12];miR-29a/b通过调节SPARC和COL3A1的表达水平来促进鼻咽癌细胞的迁移和侵袭[13]。MiR-204在鼻咽癌患者血清中表达下调,其表达与鼻咽癌患者的EB病毒感染、肿瘤的分化程度、淋巴结转移和TNM分期明显相关;同时鼻咽癌患者组织中miR-204低表达者生存时间明显低于高表达者[14]。
HOX转录因子在胚胎发育过程中发挥着重要作用,可以决定细胞命运。大量研究表明,HOX基因参与了多种类型癌症的进展。HOXB5作为其中一员,在乳腺癌组织和细胞系中异常高表达。在ER阳性的乳腺癌细胞系中沉默HOXB5显著降低细胞增殖和侵袭[15]。在胃癌中,HOXB5可以激活Wnt/β-catenin信号通路,促进细胞的转移。我们的实验结果表明,miR-1275在鼻咽癌细胞系中低表达,通过在鼻咽癌细胞中转染miR-1275或HOXB5 siRNA抑制鼻咽癌细胞中HOXB5从而达到抑制鼻咽癌细胞的增殖能力,说明在miR-1275的缺失导致HOXB5的高表达可能在鼻咽癌的发生发展中起到关键作用。
miRNA对靶基因mRNA的作用机制主要有三种方式:①直接降解靶基因——当miRNA与特异性靶基因编码区或非编码区完全配对,可直接降解特异性靶基因mRNA(miRNA只降解与其序列互补配对的mRNA);②抑制特异性靶基因的翻译——当miRNA与特异性靶基因不完全互补结合时,miRNA通过阻遏特异性靶基因的翻译,而不影响特异性靶基因mRNA的稳定性,此种miRNA的作用方式种类较多;③同时包括上述两种作用方式[16, 17]。miR-1275对HOXB5的具体作用机制及其具体的生物学功能非常值得进一步探讨。这为miR-1275及其靶基因HOXB5在鼻咽癌诊疗中可能发挥的作用提供了理论依据。
| [1] | Tang J, He Y, Tian Y. MicroRNA214 promotes proliferation and inhibits apoptosis via targeting Bax in nasopharyngeal carcinoma cells[J]. Mol Med Rep, 2015, 12(4): 6286-6292. DOI: 10.3892/mmr.2015.4168. |
| [2] | Kamran SC, Riaz N, Lee N. Nasopharyngeal carcinoma[J]. Surg Oncol Clin N Am, 2015, 24(3): 547-561. DOI: 10.1016/j.soc.2015.03.008. |
| [3] | Chua ML, Wee JT, Hui EP, et al. Nasopharyngeal carcinoma[J]. Lancet (London, England), 2015, 387(10022): 1012-1024. |
| [4] | Bhardwaj A, Singh S, Singh AP. MicroRNA-based cancer therapeutics: Big hope from small RNAs[J]. Mol Cell Pharmacol, 2010, 2(5): 213-219. |
| [5] | Grimson A, Farh KK, Johnston WK, et al. MicroRNA targeting specificity in mammals: determinants beyond seed pairing[J]. Mol Cell, 2007, 27(1): 91-105. DOI: 10.1016/j.molcel.2007.06.017. |
| [6] | Vidigal JA, Ventura A. The biological functions of miRNAs: lessons from in vivo studies[J]. Trends Cell Biol, 2015, 25(3): 137-147. DOI: 10.1016/j.tcb.2014.11.004. |
| [7] | Agarwal V, Bell GW, Nam JW, et al. Predicting effective microRNA target sites in mammalian mRNAs[J]. Elife, 2015, 4: e05005. DOI: 10.7554/eLife.05005. |
| [8] | Luo Z, Zhang L, Li Z, et al. An in silico analysis of dynamic changes in microRNA expression profiles in stepwise development of nasopharyngeal carcinoma[J]. BMC Med Genomics, 2012, 5: 3. DOI: 10.1186/1755-8794-5-3. |
| [9] | Tang JF, Yu ZH, Liu T, et al. Five miRNAs as novel diagnostic biomarker candidates for primary nasopharyngeal carcinoma[J]. Asian Pac J Cancer P, 2014, 15(18): 7575-7581. DOI: 10.7314/APJCP.2014.15.18.7575. |
| [10] | Yang W, Lan X, Li D, et al. MiR-223 targeting MAFB suppresses proliferation and migration of nasopharyngeal carcinoma cells[J]. BMC Cancer, 2015, 15: 461. DOI: 10.1186/s12885-015-1464-x. |
| [11] | Pan X, Peng G, Liu S, et al. MicroRNA-4649-3p inhibits cell proliferation by targeting protein tyrosine phosphatase SHP-1 in nasopharyngeal carcinoma cells[J]. Int J Mol Med, 2015, 36(2): 559-564. DOI: 10.3892/ijmm.2015.2245. |
| [12] | Qi X, Li J, Zhou C, et al. MiR-142-3p suppresses SOCS6 expression and promotes cell proliferation in nasopharyngeal carcinoma[J]. Cell Physiol Biochem, 2015, 36(5): 1743-1752. DOI: 10.1159/000430147. |
| [13] | Qiu F, Sun R, Deng N, et al. MiR-29a/b enhances cell migration and invasion in nasopharyngeal carcinoma progression by regulating SPARC and COL3A1 gene expression[J]. PLoS One, 2015, 10: e0120969. DOI: 10.1371/journal.pone.0120969. |
| [14] |
彭涛, 周绪红, 胡敏, 等. miRNA-204在鼻咽癌中的表达及临床意义[J].
临床耳鼻咽喉头颈外科杂志, 2014, 22(14): 1780-1782.
Peng T, Zhou XH, Hu M, et al. Clinical significance of miRNA-204 in nasopharygeal carcinoma[J]. J Clin Otorhinolaryngol Head Neck Surg (China), 2014, 22(14): 1780-1782. |
| [15] | Lee JY, Hur H, Yun H J, et al. HOXB5 promotes the proliferation and invasion of breast cancer cells[J]. Int J Biol Sci, 2015, 11(6): 701-711. DOI: 10.7150/ijbs.11431. |
| [16] | Lee YS, Nakahara K, Phan JW, et al. Distinct roles for Drosophila Dicer-1 and Dicer-2 in the siRNA/miRNA silencing pathways[J]. Cell, 2004, 117(1): 69-81. DOI: 10.1016/S0092-8674(04)00261-2. |
| [17] | Sotillo E, Thomas-Tikhonenko A. Shielding the messenger (RNA): microRNA-based anticancer therapies[J]. Pharmacol Ther, 2011, 131(1): 18-32. DOI: 10.1016/j.pharmthera.2011.04.006. |
 2018, Vol. 39
2018, Vol. 39


