视网膜色素变性(retinitis pigmentosa, RP)是一类感光细胞及色素上皮细胞病变导致的具有高度遗传异质性的视网膜变性疾病。临床表现有夜盲、向心性视野缺损甚至失明等,各年龄阶段均可发病。眼底典型表现为骨细胞样色素沉着、视网膜血管变细、视盘蜡黄等。该病的患病率约为1/3 000-1/8 000,无明显性别差异,是世界范围内失明的主要原因之一[1]。RP是单基因遗传疾病,20%-25%为常染色体显性遗传模式(autosomal dominant RP, ADRP),15%-20%为常染色体隐性遗传模式(autosomal recessive RP,ARRP)。10%-15%为X染色体连锁遗传模式(X-lined RP,XLRP),约30%表现为散发病例(sporadic RP,SRP),其中大部分为隐性遗传;少数表现为双基因突变遗传模式及线粒体遗传模式[2]。目前,人们已鉴定的RP致病基因共60个,其中常染色体显性遗传基因22个,常染色体隐性遗传基因36个,X性连锁遗传基因2个(https://sph.uth.edu/retnet/sum-dis.htm)。其中NR2E3、NRL、RHO、RP1、RPE65五个基因在ADRP和ARRP中均有报道。大部分ARRP的基因比较罕见。单个基因致病的发病率多在5%以下。目前所发现的致病基因只能解释约60%RP患者的发病原因,还有许多RP患者未能找到明确的致病基因[3]。随着测序技术的发展,特别是高通量下一代测序(next-generation sequencing, NGS)的迅猛发展,如全外显子组测序和全基因组测序,更多的致病基因被发现。本研究通过全外显子组测序的方法,在3个中国常染色体隐性遗传的RP家系中探索其致病基因,报告如下。
1 对象与方法 1.1 对象收集3个中国鄂西地区土家族隐性遗传RP家系,抽取3个家系先证者的外周血。本研究经恩施州中心医院伦理委员会同意并遵守《赫尔辛基宣言》中的伦理原则,所有检查及采样均告知被检查对象并签署知情同意书。
1.2 检测项目及诊断标准所有患者均进行详细的病史询问。眼科检查包括验光、眼底检查和照相(TOPCON,日本)、视野(Humphrey750i视野计,德国蔡司公司)、全视野视网膜电图(ERG)(RETI-Scan视觉电生理仪,德国Roland公司),家系B行听力检测。RP的临床表现:①症状:夜盲,进行性视力下降;②体征:典型眼底改变,即视盘呈蜡黄色或变淡,视网膜血管变细,视网膜呈青灰色,有骨细胞样色素沉着;③辅检:早期视野有环形暗点,晚期视野向心性缩窄呈管状;ERG无电位反应,尤其a波、b波在明暗适应状态振幅均重度降低,接近熄灭,b波潜伏期延长。依据病史、症状、体征及视野、视觉电生理特征,对本病可作出诊断。
1.3 致病基因研究 1.3.1 血标本采集及DNA提取以EDTA抗凝管收集3位先证者的外周静脉血5 ml用于提取DNA,经典苯酚-氯仿的方法抽提基因组DNA。-20 ℃保存。
1.3.2 全外显子组测序对先证患者DNA样本进行全外显子测序分析:测序平台:Illumina Genome Analyzer Ⅱ, 平均测序深度:×60。测序分析使用Illumina方法。具体测序方法由千年基因(Macrogen,深圳)公司操作。
1.3.3 致病基因数据分析第一步:排除最小等位基因频率(minor allele frequency, MAF) ≥0.01的变异。将初步获得的变异,包括SNPs和小段插入缺失变异通过dbSNP132,1 000 Genome Project (1 000 G),HapMap,炎黄计划数据库注释,排除MAF≥0.01的变异,此类变异被认为是对功能无影响的变异和公共数据库中的常见变异。
第二步:筛基因。目前,与RP相关的基因都包括在RETNET网站上,结合RETNET网站上收录的300个遗传性视网膜病的致病基因,保留在这300个基因上的变异。
第三步:筛突变。根据遗传方式和致病性筛选符合情况的突变,遗传方式为隐性遗传的保留,突变在SIFT和Polyphen 2中有一个是D(damage)或者not-available(除错义突变外的其他类型突变目前无法预测)的保留。
1.3.4 致病基因家系样本测序验证通过以上三步筛选仅在家系B中发现USH2A的突变(c.6875dupG, p.Ala2293fs)符合条件,将该突变做Sangar测序验证及家系共分离分析。测序引物用DNAStar软件进行设计,由上海生工公司合成引物。家系B成员中的另一个患者及2个正常成员的DNA样本以及正常对照经PCR扩增后,在自动测序仪ABI 3130XL Genetic Analyzer上进行测序。
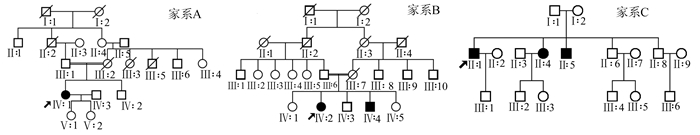
2 结果 2.1 家系遗传方式3个家系,父母均正常,无RP疾病的典型临床特征,子女中至少1人为RP疾病患者,1人正常,但不排除处在疾病早期。3个家系的遗传模式符合典型的常染色体隐性遗传模式。家系图见图 1。
|
图 1 三位先证者的家系图 家系中父母均正常,无RP疾病的典型临床特征,子女中至少1人为RP疾病患者,1人正常,符合常染色体隐性遗传。斜箭头所指为先证者 |
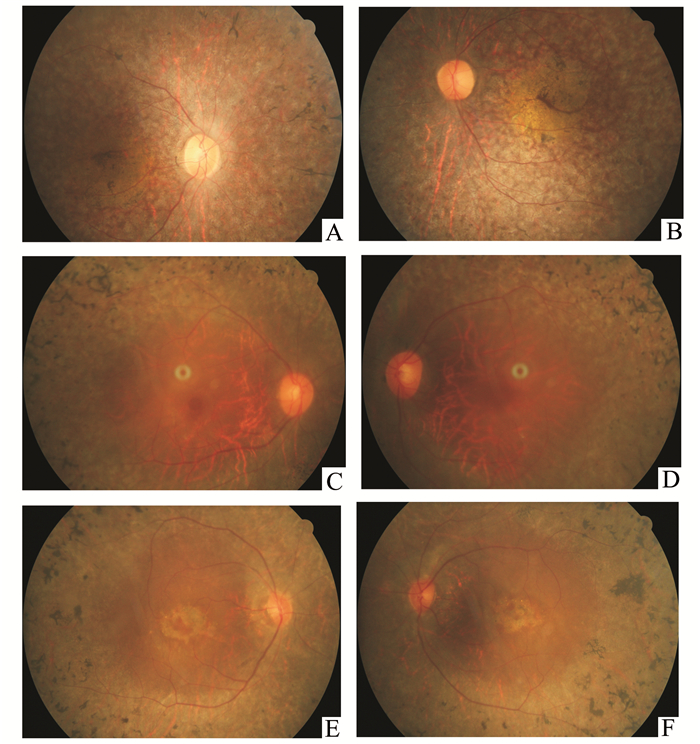
家系A先证者:Ⅳ:1,女,25岁,土家族,家族有近亲结婚史(爷爷和外婆是亲兄妹),自幼(约2岁时)发现视力差,伴有夜盲,现双眼视力:0.02(矫不应), 伴眼球水平震颤。眼底检查显示双眼视网膜色素上皮萎缩,散在骨细胞样色素沉着,黄斑区色素沉着,视网膜血管变细(眼底照片见图 2A,B), 全视野ERG显示明暗适应时a、b波振幅均重度降低,接近熄灭状态(结果未附录)。
|
图 2 三位先证者眼底彩照 A和B分别为家系A先证者Ⅳ:1的右眼和左眼底彩照,见视盘色稍淡,视网膜色素上皮骨细胞样改变,血管变细。C和D分别为家系B先证者Ⅳ:2的右眼和左眼底彩照,见视网膜中周部色素上皮骨细胞样改变。E和F分别为家系C先证者Ⅱ:1的右眼和左眼底彩照,见视网膜色泽晦暗,中周部色素上皮骨细胞样改变,黄斑区色素紊乱 |
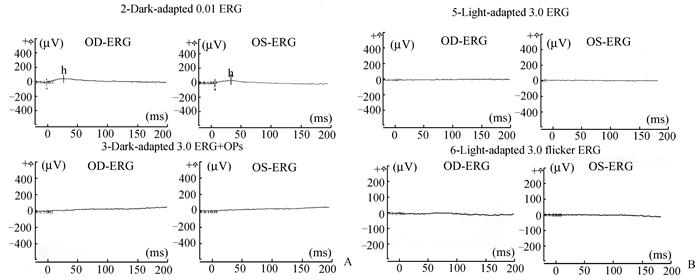
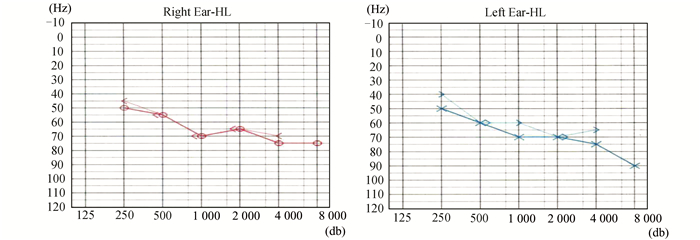
家系B先证者:Ⅳ:2,女,46岁,土家族,家族有近亲结婚史(爷爷和外婆是亲兄妹)。自幼伴有耳聋,十余岁时发现双眼视力逐渐下降,伴有夜盲,现右眼视力:0.08(矫不应),左眼视力:0.15(矫不应)。眼底检查显示双眼视网膜中周部骨细胞样色素沉着,视网膜血管变细(眼底照片见图 2C,D)。全视野ERG显示明暗适应时a、b波振幅严重降低,接近熄灭状态,b波潜伏期延长(见图 3A, B)。听力检查双耳中度听力障碍(见图 4)。
|
图 3 家系B先证者全视野ERG的检查结果 A和B分别为家系B先证者Ⅳ:2的暗适应和明适应结果,提示a、b波振幅均严重降低,接近熄灭状 |
|
图 4 家系B先证者的听力检查结果 家系B先证者Ⅳ:2的听力检查结果提示双耳中度听力障碍 |
家系C先证者:Ⅱ:1,男,30岁,土家族,家族无近亲结婚史,10岁左右发现视力逐渐下降伴有夜盲,现右眼视力:0.1,左眼视力0.05(均矫不应),双眼底视盘色可,视网膜色泽晦暗,中周部网膜色素上皮骨细胞样改变,血管变细,黄斑区色素紊乱(眼底照片,图 2E, F)。全视野ERG显示明暗适应时a、b波振幅显著降低,接近熄灭状态,b波潜伏期延长(结果未附录)。
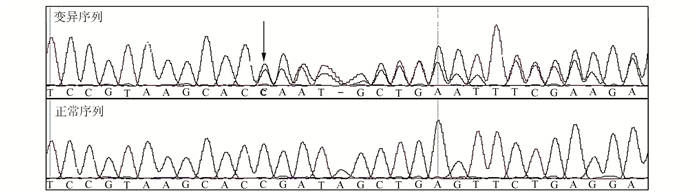
2.3 外显子测序及数据分析本研究对3例先证者进行了全外显子组测序,平均测序深度为60×。在排除MAF≥0.01的变异时,从134 999条记录中找到18 581个符合变异。结合RETNET网站上收录的基因,第二步筛选基因后发现233个突变,第三步筛选突变后剩余纯合的突变只有三个,其中一个在X染色体上被排除,一个预测不致病被排除。只有在家系B先证者Ⅳ:2中发现USH2A的突变(c.6875dupG, p.Ala2293fs)符合条件(见图 5)。由于是框移突变,现有的预测软件无法预测其致病性。结合家系的病例资料,我们高度怀疑USH2A突变致病的可能性。于是在家系B中进行共分离分析。我们设计了针对该基因的引物。并用Sangar测序法对该家系2个健康成员和另一患病者的DNA样本进行测序验证。结果在正常未患病家人中也发现有这个突变,进一步在我们收集的正常对照中进行测序,同样发现了这个突变,说明这个突变不是致病的突变,故排除该突变致病的可能。
|
图 5 家系B先证者Ⅳ:2中发现USH2A基因的突变(c.6875dupG, p.Ala2293fs) 上排为发生突变序列,下排为正常对照序列。箭头所指为突变起始点 |
RP可分为非综合征型RP(nonsyndromic RP或typical RP)和综合征RP(syndromic RP),非综合征型RP约占所有病例的65%。在非综合征型RP中,约30%-40%为常染色体显性遗传,50%-60%为常染色体隐性遗传,5%-15%为X连锁遗传。还有20%-30%的RP以综合征的形式表现。可导致RP的综合征有30余种,最常见的有Usher综合征和Bardet-Biedl综合征[4]。Usher综合征以耳聋和RP为特征的一种常染色体隐性遗传病,是最常见的引起耳聋伴眼盲的疾病。发病率是1/16 000-1/50 000。该综合征分为3型:Usher综合征Ⅰ型(USH1)、Ⅱ型(USH2)、Ⅲ型(USH3)[5]。USH2型以婴幼儿期出现听力损害和青春期出现视力损害为特征[6]。在我们收集的3个家系中家系B的先证者除了有青春期出现的视力损害外,还合并有早期出现的耳聋,可以诊断为Usher综合征Ⅱ型。目前已找到3个USH2的致病基因:USH2A、GPR98 (MIM: 602851)和WHRN (MIM:607928)。USH2A (MIM: 608400)也是Usher综合征Ⅱ型的致病基因,其突变可以解释19%-23%的ARRP的病因,在美国是最常见的RP致病基因[7]。
在本研究中,通过对3个中国土家族常染色体隐性遗传的RP家系进行全外显子测序及生物信息学分析,虽然在家系B的先证者中找到USH2A基因的突变(c.6875dupG, p.Ala2293fs),但进一步研究不符合家系共分离。因而在这3个常染色体隐性遗传的RP家系未能找到致病突变。究其原因可能有以下几个方面:①RP的遗传机制仍未完全阐明。目前,虽然国际上已经鉴定出众多的RP致病基因位点。然而这些基因只能解释其中大约60%患者的发病。尚有约40%的RP患者不能被已报道的RP致病基因所解释,因此,仍需继续探索未知的RP致病基因。②RetNet基因无法完全涵盖RP的致病基因。我们筛查的基因来源于RetNet基因网站,目前收录在RetNet网站上的RP基因有300个,有可能家系的致病基因是一个未知的基因,这样突变就无法筛出来。我们发现了一个USH2A基因的突变,但不符合家系共分离分析。Xu等通过全外显子组测序,在RetNet基因中有57.3%的RP先证者发现潜在致病突变,仍有近40%的RP患者未能发现致病突变。RetNet基因预测致病变异在90个家系中发现有16个家系不符合家系共分离[8]。③全外显子测序也有局限性。我们做的是全外显子测序,外显子序列只占全基因组序列的1%。全外显子组测序虽然给遗传性疾病致病基因的检测和分子诊断提供了更广阔的空间,但也存在一些局限性。例如不能覆盖非编码区和基因调节区,不能检测线粒体基因突变,不能检测大片段缺失重复的结构变异,不能检测基因组拷贝数变异和表观遗传学修饰缺陷等。未检测到的突变有可能存在上述基因组缺陷,可进一步做全基因组扫描才能筛到。但是非外显子区段的序列功能很多都未阐明,不足以作为筛选的条件,故未行全基因组扫描。④全外显子组测序发现的变异中也可能存在着未被确认的与疾病相关的新基因。因而这些家系虽未找到突变,但对于寻找RP新的致病原因提供了有价值的线索。我们将保留三个家系的所有数据,待RP的致病机理得到进一步阐明时做进一步的筛选。
| [1] | Ali MU, Rahman M, Cao J, et al. Genetic characterization and disease mechanism of retinitis pigmentosa; current scenario[J]. 3 Biotech, 2017, 7(4): 251. DOI: 10.1007/s13205-017-0878-3. |
| [2] | Ferrari S, Di Iorio E, Barbaro V, et al. Retinitis pigmentosa: genes and disease mechanisms[J]. Curr Genomics, 2011, 12(4): 238-249. DOI: 10.2174/138920211795860107. |
| [3] | Berger W, Kloeckener-Gruissem B, Neidhardt J. The molecular basis of human retinal and vitreoretinal diseases[J]. Prog Retin Eye Res, 2010, 29(5): 335-375. DOI: 10.1016/j.preteyeres.2010.03.004. |
| [4] | Hartong DT, Berson EL, Dryja TP. Retinitis pigmentosa[J]. Lancet, 2006, 368(9549): 1 795-1 809. DOI: 10.1016/S0140-6736(06)69740-7. |
| [5] | Bonnet C, El-Amraoui A. Usher syndrome (sensorineural deafness and retinitis pigmentosa): pathogenesis, molecular diagnosis and therapeutic approaches[J]. Curr Opin Neurol, 2012, 25(1): 42-49. DOI: 10.1097/WCO.0b013e32834ef8b2. |
| [6] | Seeliger MW, Fischer MD, Pfister M. Usher syndrome: clinical features, diagnostic options, and therapeutic prospects[J]. Ophthalmologe, 2009, 106(6): 505-511. DOI: 10.1007/s00347-008-1888-7. |
| [7] | Mcgee TL, Seyedahmadi BJ, Sweeney MO, et al. Novel mutations in the long isoform of the USH2A gene in patients with Usher syndrome type Ⅱ or non-syndromic retinitis pigmentosa[J]. J Med Genet, 2010, 47(7): 499-506. DOI: 10.1136/jmg.2009.075143. |
| [8] | Xu Y, Guan L, Shen T, et al. Mutations of 60 known causative genes in 157 families with retinitis pigmentosa based on exome sequencing[J]. Hum Genet, 2014, 133(10): 1 255-1 271. DOI: 10.1007/s00439-014-1460-2. |
 2018, Vol. 39
2018, Vol. 39


