宫颈癌是最常见的妇科恶性肿瘤之一,发病率居女性恶性肿瘤的第3位,严重威胁着妇女健康。全世界每年约有53万新发病例,其中超过85%发生于发展中国家。我国宫颈癌发病率居世界第2位[1]。高危型HPV感染是宫颈癌发生的主要病因,尽管HPV感染的筛查已普及,但宫颈癌患者治疗后复发与转移的概率并未得到明显改善。因此,寻找与宫颈癌发生发展相关的分子生物学指标以及提高治疗疗效的特异性靶点,有望从整体提高宫颈癌的无疾病生存率。转化生长因子Ⅱ型受体 (transforming growth factor-beta type Ⅱ receptor,TGFBR2)通过与转化生长因子(TGF)-β结合,将信号传递至细胞内,从而发挥TGF-β对细胞生长的抑制作用[2]。TGFBR2蛋白的突变或低表达,可降低TGF-β通路对细胞生长的抑制作用,从而在许多肿瘤组织中,可检测到TGFBR2的突变或低表达[2]。然而,其在宫颈癌发生发展及治疗中的作用尚不十分明确,还需要进一步研究探索。因此,本研究采用组织芯片联合免疫组化的方法检测TGFBR2蛋白在慢性宫颈炎、宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)和宫颈癌组织中的表达,并研究其对临床的意义,为未来将其作为宫颈癌治疗的靶点及预后的预测指标提供理论依据。
1 资料与方法 1.1 主要试剂所用抗体及试剂:TGFBR2及hTERT一抗(鼠抗人单克隆抗体)购于英国Abcam公司。免疫组化通用SP试剂盒购于碧云天生物技术有限公司,其他常规免疫组化相关试剂均为国产分析纯试剂。
1.2 标本来源从贵州泛谱生物科技有限公司购买包含13例慢性宫颈炎及102例CIN组织的组织芯片。同时,收集武汉大学中南医院2003年1月至2012年12月期间收治的167例初治宫颈癌患者术后完整切除的病理标本,均经手术后病理诊断证实为宫颈癌患者并具有完整的临床资料。入组患者术前均未进行放疗、化疗等辅助治疗,且其组织蜡块均可进行免疫组织化学研究。我院病案室调阅入选病例的相关临床与病理资料且根据国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)2009年标准进行临床分期,所有患者进行随访,随访时间从第一次治疗后开始至患者死亡或最后一次随访时间,最后一次随访时间为2014年1月30日。
1.3 组织芯片构建根据常规HE染色的结果,显微镜下选定待观察区,并作好标记。交由上海芯超生物科技有限公司协助进行组织芯片的制作。构建孔径和孔间距均为1.5 mm的组织阵列蜡块。标记好受体蜡块中组织阵列的起始点位置,记录好排列顺序。按病理科实验室常规方法制片,切成厚4 mm的组织微阵列。HE切片显示取样组织边缘锐利,无明显组织挤压和结构变形,所取组织微阵列符合研究要求。
1.4 免疫组化(IHC)检测采用链霉卵白素-过氧化物酶连结(SP)法检测TGFBR2蛋白表达,按照试剂盒说明进行操作,抗原修复液为枸橼酸缓冲液(pH 6.0) 。通过预实验后确定TGFBR2蛋白抗体滴度为1:100。
1.5 结果判断镜下观察,随机选择5个高倍镜视野(×400倍)进行统计,计数5个视野内蛋白阳性表达的细胞数以及肿瘤细胞的总数,同时观察蛋白表达显色的强弱程度。阳性强度判定采用半定量方法,统计阳性细胞数占总的肿瘤细胞数的百分比。评分标准如下:阳性细胞比例<5%视为0分,即阴性表达,>5%即视为阳性表达,具体评分:5%-25%之间为1分,25%-50%之间为2分,50%-75%之间为3分,>75%为4分;显色强度评分:不着色为0分,浅黄色为1分,黄色为2分,棕褐色为3分。阳性表达率与显色度相乘,计算结果,分为四类:0-1代表表达阴性(-),2-4弱表达(+),5-8中度表达(++),以及≥9高表达(+++)。
1.6 截断值(Cut-off)的选择为了研究蛋白表达水平和肿瘤临床病理特征的表达之间的关系,采用ROC曲线方法选取Cut-off值来定义TGFBR2蛋白的表达高低。首先,我们根据临床病理特征将病例为以下几组:FIGO分期分类(ⅠB与ⅡA-ⅡB),肿瘤大小(<4 cm与≥4 cm),盆腔淋巴结转移情况(有与无),阴道受侵(是与非),宫旁浸润(有与无),复发状态(有与无),和生存状态(生存或死亡)。Cut-off值是曲线上的敏感性和特异性之和为最大的点。
1.7 统计学分析采用SPSS 20.0软件进行统计学分析。计数资料的比较采用χ2检验,采用Kaplan-Meier法和Log rank检验进行生存分析,多因素分析采用Cox比例风险模型,检验水准α=0.05。
2 结果成功染色11例慢性宫颈炎、97例CIN及164例宫颈癌组织。至随访终点,164例宫颈癌患者1年、3年和5年生存率分别为95.7%、80.4%、69.6%。
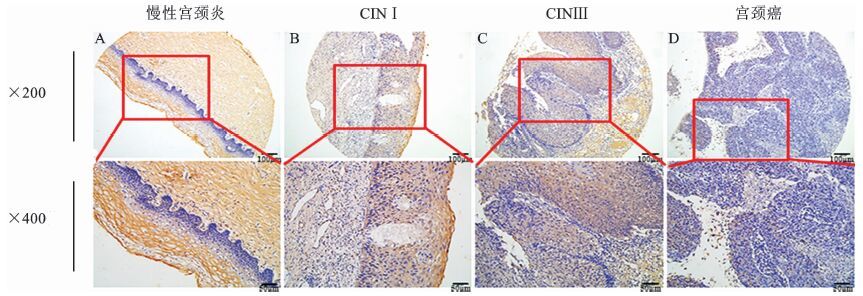
2.1 TGFBR2蛋白在不同宫颈病变中的表达TRFBR2在不同宫颈病变中免疫组化表达情况如图 1。在慢性宫颈炎、CINⅠ、CINⅡ、CINⅢ及宫颈癌组织中,TGFBR2蛋白表达从高到低表达顺序依次为慢性宫颈炎(5/11,45.5%)>CINⅠ(14/51,27.4%)>CINⅡ(4/19,21.1%)>CINⅢ(2/27,7.4%)>宫颈癌(5/164,3.0%)(P=0.000,P<0.05) ,差异有统计学意义(P<0.05,表 1) 。另外,慢性宫颈炎组和CINⅢ或宫颈癌组之间的表达水平也具有显著差异(P=0.034,P=0.001,P<0.05) ,TGFBR2蛋白在CINⅠ与宫颈癌的表达水平也有显著差异(P=0.000,P<0.05) 。
| 表 1 TGFBR2蛋白在宫颈不同组织中的表达水平 |
|
图 1 TGFBR2在不同宫颈组织中的免疫组化染色情况 A、B、C、D:分别代表慢性宫颈炎、CIN Ⅰ、CIN Ⅲ和宫颈癌组织中,TGFBR2表达的情况 |
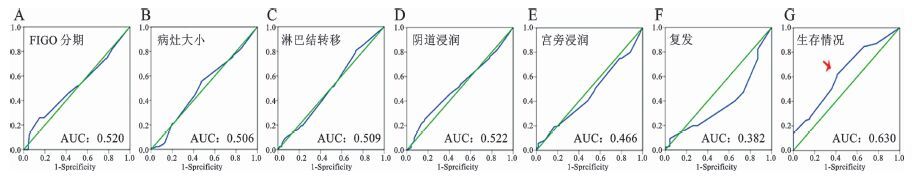
为了更好地研究TGFBR2蛋白表达水平和宫颈癌临床病理特征之间的关系,采用ROC曲线方法分析蛋白表达的截断值。如图 2所示,TGFBR2蛋白表达在以生存状态作为金标准时,具有曲线下最大面积(AUC)0.630。曲线上具有最大的特异性和灵敏度的点定义为蛋白表达截断值1.13。确定截断值后,我们定义宫颈癌组织中蛋白表达水平评分低于截断值为低表达,而高于截断值被定义为高表达。
|
图 2 宫颈癌组织中TGFBR2截断值的ROC曲线图 A.临床分期(P=0.839) ;B.局部病灶大小(P=0.714) ;C.淋巴结转移情况(P=0.019) ;D.阴道浸润(P=0.786) ;E.宫旁浸润(P=0.069) ;F.复发(P=0.741) ;G.生存状态(P=0.008) |
164例宫颈癌症患者的平均年龄为45(23-78) 岁,平均随访时间(从初次诊断时间到死亡或末次随访)为46个月(5-123月),ⅠB期患者65例(39.6%),ⅡA期患者54例(32.9%),ⅡB期患者45例(27.4%),无淋巴结转移者102例(62.2%),有淋巴结转移的62例(37.8%),截止最近一次随访时间存活的患者86例(52.4%),死亡患者78例(47.6%),其他具体临床数据见下表(表 2) 。结果表明,TGFBR2表达水平和年龄、绝经状态、肿瘤大小、阴道受侵、宫旁浸润等临床病理特征无显著相关性(P>0.05) 。然而,TGFBR2表达水平与FIGO分期、组织学类型、分化程度、盆腔淋巴结转移、复发和生存状态显著相关(P<0.05) ,即FIGO分期越晚、分化程度越低、淋巴结转移阳性、复发或者死亡组患者TGFBR2蛋白表达水平越低。
| 表 2 TGFBR2蛋白表达水平与宫颈癌临床病理特征的关系 |
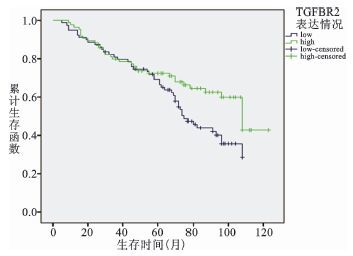
随访的164例宫颈癌患者中,TGFBR2高表达和低表达患者的5年生存率分别为72.4%和69.2%,二者间差异有显著统计学意义(P<0.05,图 3) 。
|
图 3 TGFBR2蛋白表达情况与164例宫颈癌患者总生存时间的生存分析 |
单因素分析(表 3) 显示,盆腔淋巴结转移、分化程度、临床分期、复发和TGFBR2表达水平可预测宫颈癌的预后(P<0.05) 。多因素分析结果显示,盆腔淋巴结转移和TGFBR2的表达是影响宫颈癌患者生存时间独立的预后因素(P<0.05,表 4) 。
| 表 3 164例宫颈癌患者预后因素的单因素分析 |
| 表 4 164例宫颈癌患者的多因素分析 |
宫颈癌是最常见的妇科恶性肿瘤之一,严重威胁了妇女健康。宫颈癌的发生是一个由多因素、多种分子参与的复杂病理过程。宫颈癌发生发展的确切机制尚未完全阐明,其治疗效果也有待提高。因此,寻找与宫颈癌发生发展相关的分子生物学指标以及提高治疗疗效的特异性靶点,是亟需解决的问题。如果能够在分子水平发现宫颈癌复发转移的机理,并探索其具体分子机制,从而建立特异性的治疗方法,可为宫颈癌的预防和根治提供重要理论支持。
已有研究表明TGF-β信号通路具有调节细胞周期、细胞凋亡、免疫抑制、上皮-间充质转型、血管形成、肿瘤迁徙和转移等肿瘤生物学特性的功能[3], 在肿瘤的发生发展中起着重要的作用。TGFBR2作为该通路中首个与细胞因子TGF-β结合并将信号传递至细胞内的受体蛋白, 其基因定位在染色体3p22区域, 编码蛋白相对分子量大小约(70-80)×103。近来的一些研究表明, TGFBR2在肿瘤中的表达缺失或下降能促进肿瘤的发生和进展, 这提示TGFBR2是抑癌基因。
TGFBR2基因的最常见的突变位点位于PolyA10相关的重复序列,突变后的TGFBR2基因异常表达,直接影响肿瘤细胞恶性程度[4]。在正常人乳腺细胞向乳腺癌细胞演进的过程中,TGFBR2基因表达逐渐下降,甚至表达完全缺失,提示TGFBR2受体基因缺失可以直接影响TGF-β通路的生理功能,导致细胞不典型增生或发生癌变。在喉癌及结肠癌中同样发生这一现象,表明TGFBR2蛋白的表达水平可以作为预测肿瘤相关预后指标之一,直接指导临床诊疗[5]。有研究表明在TGFBR2缺失或减少的肿瘤细胞中,重新表达TGFBR2后可恢复其对细胞的生长抑制作用,因此TGFBR2被认为是一种抑癌基因[6, 7]。
TGFBR2表达缺失的小鼠出现肛门和外阴部的肿瘤发生[8],这一研究表明,TGFBR2表达的缺失,可促进上皮细胞向肿瘤转化[9]。体内外研究表明,可溶性TGFBR2可抑制胰腺癌和乳腺癌细胞的生长、侵袭和转移[10]。另有研究表明,法尼基转移酶抑制剂L-744,832可通过调控TGFBR2的表达水平而提高胰腺癌细胞的放射敏感性[11]。这些现象表明,TGFBR2在肿瘤上皮细胞癌变的过程中,发挥重要作用,是抗肿瘤治疗的靶点。
在本研究中, 我们发现TGFBR2在慢性宫颈炎组织、宫颈上皮内瘤变组织及宫颈癌组织中的表达呈现逐渐降低的趋势, 这些表达的差异具有统计学意义。除此之外, 我们发现TGFBR2的低表达与FIGO分期、组织学类型、分化程度、盆腔淋巴结转移、复发和生存状态负相关, 差异具有统计学意义; Kaplan-Meier分析结果显示, TGFBR2低表达的患者, 其总体生存率(OS)低于TGFBR2高表达的患者, 差异具有统计学意义; 单因素分析显示, 盆腔淋巴结转移、分化程度、临床分期、复发和TGFBR2表达水平与宫颈癌患者预后相关, 差异具有统计学意义。多因素分析结果显示,盆腔淋巴结转移和TGFBR2的表达是影响宫颈癌患者预后的独立因素。
本研究结果类似于其他研究者所发现的TGFBR2在多种肿瘤组织中低表达的结果。因此, TGFBR2低表达可能与宫颈癌侵袭力、转移性等恶性生物学行为密切相关, 可能成为肿瘤诊断、预后判断的标志之一, 为应用TGFBR2作为靶位点进行基因免疫治疗宫颈癌提供了重要的实验依据。 总之, 我们的研究表明, TGFBR2基因表达下调可能在宫颈癌的发生和发展中起着重要的作用, 并与宫颈癌的转移、预后及转归相关, 其具体机制及其在抗肿瘤治疗中的作用可能为宫颈癌靶向治疗提供新的理论依据。
| [1] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics,2012[J]. Cancer J Clin, 2015, 65(2): 87-108. DOI: 10.3322/caac.21262. |
| [2] | Drabsch Y, ten Dijke P. TGF-beta signalling and its role in cancer progression and metastasis[J]. Cancer Metastasis Rev, 2012, 31(3-4): 553-568. DOI: 10.1007/s10555-012-9375-7. |
| [3] | Derynck R, Akhurst RJ. Differentiation plasticity regulated by TGF-beta family proteins in development and disease[J]. Nat Cell Biol, 2007, 9(9): 1000-1004. DOI: 10.1038/ncb434. |
| [4] | Engle SJ, Ormsby I, Pawlowski S, et al. Elimination of colon cancer in germ-free transforming growth factor beta 1-deficient mice[J]. Cancer Res, 2002, 62(22): 6362-6366. |
| [5] | Fukai Y, Fukuchi M, Masuda N, et al. Reduced expression of transforming growth factor-beta receptors is an unfavorable prognostic factor in human esophageal squamous cell carcinoma[J]. Int J Cancer, 2003, 104(2): 161-166. DOI: 10.1002/(ISSN)1097-0215. |
| [6] | Yamamoto N, Imai J, Watanabe M, et al. Restoration of transforming growth factor-beta type II receptor reduces tumorigenicity in the human adrenocortical carcinoma SW-13 cell line[J]. Horm Metab Res, 2006, 38(3): 159-166. DOI: 10.1055/s-2006-925185. |
| [7] | Lampropoulos P, Zizi-Sermpetzoglou A, Rizos S, et al. TGF-beta signalling in colon carcinogenesis[J]. Cancer Lett, 2012, 314(1): 1-7. DOI: 10.1016/j.canlet.2011.09.041. |
| [8] | Guasch G, Schober M, Pasolli HA, et al. Loss of TGFbeta signaling destabilizes homeostasis and promotes squamous cell carcinomas in stratified epithelia[J]. Cancer Cell, 2007, 12(4): 313-327. DOI: 10.1016/j.ccr.2007.08.020. |
| [9] | French D, Belleudi F, Mauro MV, et al. Expression of HPV16 E5 down-modulates the TGFbeta signaling pathway[J]. Mol Cancer, 2013, 12: 38. |
| [10] | Nagaraj NS, Datta PK. Targeting the transforming growth factor-beta signaling pathway in human cancer[J]. Expert Opin Investig Drugs, 2010, 19(1): 77-91. DOI: 10.1517/13543780903382609. |
| [11] | Alcock RA, Dey S, Chendil D, et al. Farnesyltransferase inhibitor(L-744,832) restores TGF-beta type Ⅱ receptor expression and enhances radiation sensitivity in K-ras mutant pancreatic cancer cell line MIA PaCa-2[J]. Oncogene, 2002, 21(51): 7883-7890. DOI: 10.1038/sj.onc.1205948. |
 2017, Vol. 38
2017, Vol. 38

