表观遗传学变异在白血病的发生、发展和转移中发挥重要作用。组蛋白甲基转移酶EZH2是特异性H3K27甲基转移酶,通过与DNA甲基转移酶(DNMT1)合作,致使靶基因CpG岛区DNA甲基化导致靶基因的永久性沉默,从而参与异染色质的形成及基因转录调控[1]。研究表明EZH2在多种恶性实体肿瘤组织中表达异常增高,并且具有癌基因的活性[2]。近来研究发现EZH2在高危骨髓增生异常综合征患者及急性髓系白血病(acute myelogenous leukemia, AML)患者中的表达水平显著高于低危骨髓异常增生综合征(MDS)患者及正常人[3, 4],提示EZH2在髓系恶性肿瘤的发生发展中发挥重要作用。但是,DNMT1的表达在AML中有何临床意义?EZH2在AML中的表达与DNMT1有无相关性?目前国内还未见相关报道。本研究就DNMT1和EZH2在AML中的表达及其相关性,以及与AML临床特征、预后的关系作初步探讨,为急性白血病的治疗提供新的思路。
1 对象与方法 1.1 对象50例初治AML患者来自2012-2015年本院血液化疗科收治的患者,所有病例均经骨髓形态细胞学检查、免疫组织化学染色或流式细胞术免疫分型确诊。按照FAB白血病诊断分型标准[5],其中M1 8例,M2 13例,M4 12例,M5 17例。男33例,女17例;中位年龄42.5(12-62)岁;中位白细胞计数(WBC)为38.9 (1.9-359.7)×109/L;外周血原幼稚细胞比例(PB)中位数为61% (5%-87%)。对照组为30例正常供者。所有标本的采集均获得我院伦理委员会批准并征得患者或者家属的同意。
1.2 骨髓单个核细胞分离常规骨髓穿刺,抽取患者骨髓液3-5 ml,肝素抗凝,采用淋巴细胞分离液分离出骨髓单个核细胞,PBS洗涤2遍后加1 ml Trizol反复吹打至无沉淀,-80 ℃保存备用。
1.3 总RNA提取按Trizol说明书进行操作抽提总RNA。DEPC水溶解后采用分光光度计测定RNA的浓度和纯度,A260/A280大于1.8方可用于后续逆转录。
1.4 逆转录反应按照TAKARA公司的PrimeScript逆转录试剂盒说明书进行。将1 μg总RNA,1 μl Oligo (dT)18,1 μl dNTPmix充分混匀后,置65 ℃作用5 min后迅速冰上冷却,再加入4 μl 5×PrimeScript缓冲液,1 μl Ribonuclease Inhibitor,最后加入1 μl Enzyme Mix逆转录酶(200 U/μl)至终体积为20 μl,42 ℃作用1 h,70 ℃作用10 min后冰上冷却,获得的cDNA第一链立即行PCR或-80 ℃冰箱保存待用。
1.5 荧光定量PCR应用SYBR Green实时荧光定量PCR试剂盒(Applied Biosystems)进行检测。EZH2上游引物:5’-GACCCTGACCTCTGTCTTACTT-3’,下游引物:5’-GATGGTGCCAGGCAATAGATG-3’。DNMT1上游引物:5’-AACCTTCACCTAGCCCCAG-3’,下游引物:5’-CTCATCCGATTTGGCTCTTCA-3’。内参GAPDH上游引物:5’-TGAAGGTCGGAGTCAACGG-3’,下游引物5’-CTGGAAGATGGTGATGGGATT-3’。PCR扩增条件:95 ℃30 s,95 ℃ 5 s,60 ℃ 40 s,40个循环。所有反应设置3个复孔。采用相对定量法,以2-ΔCt表示标本中目的基因的相对表达量,其中ΔCt=(CtEZH2/ CtDNMT1-CtGADPH)。
1.6 统计学方法应用SPSS 16.0统计软件分析,数据均以均数±标准差(x±s)表示。DNMT1表达水平用2-ΔCt表示,经乘以1 000后取lg数据转换后符合正态分布,选用两样本t检验或校正t检验;相关分析选用Pearson相关,Kaplan-Meier法绘制生存曲线,log-rank法进行生存分析。P < 0.05认为有统计学意义。
2 结果 2.1 DNMT1在AML患者中的表达荧光定量PCR结果显示,50例AML患者骨髓细胞中DNMT1 mRNA的表达值为2.72±0.73,显著高于30例正常供者0.89±0.27 (P < 0.01)。
2.2 EZH2在AML中的表达及其与DNMT1的相关性EZH2在50名AML患者骨髓细胞中的表达水平为4.39±1.06,显著高于30例正常供者的1.87±0.33(P < 0.01)。相关性分析显示,EZH2 mRNA在AML患者骨髓细胞中的表达水平与DNMT1 mRNA的表达水平均呈显著正相关,相关系数r=0.51(P=0.002),结果见图 1。
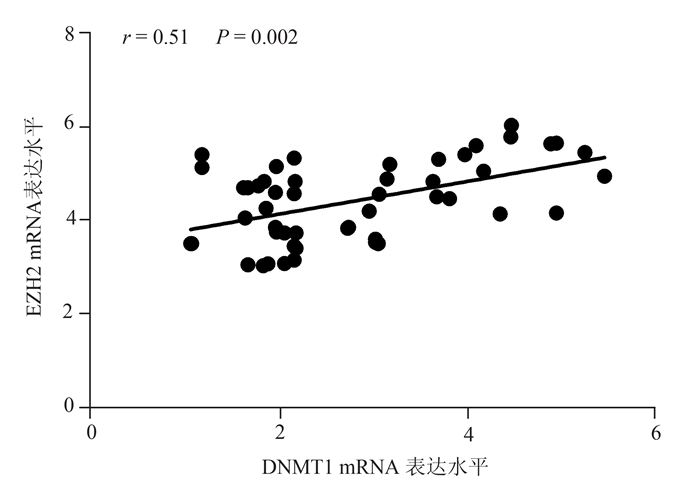
|
图 1 DNMT1表达水平与EZH2表达水平呈正相关 |
AML患者骨髓细胞中的DNMT1 mRNA表达水平与外周血幼稚细胞比例≥60%(P < 0.05)、WBC≥50×109/L (P < 0.05)显著相关,而与性别、年龄、骨髓中幼稚细胞比例、LDH水平以及染色体核型相关预后均不相关。结果见表 1。
| 表 1 DNMT1表达水平与AML患者临床特征之间的关系(x±s) |
所有病例中位随访时间为16(3-43)个月,19例(38%)患者死亡。以DNMT1 mRNA表达水平中位值2-ΔCt=2.16作为截断值,将DNMT1在AML中的表达分为高表达组和低表达组。Kaplan-Meier生存分析表明,DNMT1高表达组患者中位生存时间15个月(95%CI:9-19个月),显著低于DNMT1低表达组患者的32个月(95%CI:27-40个月),差异有统计学意义(P=0.006)。
3 讨论急性髓系白血病(AML)是发生于造血干/祖细胞的恶性增殖性疾病。表观遗传学变异在白血病的发生、发展和转移中发挥重要作用。近年来,染色体甲基化异常逐渐成为AML研究的热点,AML中存在一组基因的高度甲基化,导致这些基因表达的沉默或抑制,从而促进正常造血干细胞向白血病细胞的转化。EZH2基因是果蝇ZESTE基因增强子的人类同源物,其编码蛋白含有高度保守的SET结构域,可甲基化组蛋白H3K27,通过调节染色体组蛋白的甲基化状态而沉默分化基因[6]。
EZH2导致靶基因高度失活的机制有两种:一种是通过与DNA甲基转移酶(DNMT1)合作,致使靶基因CpG岛区DNA甲基化导致靶基因的永久性沉默;另一种是先通过PRC2(多梳抑制复合物)催化H3K27me3,甲基化的H3K27再作为锚定点结合HPC,再招募PRC1的其他蛋白结合至靶基因的polycomb反应元件来共同完成的[2]。DNMT1是介导DNA甲基化的主要元件,其对沉默靶基因的甲基化作用中受到了EZH2作为上游因子的调控作用[7]。我们前期的研究表明EZH2在AML中高表达,且与临床高白细胞和血清LDH水平升高显著相关,同时EZH2高表达患者预后较E2H2低表达者差[4]。然而DNMT1在AML中的表达及其与EZH2的表达有无相关性目前尚不清楚。
在本研究中,我们应用荧光定量PCR方法检测了50例AML患者DNMT1的表达情况,发现DNMT1在AML患者的骨髓细胞中显著高表达,而且其表达水平与其上游调控基因EZH2呈明显正相关关系。国内冯琳等[8]研究发现DNMT1在儿童急性白血病中也呈现高表达,阳性率高达73.2%。乔淑凯等[9]研究发现DNMT1基因在成人急性白血病患者有异常高表达,其表达水平与抑癌基因p15INK4B、mdr1表达呈明显负相关。这些研究结果提示DNMT1与EZH2相互作用,调控了抑癌基因的启动子甲基化,导致其转录失活,从而导致白血病恶性克隆的形成。然而DNMT1如何与EZH2相互作用,其具有机制还有待深入研究。
本研究还发现表达与DNMT1 mRNA表达水平与外周血幼稚细胞比例、WBC计数呈显著正相关,提示DNMT1能够促使白血病细胞从骨髓释放到外周血,迁移至髓外形成浸润病灶。而且DNMT1高表达的患者预后较低表达者差,表明DNMT1可能是AML患者预后的判断指标。
| [1] |
常乃柏. 急性髓系白血病DNA甲基化及治疗进展[J].
中华临床医师杂志(电子版), 2013, 7(12): 5504-5506.
Chang NB. DNA methylation and the treatment of acute myeloid leukemia[J]. Chinese Journal of Clinicians Electronic Edition, 2013, 7(12): 5504-5506. |
| [2] |
杨青梅, 白松, 雷又鸣, 等. EZH2的功能及在肿瘤中的表达[J].
中国老年保健医学, 2014, 12(6): 72-75.
Yang QM, Bai S, Lei YM, et al. Expression of EZH2 and the function in tumor[J]. Chinese Journal of Geriatric Care, 2014, 12(6): 72-75. |
| [3] | Nikoloski G, Langemeijer SM, Kuiper RP, et al. Somatic mutations of the histone methyltransferase gene EZH2 in myelodysplastic syndromes[J]. Nat Genet, 2010, 42(8): 665-667. DOI: 10.1038/ng.620. |
| [4] |
吴圣豪, 郑翠苹, 徐杰. EZH2和microRNA-101在急性髓系白血病中的相关性分析及对预后的影响[J].
中华血液学杂志, 2012, 33(3): 232-235.
Wu SH, Zheng CP, Xu J. Correlation analysis of EZH2 and microRNA-101 in acute myeloid leukemia and its influence on prognosis[J]. Chin J Hematol, 2012, 33(3): 232-235. |
| [5] | Bennett J M, Catovsky D, Daniel MT, et al. Proposed revised criteria for the classification of acute myeloid leukemia. A report of the French-American-British Cooperative Group[J]. Ann Intern Med, 1985, 103(4): 620-625. DOI: 10.7326/0003-4819-103-4-620. |
| [6] |
范晨宇, 赵建农, 朱蔚林. EZH2与肿瘤相关性研究进展[J].
海南医学, 2015, 26(10): 1469-1471.
Fan CY, Zhao JN, Zhu WL. Correlation research between EZH2 genes and tumors[J]. Hainan Medical Journal, 2015, 26(10): 1469-1471. |
| [7] |
苏玉, 王溪, 朱卫国. DNA甲基转移酶的表达调控及主要生物学功能[J].
遗传, 2009, 31(11): 1087-1093.
Su Y, Wang X, Zhu WG, et al. DNA methyltransferases: the role in regulation of gene expression and biological processes[J]. Hereditas, 2009, 31(11): 1087-1093. |
| [8] |
冯琳, 乔淑凯, 徐世荣. 急性白血病患儿DNA甲基转移酶基因表达的临床预后价值[J].
实用儿科临床杂志, 2009, 24(3): 203-205.
Feng L, Qiao SK, Xu SR. Clinical prognostic value of expression of DNA methyltransferase gene in children with acute leukemia[J]. Journal of Applied Clinical Pediatrics, 2009, 24(3): 203-205. |
| [9] |
乔淑凯, 徐世荣, 郭晓楠, 等. 急性白血病患者DNA甲基转移酶基因的表达其及临床意义[J].
中国实验血液学杂志, 2005, 13(2): 260-265.
Qiao SK, Xu SR, Guo XN, et al. Expression of DNMT gene in bone marrow of patients with acute myelogenous leukemia and its significance[J]. Journal of Experimental Hematology, 2005, 13(2): 260-265. |
 2017, Vol. 38
2017, Vol. 38
