2. 中南大学湘雅三医院/卫生部移植医学工程技术研究中心 湖南 长沙 410013
2. The 3rd Xiangya Hospital of Central South University, & Research Center of National Health Ministry on Transplantation Medicine Engineering and Technology, Changsha 410013, China
肾移植术后巨细胞病毒(cytomegalovirus, CMV)感染仍然是肾移植术后最常见的并发症之一,严重影响着移植后人/肾的存活率[1]。普遍预防是目前临床上应用最为广泛的预防策略[2, 3],常用的预防性抗CMV的药物主要有更昔洛韦(ganciclovir, GCV)、阿昔洛韦(acyclovir, ACV)、伐昔洛韦(valacyclovir, VCV)和缬更昔洛韦(valganciclovir, VGCV)。其中,GCV是一种新型核苷类抗病毒药物,是目前首选的抗CMV治疗的药物[4]。但在CMV普遍预防中GCV的临床价值尚未统一[5, 6]。因此,我们对所有GCV预防方案的结果(包括有效性和安全性等)进行Meta分析,旨在探讨GCV在肾移植术后CMV预防中的临床价值。
1 资料与方法 1.1 文献检索有2名评价员检索中/英文公开发表的临床对照试验,计算机检索Pubmed、EMbase、SinoMed、Web of Science、the Cochrane Central Register of Controlled Trials(CENTRAL)、万方数据库、中国知网以及维普数据库等,建库至2016年12月公开发表的文献,同时查阅检索结果中所附相似文献及参考文献。英文检索策略为:(“Kidney transplantation” [All Fields] OR “Renal transplantation” [All Fields]”)、“CMV infection” [All Fields] AND “Universal prophylaxis ” [All Fields] AND “Ganciclovir ” [All Fields]AND “Controlled clinical Trial” [All Fields] AND “Humans”[MeSH Terms];中文检索策略为:“肾移植”、“CMV感染”、“预防”、“更昔洛韦”、“普遍预防”。
1.2 文献纳入和排除标准 1.2.1 纳入标准① 肾移植术后前瞻性或回顾性队列研究;②抢先治疗和普遍预防方案作为研究的主要目的;③方法学可靠;④数据详实。
1.2.2 排除标准① 不相关或体外实验;②病例报告、综述或者会议论文;③重复报道。
如果一个中心的数据多次发表,我们取最新发表的数据。如果一项研究多次报道,我们取随访时间最长的数据。
1.3 资料提取由2名评价员按照上述纳入与排除标准独立阅读所获文献题目和摘要,在排除明显不符合纳入标准的研究后进一步阅读全文,以确定是否符合纳入标准并提取相关资料。如遇分歧,由第3位作者决定是否纳入。
提取内容包括:①一般资料:文题、第一作者、发表日期和文献来源;②研究特征:研究对象的一般情况、分组方式及纳入的例数;③结局指标[CMV感染发生率、CMV病发病率、肾移植术急性排斥反应(cute rejection, AR)发生率、抗病毒药物副作用发生率等]。
1.4 干预措施和结局指标定义普遍预防:即肾移植术后最初的几个月内,无论是否存在CMV感染的风险,对所有的受者预防性应用抗病毒药。CMV感染:包括CMV DNA血症和PP65抗原血症。CMV病:包括有症状的CMV感染和经病理证实无症状的CMV感染。肾移植术后AR:包括亚临床AR、有临床症状的AR和经病理证实的AR。抗病毒药物副作用:包括白细胞减少、粒细胞减少、血小板减少以及贫血等,还包括头晕、头痛等中枢神经系统症状以及肝功能异常等。
1.5 统计学分析Meta分析采用Cochrane协作网提供的RevMan 5.3.0软件进行,首先检测研究间的异质性分析:若P≥0.1,I2≤50%,说明研究间存在异质性的可能性很小,使用固定效应模型;若P<0.1,I2>50%,说明研究间具有异质性,使用随机效应模型并通过亚组分析和(或)Meta回归进行异质性来源的探讨。异质性来源于低质量研究,进行敏感性分析。计数资料采用比值比(odds ratio, OR)作为分析统计量,计算其95%置信区间(95%CI),并绘制漏斗图来判断是否存在发表偏移。
2 结果 2.1 文献检索结果初检出相关文献2 196篇,其中英文文献1 235篇,中文文献961篇。使用NoteExpress 3.1排除重复文献160篇,经阅读文献和(或)摘要后剔除明显不符合纳入标准的1 024篇文献。进一步剔除重复发表、交叉的和不符合纳入标准的文献2篇[7, 8]。另外,GCV与VGC 3篇中1篇为抢先治疗[9],1篇数据不全[10],纳入研究过少[11],故本次对比研究排除了VGC与GCV对比研究。最终纳入10篇文献。其中,GCV与空白对照对比5项[12-16]、GCV与阿昔洛韦(ACV)4项[16-19]、GCV与伐昔洛韦(VCV)3项[15, 20, 21]。检索及筛选流程详见图 1。
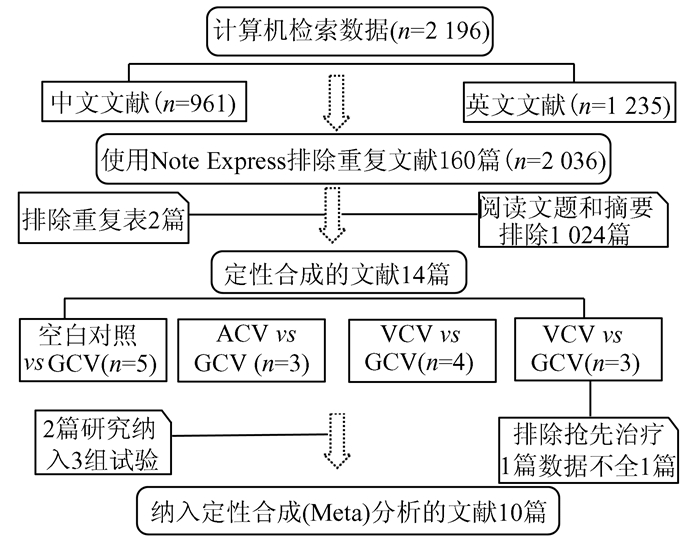
|
图 1 文献检索及纳入流程图 |
纳入研究的一般情况见表 1。所有的研究都包含抢先治疗和普遍预防方案,共纳入10项临床研究。其中随机对照试验6项,历史对照性研究4项。
| 表 1 纳入研究基本特征 |
肾移植术后CMV感染的发生风险:有4项研究报告了空白对照与GCV的疗效比较,CMV感染总的发生率为26.7%(52/195),其中空白对照组32.6%(30/92)、GCV组21.4%(22/103)。异质性检验I2=84%,P=0.002,研究间存在异质性,采用随机效应模型。合并OR值(OR=3.38,95%CI 0.19-61.28)分析两组差异不显著(P=0.41);3项研究报告了ACV与GCV的疗效比较,CMV感染总的发生率为35.1%(431/1 228),其中ACV组35.3%(272/771)、GCV组34.8%(159/457)。异质性检验I2=79%,P=0.009,研究间存在异质性,采用随机效应模型。合并OR值(OR=1.33,95%CI 0.52-3.41)分析两组差异不显著(P=0.55);有4项研究报告了VCV与GCV的疗效比较,CMV感染总的发生率为14.8%(54/364),其中VCV组18.2%(33/181)、更昔洛韦组11.5%(21/183)。异质性检验I2=0%,P=0.40,研究间不存在异质性,采用固定效应模型。合并OR值(OR=1.73,95% CI 0.95-3.16),分析两组差异不显著(P=0.07),见表 2。
| 表 2 更昔洛韦预防肾移植术后CMV感染发生的Meta分析 |
肾移植术后CMV病的发生风险:有5项研究报告了空白对照与GCV的疗效比较,CMV病总的发生率为12.0%(49/408),其中空白对照组15.9%(39/245)、GCV组6.1%(10/163)。异质性检验I2=71%,P=0.008,研究间存在异质性,采用随机效应模型。合并OR值(OR=3.68,95%CI 0.62-21.87),分析两组差异不显著(P=0.15);3项研究报告了ACV与GCV的疗效比较,CMV病总的发生率为10.6%(130/1 228),其中ACV组11.7%(90/771)、GCV组8.8%(40/457)。异质性检验I2=78%,P=0.01,研究间存在异质性,采用随机效应模型。合并OR值(OR=2.51,95%CI 0.76-38.30),分析两组差异不显著(P=0.13);有4项研究报告了VCV与GCV的疗效比较,CMV病总的发生率为6.0%(22/364),其中VCV组7.2%(13/181)、GCV组4.9%(9/183)。异质性检验I2=26%,P=0.26,研究间不存在异质性,采用固定效应模型。合并OR值(OR=1.49,95%CI 0.63-3.51),分析两组差异不显著(P=0.36), 见表 3。
| 表 3 更昔洛韦预防肾移植术后CMV病发生的Meta分析 |
肾移植术后AR的发生:有4项研究报告了空白对照与GCV的疗效比较,AR总的发生率为19.9%(81/408),其中空白对照组17.1%(42/245)、GCV组23.4%(39/163)。异质性检验I2=71%,P=0.008,研究间存在异质性,采用随机效应模型。合并OR值(OR=1.19,95%CI0.38-3.71),分析两组差异不显著(P=0.77);2项研究报告了ACV与GCV的疗效比较,AR总的发生率为29.4%(169/575),其中ACV组57.3%(118/206)、GCV组13.8%(51/369)。异质性检验I2=97%,P<0.000 01,研究间存在异质性,采用随机效应模型。合并OR值(OR=2.71,95%CI 0.08-87.51)分析两组差异不显著(P=0.57);有4项研究报告了VCV与GCV的疗效比较,AR总的发生率为12.9%(47/364),其中VCV组9.4%(17/181)、更昔洛韦组16.4%(30/183)。异质性检验I2=0%,P=0.55,研究间不存在异质性,采用固定效应模型。合并OR值(OR=0.52,95%CI 0.28-0.99)分析两组差异不显著(P=0.05),见表 4。
| 表 4 更昔洛韦预防肾移植术后急性排斥反应发生的Meta分析 |
抗病毒药物副作用的发生:有4项研究报告了空白对照与GCV的副反应发生的比较,其中空白对照组0(0/245)、GCV组9.2%(15/163)。异质性检验I2=0%,P=0.85,研究间存在异质性,采用固定效应模型。合并OR值(OR=0.18,95%CI 0.04-0.83)分析两组差异显著(P=0.03);2项研究报告了ACV与GCV副作用的比较,其中ACV组13.5%(14/104)、GCV组7.0%(9/128)。异质性检验I2=0%,P=0.47,研究间存在异质性,采用随机效应模型。合并OR值(OR=2.17,95%CI 0.89-5.30)分析两组差异不显著(P=0.09);有1项研究报告了VCV与GCV的副作用发生的比较,其中VCV组18.2%(6/35)、更昔洛韦组11.5%(10/36),两组差异不显著(P>0.05),见表 5。
| 表 5 更昔洛韦预防肾移植术后CMV感染中副作用发生的Meta分析 |
GCV是鸟嘌呤核苷的类似物,是肾移植术后最常用的抗病毒药物。GCV在CMV感染的细胞中转化为活性更强的三磷酸GCV,插入到病毒DNA中终止其复制和转录。另外,GCV具有很强的选择性作用,选择性聚集于CMV感染细胞而非正常细胞。但是,耐药是GCV的主要缺点[22, 23]。ACV是最早的抗病毒药物,其需要在病毒胸腺嘧啶核苷激酶的作用下才能抑制DNA的复制,但是人类CMV缺乏这种激酶。因此,ACV目前已极少用于临床。VCV是ACV的前体,也是ACV的活性成分,预防效果与GCV相当,但需要较大剂量。VGCV是GCV的缬氨酸替代制剂,生物利用度高,但是其价格昂贵。
Meta分析结果显示,与未服用抗病毒药相比,GCV并不能降低肾移植术后CMV感染、CMV病以及AR总的发生率,但是能明显降低术后短期CMV感染、CMV病、AR的发生[7, 8, 15]以及肾移植术后CMV感染长期的抗病毒费用[8];与ACV和VCV相比,GCV并不能降低肾移植术后CMV感染、CMV病以及AR总的发生率。但是,与ACV相比GCV能显著降低了不良反应发生的风险[16]、减少了混合感染的发生[18],与VCV相比GCV增加了严重AR的发生[8, 15, 20]、提高了移植肾功能延迟恢复发生的风险[15]。并且,Yango等[20]研究发现VCV较GCV生物利用度更高、血药分布更快、半衰期更短。
本次纳入的10个研究中均为病例对照研究。所有研究均明确分组,并且不存在选择性结果报道。所有研究结局指标明确,不存在偏倚。本研究虽然采用严格的文献检索和纳入标准,但仍有不足之处:①虽然采用了广泛的检索策略,但诸如增刊、会议论文及部分灰色文献无法获取,且纳入研究信息的限制,该研究只能就相关指标予以评价,因而不能排除潜在的发表偏倚;②所纳入的研究含有大量回顾性队列研究,缺乏大样本、多中心的随机对照研究;③纳入研究间术前免疫诱导方案、术前CMV血清学状态等不尽相同,导致研究间存在异质性,影响了本Meta分析结果的证据强度和可信度。
综上所述,本Meta分析提示:普遍预防可能只是延滞CMV感染的发生,从有效性、副作用的发生上两种预防方案并无优劣,但目前尚缺乏充足的循证医学证据支持。鉴于纳入的研究缺乏大样本、多中心的随机对照研究及文献质量等的限制,对上述结果应持谨慎态度,肾移植术后CMV的预防尚需更多高质量、大样本的临床随机对照研究。
| [1] | Puttarajappa C, Bhattarai M, Mour G, et al. Cytomegalovirus infection in high-risk kidney transplant recipients receiving thymoglobulin induction-a single-center experience[J]. Clin Transplant, 2016, 30(9): 1159-1164. DOI: 10.1111/ctr.2016.30.issue-9. |
| [2] |
石炳毅. 肾移植术后巨细胞病毒感染的"普遍预防"和"抢先治疗"应个体化[J].
肾脏病与透析肾移植杂志, 2013, 22(5): 449-450.
Shi BY. Universal prophylaxis or preemptive therapy in the prevention of cytomegalovirus infection after renal transplantation should be personalized[J]. J Nephrol Dialy Transplant, 2013, 22(5): 449-450. |
| [3] | Kir O, Zeytinoglu A, Arda B, et al. Impact of Prophylaxis vs Pre-emptive Approach for Cytomegalovirus Infection in Kidney Transplant Recipients[J]. Transplant Proc, 2017, 49(3): 537-540. DOI: 10.1016/j.transproceed.2017.01.027. |
| [4] | Weclawiak H, Kamar N, Mengelle C, et al. Pre-emptive intravenous ganciclovir versus valganciclovir prophylaxis for de novo cytomegalovirus-seropositive kidney-transplant recipients[J]. Transplant International Official Journal of the European Society for Organ Transplantation, 2010, 23(10): 1056-1064. DOI: 10.1111/j.1432-2277.2010.01101.x. |
| [5] |
陈兰兰, 倪安平, 崔京涛, 等. 肾移植后巨细胞病毒感染的先驱治疗和普遍预防方案的荟萃分析[J].
中华器官移植杂志, 2014, 35(4): 216-220.
Chen LL, Ni AP, Cui JT, et al. Meta-analysis on the two medications to prevent cytomegalovirus infection in recipients of renal transplants[J]. Chin J Organ Transplant, 2014, 35(4): 216-220. |
| [6] |
张李峰, 田金徽, 移康, 等. 更昔洛韦对防治肾移植后巨细胞病毒感染预防性治疗的系统评价[J].
复旦学报:医学版, 2010, 37(2): 131-139.
Zhang LF, Tian JH, Yi K, et al. Prophylactictreatment of ganciclovir to prevent and cure cytomegalovirus infection after renal transplantation: a systematic review[J]. Fudan Univ J Med Sci, 2010, 37(2): 131-139. |
| [7] | Reischig T, Opatrny KJ, Bouda M, et al. A randomized prospective controlled trial of oral ganciclovir versus oral valacyclovir for prophylaxis of cytomegalovirus disease after renal transplantation[J]. Transpl Int, 2002, 15(12): 615-622. DOI: 10.1111/tri.2002.15.issue-12. |
| [8] | Reischig T, Opatrny JK, Treska V, et al. Prospective comparison of valacyclovir and oral ganciclovir for prevention of cytomegalovirus disease in high-risk renal transplant recipients[J]. Kidney Blood Press Res, 2005, 28(4): 218-225. DOI: 10.1159/000087129. |
| [9] | Kalpoe JS, Schippers EF, Eling Y, et al. Similar reduction of cytomegalovirus DNA load by oral valganciclovir and intravenous ganciclovir on pre-emptive therapy after renal and renal-pancreas transplantation[J]. Antivir Ther, 2005, 10(1): 119-123. |
| [10] |
杨典东, 张智宇, 吴吉涛, 等. 缬更昔洛韦与更昔洛韦在肾移植后预防和减少巨细胞病毒感染发生率的比较[J].
中华器官移植杂志, 2014, 35(8): 507-508.
Yang DD, Zhang ZY, WU JT, et al. Comparison between valganciclovir and ganciclovir in the prevention and decreasing of cytomegalovirus infection incidence rate after renal transplantation[J]. Chin J Organ Transplant, 2014, 35(8): 507-508. |
| [11] | Said T, Nampoory MR, Pacsa AS, et al. Oral valgancyclovir versus intravenous gancyclovir for cytomegalovirus prophylaxis in kidney transplant recipients[J]. Transplant Proc, 2007, 39(4): 997-999. DOI: 10.1016/j.transproceed.2007.03.046. |
| [12] |
侯小飞, 马潞林, 李宇, 等. 更昔洛韦预防肾移植术后巨细胞病毒感染的效果观察[J].
中华器官移植杂志, 2009, 30(8): 500-501.
Hou XF, Ma LL, Li Y, et al. Observation of ganciclovir effect on the prevention of cytomegalovirus infection after renal transplantation[J]. Chin J Organ Transplant, 2009, 30(8): 500-501. |
| [13] |
李宁, 武小桐, 黄丽萍, 等. 应用更昔洛韦预防肾移植术后的巨细胞病毒肺炎[J].
中华器官移植杂志, 2005, 26(9): 569-570.
Li N, Wu XT, Huang LP, et al. Application of ganciclovir in the prevention of cytomegalovirus pneumonia after renal transplantation[J]. Chin J Organ Transplant, 2005, 26(9): 569-570. |
| [14] |
张明, 钟建泳, 瞿连喜, 等. 更昔洛韦预防肾移植术后巨细胞病毒感染的前瞻性随机对照研究[J].
中华器官移植杂志, 2006, 27(8): 452-455.
Zhang M, Zhong JY, Qu LX, et al. Prophylaxis of cytomegalovirus infection with ganciclovir in renal transplant recipients: a retrospective randomized controlled study[J]. Chin J Organ Transplant, 2006, 27(8): 452-455. |
| [15] | Reischig T, Jindra P, Mares J, et al. Valacyclovir for cytomegalovirus prophylaxis reduces the risk of acute renal allograft rejection[J]. Transplantation, 2005, 79(3): 317-324. DOI: 10.1097/01.TP.0000150024.01672.CA. |
| [16] | Flechner SM, Avery RK, Fisher R, et al. A randomized prospective controlled trial of oral acyclovir versus oral ganciclovir for cytomegalovirus prophylaxis in high-risk kidney transplant recipients[J]. Transplantation, 1998, 66(12): 1682-1688. DOI: 10.1097/00007890-199812270-00019. |
| [17] |
薛武军, 燕航, 田普训, 等. 更昔洛韦防治肾移植术后CMV感染的对照研究[J].
西安交通大学学报:医学版, 1999, 20(2): 178-181.
Xue WJ, Yan H, Tian PX, et al. Comparative study of ganciclovir in the prevention of CMV infection after renal transplantation[J]. Journal of Xi' An Medical University, 1999, 20(2): 178-181. |
| [18] |
邱江, 陈立中, 王长希, 等. 不同抗病毒药物对肾移植受者巨细胞病毒感染的预防疗效:附996例分析[J].
南方医科大学学报, 2009, 29(9): 1949-1950;1954.
Qiu J, Chen LZ, Wang CX, et al. Prophylactic effects of different antivirus drugs on the cytomegalovirus infection after renal transplantation[J]. J South Med Univ, 2009, 29(9): 1949-1950;1954. |
| [19] |
齐隽, 郭义峰, 闵志廉. 更昔洛韦预防肾移植术后巨细胞病毒感染[J].
中国新药与临床杂志, 2005, 24(1): 47-49.
Qi J, Guo YF, Min ZL. Ganciclovir in the prophylaxis of cytomegalovirus infection after renal transplantation[J]. Chin J New Durgs Clin Rem, 2005, 24(1): 47-49. |
| [20] | Yango A, Morrissey P, Zanabli A, et al. Comparative study of prophylactic oral ganciclovir and valacyclovir in high-risk kidney transplant recipients[J]. Nephrol Dial Transplant, 2003, 18(4): 809-813. DOI: 10.1093/ndt/gfg039. |
| [21] | Pavlopoulou ID, Syriopoulou VP, Chelioti H, et al. A comparative randomised study of valacyclovir vs. oral ganciclovir for cytomegalovirus prophylaxis in renal transplant recipients[J]. Clin Microbiol Infect, 2005, 11(9): 736-743. DOI: 10.1111/j.1469-0691.2005.01215.x. |
| [22] | Bruminhent J, Rotjanapan P, Watcharananan SP. Epidemiology and outcome of ganciclovir-resistant cytomegalovirus infection after solid organ transplantation: a single transplant center experience in Thailand[J]. Transplant Proc, 2017, 49(5): 1048-1052. DOI: 10.1016/j.transproceed.2017.03.053. |
| [23] | Young PG, Rubin J, Angarone M, et al. Ganciclovir-resistant cytomegalovirus infection in solid organ transplant recipients: a single-center retrospective cohort study[J]. Transpl Infect Dis, 2016, 18(3): 390-395. DOI: 10.1111/tid.2016.18.issue-3. |
 2018, Vol. 39
2018, Vol. 39


