鼻咽癌(nasopharyneal carcinoma NPC)是来源于鼻咽部黏膜上皮的最常见的头颈部恶性肿瘤, 其治疗以放疗为主的综合治疗。患者5年总生存率为40%-70%[1], 鼻咽癌患者的预后,除外鼻咽癌早期发现、病理分型、治疗方案及肿瘤分期等因素,还与肿瘤分子机制因素密切相关[2]。因此寻找一种鼻咽癌特异的分子标记物作为判断鼻咽癌患者的预后指标,为临床治疗及预防复发提供科学依据,以提高患者的治疗效果。
同源异形盒基因分为Homeobox基因家族(HOX基因)和paraHox基因家族[3, 4]。哺乳动物中HOX基因分为A、B、C、D四簇,分别位于7、17、12和2号染色体上,每簇含有9-13个排列在一条同源DNA链上的HOX基因位点[5]。HOX基因编码产物是胚胎发育调控的主控基因也是成人细胞分化的重要调节基因[6]。HOXC10是HOX家族基因成员,广泛表达于多种生物细胞中。
目前已有研究表明HOXC10的异常表达与肿瘤发生密切相关。如在肺腺癌中HOXC10表达上调,其高表达与肺腺癌患者的肿瘤分期、淋巴结转移及临床分期相关,与患者差的临床预后呈正向关,并且HOXC10可通过调控上皮间质转化相关蛋白vimentin和E-cadherin的表达促进肺癌细胞迁移[7]。在骨肉瘤中HOXC10表达上调,通过介导凋亡相关蛋白Bcl-2、Bax表达促进骨肉瘤细胞凋亡,并且其高表达可能作为骨肉瘤早期诊断的分子标志物[8]。上述研究结果表明HOXC10能够参与多种肿瘤的发生发展过程,并且与肿瘤患者预后密切相关。然而其在鼻咽癌中功能目前尚未见报道。
因此,本研究对HOXC10在鼻咽癌组织中的表达及其与鼻咽癌患者预后的相关性进行评估,为鼻咽癌患者的预后评判提供一个潜在的生物标志物。
1 材料与方法 1.1 患者临床资料收集2012年2月-2015年12月武汉大学中南医院医院耳鼻咽喉-头颈外科的124例鼻咽癌组织和124例配对的癌旁组织,所有标本均为鼻咽部活检组织,经病理确诊为鼻咽癌,患者年龄42-68岁,平均年龄56岁,所有患者均尚未接受放化疗治疗,在确诊时也均无癌细胞的远处转移,标本留取后立即放入液氮中保存。依据WHO分类标准对鼻咽癌进行肿瘤分期,由本院的两位病理学专家对鼻咽癌的临床分期进行独立记录。
1.2 RNA提取和荧光定量PCR检测用Trizol提取组织总RNA后,用核酸蛋白检测仪检测所提取的RNA的纯度及浓度。逆转录反应体系严格按照逆转录试剂盒M-MLV First Strand Kit(Invitrogen)的操作说明进行。荧光定量PCR操作按照荧光实时定量PCR试剂盒SYBR Premix Ex Taq(TaKaRa)说明书进行。qRT-PCR反应参数为:预变性94 ℃ 5 min,变性95 ℃ 30 s,退火58 ℃ 30 s,延伸72 ℃ 30 s,进行40个循环,75-80 ℃采集荧光,最后65-95 ℃进行熔解曲线分析(GAPDH为内参)。定量PCR所用引物使用Primer 5.0软件设计,经同源比对后由美国Invitrogen公司合成,具体序列、扩增长度及退火温度见表 1。
| 表 1 引物序列 |
将组织包埋在石蜡中切成4 μm厚的切片。脱蜡之后,将切片加入含有10 μmol/L钠柠檬酸盐缓冲液(pH 6.0)中,98 ℃下加热20 min,进行抗原修复。用5%BSA对非特异性抗原进行封闭,随后将兔抗人HOXC10单克隆抗体(用5%BSA 1:100稀释)加到玻片上,将组织完全覆盖,4 ℃湿盒孵育过夜,PBS洗2次/5 min。将山羊抗兔的二抗加到玻片上,将组织完全覆盖,湿盒37 ℃ 30 min,PBS洗2次/5 min。用DAB进行显示,显微镜下控制反应时间,约在2-4 min间,PBS冲洗终止显示。接着用苏木素复染,梯度乙醇溶液脱水,最后用二甲苯透明,中性树胶封片后于显微镜下观察。
1.4 统计学分析使用SPSS 18.0软件进行统计分析,统计数据采用x±s表示。应用卡方检验分析HOXC10表达与多种临床病理资料间的相关性。无局部复发生存期(LRFS)、无转移生存率(MeFS)和疾病特异性生存期(DSS)的计算是从放疗开始到事件发生之日。使用Cox比例风险模型进行多变量分析。用Kaplan-Meier分析和对数秩检验比较两组间的预后差异。对于所有分析,P<0.05被认为具有统计学意义。
2 结果 2.1 HOXC10在鼻咽癌组织中表达上调为证实HOXC10在鼻咽癌组织中的表达,我们使用荧光定量PCR和免疫组织化学的方法对鼻咽癌组织中HOXC10 mRNA及蛋白水平的表达进行检查。结果如图 1所示,相对于癌旁组织,HOXC10在鼻咽癌组织中表达上调,P<0.05,差异具有统计学意义。
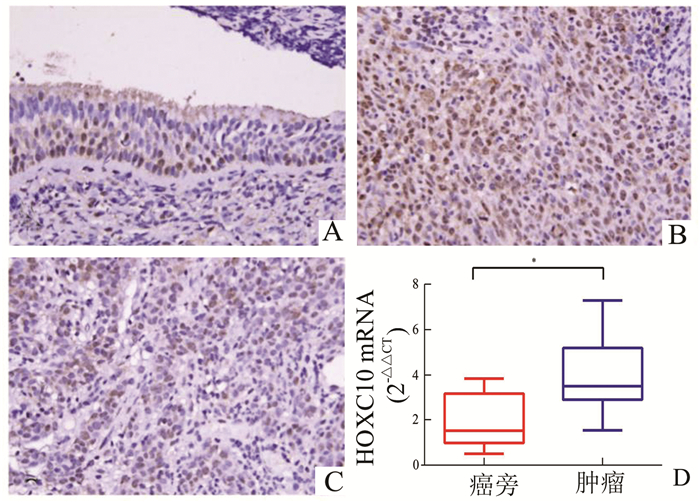
|
图 1 HOXC10在鼻咽癌组织中表达上调 A, B, C:免疫组织化学检测HOXC10在鼻咽癌组织中的表达,A为癌旁组织,B为高分化鼻咽癌组织,C为低分化鼻咽癌组织;D:HOXC10 mRNA的相对表达对比 |
如表 2所示,124例鼻咽癌中包括5例角化鳞状细胞癌,40例非角质化分化癌和79例未分化癌。本研究共纳入90例男性和34例女性,平均年龄48.6岁(范围20-83岁)。肿瘤临床分期情况:7例为Ⅰ期,31例为Ⅱ期,46例为Ⅲ期,40例为Ⅳ期。Chi-square检验结果显示HOXC10高表达与鼻咽癌患者肿瘤分期(P=0.021)、淋巴结转移(P<0.001)及临床分期(P=0.002)密切相关,然而与患者的年龄、性别及组织分化程度间不存在明显的相关性。
| 表 2 HOXC10与鼻咽癌患者临床病理资料间的相关性分析 |
为了进一步阐明HOXC10在鼻咽癌患者预后预测中的重要作用,我们对HOXC10 mRNA表达水平与鼻咽癌患者DSS、MeFS和LRFS间相关性进行了分析。Kaplan-Meier分析结果显示,HOXC10高表达与鼻咽癌患者DSS(P=0.007)及MeFS(P=0.0042)差的预后呈正相关,然而与LRFS间不存在明显的相关性(P=0.1987)(图 2)。此外我们的结果还显示,DSS、MeFS及LRFS与鼻咽癌患者的肿瘤分期、淋巴结转移及临床分期密切相关,然而与鼻咽癌患者的年龄、性别和组织分化程度间不存在明显的相关性(表 3)。此外,多变量生存分析结果显示HOXC10高表达在鼻咽癌中仍然是一个独立的预测因子,预示着鼻咽癌患者较差的DSS(P=0.018,危险比=1.978)和MeFS(P=0.026,危险比= 1.782)(表 3),并且鼻咽癌患者DSS(P=0.026)、MeFS(P=0.033)和LRFS(P=0.014)均和患者肿瘤分期间存在明显相关性(表 4)。
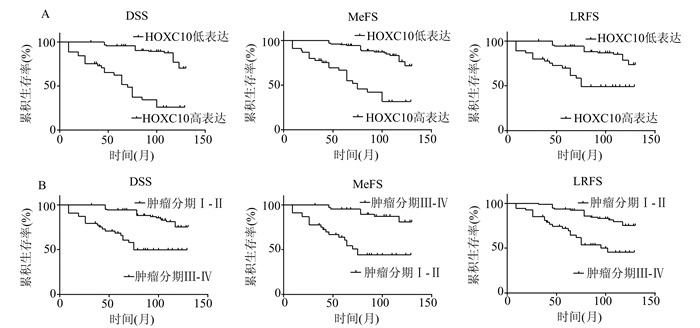
|
图 2 HOXC10高表达与鼻咽癌患者预后间的相关性分析 (A)Kaplan-Meier分析HOXC10高表达与鼻咽癌患者疾病特异性生存期、无远处转移生存期和无局部复发生存期间的相关性。(B)Kaplan-Meier分析HOXC10高表达与鼻咽癌患者各生存期肿瘤分期间的相关性 |
| 表 3 单变量log-rank分析 |
| 表 4 多变量生存分析 |
Homeobox基因家族(HOX基因)是调控胚胎发育分化的主控基因,也是成人组织细胞增殖分化的重要调控基因。近年来不断有研究发现,HOX基因与多种肿瘤的发生发展及预后密切相关,并参与调控细胞的增殖分化、凋亡和迁移侵袭等生物学过程。HOXC10是HOX家族基因成员,广泛表达于多种生物细胞中。近年来已有研究报道HOXC10在人类多种肿瘤中表达异常,且参与肿瘤的发生发展过程。如HOXC10在胃癌细胞中表达上调,其高表达能够促进胃癌细胞增殖、侵袭和迁移[9]。在甲状腺癌中,HOXC10表达上调,其高表达能够促进甲状腺癌细胞增殖、侵袭和迁移,并且与甲状腺癌患者差的预后呈正相关[10]。
此外,HOXC10异常表达还见于乳腺癌[11]、口腔癌[12]和宫颈癌[13]等,并且可能与肿瘤浸润、肿瘤分期、淋巴结转移等生物学行为密切相关。可见HOXC10可参与多种肿瘤的发生发展过程,并且与患者的预后密切相关。
我们使用荧光定量PCR及免疫组织化学的方法对124例鼻咽癌组织中HOXC10的表达进行了检测,结果证实HOXC10在鼻咽癌组织中表达上调(图 1)。Chi-square检验结果显示HOXC10高表达与鼻咽癌患者肿瘤分期(P=0.021)、淋巴结转移(P<0.001)及临床分期(P=0.002)密切相关,然而与患者的年龄、性别及组织分化程度间不存在明显的相关性(表 2)。Kaplan-Meier分析结果显示,HOXC10高表达与鼻咽癌患者DSS(P=0.007)及MeFS(P=0.004 2)差的预后呈正相关,然而与LRFS间不存在明显的相关性(P=0.198 7)(图3)。此外,多变量生存分析结果显示HOXC10高表达在鼻咽癌中仍然是一个独立的预测因子,预示着鼻咽癌患者较差的DSS(P=0.018,危险比=1.978)和MeFS(P=0.026,危险比= 1.782)(表 4),并且鼻咽癌患者DSS(P=0.026)、MeFS(P=0.033)和LRFS(P=0.014)均和患者肿瘤分期间存在明显相关性(表 4)。
综上,本研究结果表明HOXC10在鼻咽癌中的表达及其与鼻咽癌患者预后间存在密切相关性,HOXC10可能在鼻咽癌发生、发展及转移等生物学行为中起着重要的作用,其可能成为鼻咽癌患者预后的一个的生物标志物。
| [1] |
高黎, 谷铣之, 殷蔚伯, 等.
肿瘤放射治疗学[M]. 北京: 北京医科大学·中国协和医科大学联合出版社, 2008: 480-481.
Gao L, Gu XZ, Yin WB, et al. Neoplasm Radiotherapeutics[M]. Beijing: Beijing Medical University & China Union Medical University Associated Press, 2008: 480-481. |
| [2] | Sidler D, Thum P, Winterhalder R, et al. Undifferentiated carcinoma of nasopharyngeal type (UCNT): a Swiss single-institutional experience during 1990-2005[J]. Swiss Med Wkly, 2010, 140(19-20): 273-279. |
| [3] | Fröbius AC, Seaver EC. ParaHox gene expression in the polychaete annelid Capitella sp. Ⅰ[J]. Dev Genes Evol, 2006, 216(2): 81-88. DOI: 10.1007/s00427-005-0049-0. |
| [4] | Brooke NM, Garciafernàndez J, Holland PWH. The ParaHox gene cluster is an evolutionary sister of the Hox gene cluster[J]. Nature, 1998, 392(6 679): 920-922. |
| [5] | Cillo C, Cantile M, Faiella A, et al. Homeobox genes in normal and malignant cells[J]. J Cell Physiol, 2001, 188(2): 161-169. DOI: 10.1002/(ISSN)1097-4652. |
| [6] | Bardine N, Donow C, Korte B, et al. Two Hoxc6, transcripts are differentially expressed and regulate primary neurogenesis in Xenopus laevis[J]. Dev Dyn, 2009, 238(3): 755-765. DOI: 10.1002/dvdy.v238:3. |
| [7] | Tang XL, Ding BX, Hua Y, et al. HOXC10 promotes the metastasis of human lung adenocarcinoma and indicates poor survival outcome[J]. Frontiers, 2017, 135(2): 1 235-1 324. |
| [8] | Xiong W, Zhou Q, Liu G, et al. Homeodomain-containing gene 10 inhibits cell apoptosis and promotes cell invasion and migration in osteosarcoma cell lines[J]. Tumour Biology, 2017, 39(5): 1010428317697566. |
| [9] | Zheng J, Ge P, Liu X, et al. MiR-136 inhibits gastric cancer-specific peritoneal metastasis by targeting HOXC10[J]. Tumour Biol, 2017, 39(6): 1010428317706207. |
| [10] | Feng X, Li T, Liu Z, et al. HOXC10 up-regulation contributes to human thyroid cancer and indicates poor survival outcome[J]. Mol Biosyst, 2015, 11(11): 2 946-2 954. DOI: 10.1039/C5MB00253B. |
| [11] | Pathiraja TN, Nayak SR, Xi Y, et al. Epigenetic reprogramming of HOXC10 in endocrine-resistant breast cancer[J]. Sci Transl Med, 2014, 6(229): 229ra41. DOI: 10.1126/scitranslmed.3008326. |
| [12] | Marcinkiewicz KM, Gudas LJ. Altered histone mark deposition and DNA methylation at homeobox genes in human oral squamous cell carcinoma[J]. J Cell Physiol, 2014, 229(10): 1 405-1 416. DOI: 10.1002/jcp.v229.10. |
| [13] | Zhai Y, Kuick R, Nan B, et al. Gene expression analysis of preinvasive and invasive cervical squamous cell carcinomas identifies HOXC10 as a key mediator of invasion[J]. Cancer Res, 2007, 67(21): 10 163-10 172. DOI: 10.1158/0008-5472.CAN-07-2056. |
 2018, Vol. 39
2018, Vol. 39


