缺血性心脏病是糖尿病患者主要的心血管并发症和首要致死病因。糖尿病患者一旦发生急性心肌梗塞(acute myocardial infarction,AMI)则病情重、进展快、预后差、死亡率高。糖尿病加重了心脏对缺血/再灌注损伤(ischemia/reperfusion injury,IRI)的易损性[1],而大量研究表明单纯控制血糖并不能降低糖尿病患者AMI后严重心血管事件的发生率及死亡率,这很可能与糖尿病脂类转运代谢异常密切相关。
Abumrad等[2]在脂肪细胞的细胞膜上发现一种参与脂肪酸转运的重要蛋白,并证实了其分子质量在80-90 kU,命名为脂肪酸转位酶(fatty acid transporter,FAT),后来发现与人类白细胞分化抗原CD36(cluster of differentiation 36)有85%的同源性且都具有结合脂肪酸的能力,故又称FAT/CD36。有研究发现根据糖基化程度的不同,CD36的分子质量通常在53-88 kU。正常成年人的心脏能量约70%从脂肪酸氧化获取,脂肪酸的摄取和氧化主要依靠CD36,CD36转运长链脂肪酸(long chain fatty acid,LCFA)的能力被大量研究证实,并且通过调节脂肪酸代谢来参与脂质稳态[3]。CD36在脂肪酸代谢活跃的组织中大量表达,例如心脏、脂肪、骨骼肌、肝脏等。研究提示CD36在细胞膜重新分布是再灌注损伤(IR)的早期事件,并可能是治疗心肌IRI的新的靶点。
在糖尿病心脏,CD36从细胞内大量转位至心肌细胞膜呈过表达,脂类摄取异常增多,超过脂肪酸氧化速率,促使甘油三酯(triglycerides,TGs)积聚和脂类利用异常[3]。CD36过表达加重心肌脂质毒性和胰岛素拮抗,在以脂类代谢异常为特征的疾病如糖尿病的心血管病变产生中起到重要作用。因此,我们推测CD36过表达可能是糖尿病心肌IRI加重的重要原因。
本研究通过使用磺基-N-琥珀酰亚胺酯油酸(sulfo-N-succinimidyloleat,SSO)与CD36特异性结合进而抑制CD36,探讨减轻糖尿病心肌缺血/再灌注损伤的机制。
1 材料与方法 1.1 材料与试剂成年雄性健康Sprague-Dawley (SD)大鼠,SPF级,体重210-240 g(北京华阜康生物科技股份有限公司);链脲佐菌素(STZ)、TTC和CD36抗体均订购于美国Sigma-Aldrich公司;SSO (Santa Cruz,美国),15-F2t-isoprostane(Cayman公司,美国),其他血浆检测指标试剂盒购自南京建成公司和武汉碧云天公司。动物实验方案经过武汉大学人民医院动物实验伦理委员会的批准。
1.2 模型制备和实验方法 1.2.1 糖尿病大鼠模型SPF级SD雄性健康成年大鼠,禁食12 h后经尾静脉一次性注射1% STZ 60 mg/kg,3 d后禁食6 h,测空腹血糖值大于16.7 mmol/L,并出现相应症状,认定糖尿病大鼠模型制备成功。此后每天记录大鼠饮食饮水量,每周监测血糖和体重,成模8周后开始实验。
1.2.2 分组正常大鼠和造模成功的糖尿病大鼠被分为3组(n=16):正常心肌缺血/再灌注组(IR组)、糖尿病心肌缺血/再灌注组(DIR组),SSO处理的糖尿病心肌缺血/再灌注组(DIRS组)。SSO溶液浓度为20 μmol/L,经颈内静脉泵注15 min后,再实施心肌缺血。
1.2.3 心肌IR模型大鼠术前禁食12 h,采用腹腔注射1%戊巴比妥钠60 mg/kg实施麻醉并固定于实验台上,连接心电监护,气管插管后连接呼吸机行机械控制呼吸。分离右颈内静脉建立静脉通路,分离右股动脉插管记录有创动脉压,在大鼠四肢皮下及胸前插入针性电极,连接小动物心电图仪。75%乙醇溶液消毒胸部皮肤,于左侧胸骨旁剪开1 cm切口,逐层分离暴露,切断第三、四肋骨,拉钩沿肋间隙撑开,剪开心包膜,充分暴露心脏。以6-0无损伤线在冠状动脉左前降支(LAD)分支下约2 mm处穿一结扎线,以备结扎。结扎时采用直径0.2 cm的细塑料管穿过结扎线用显微止血钳夹紧。稳定10 min后结扎LAD造成心肌缺血,30 min后松开结扎线再灌注2 h。LAD结扎成功标准为:心前区变白,心电图Ⅱ导联出现ST段抬高(T波高耸,与QRS波融合,QRS波增宽、变高)为结扎成功。再灌注成功标准为:S-T段回落,心尖复红。
1.3 观察指标及技术方法 1.3.1 Western Blot法检测心肌CD36再灌注2 h结束后,迅速取出结扎线下的全心组织,置于液氮保存。捣碎研磨后裂解,提取上清冻存-20 ℃备用。CD36的检测需要提取心肌组织膜蛋白、细胞质蛋白和总蛋白样品。BCA蛋白试剂盒测定蛋白浓度,蛋白提取液以缓冲液(Tris HCl 50 mmol/L,DTT 100 mmol/L SDS 2%,溴酚蓝0.1%,纯甘油10%)稀释后100 ℃加热5 min,离心12 000 r/min,10 min,-20 ℃保存。SDS-PAGE上行凝胶电泳分离蛋白并移至PVDF膜上,5%脱脂奶粉封闭,分别加入一抗,一抗孵育过夜后,缓冲液洗膜后加入二抗,共同室温孵育后洗膜。用Odyssey双色红外激光扫描显影仪扫描荧光蛋白条带,并进行结果分析,通过目的蛋白条带灰度值与内参GAPDH条带灰度值的比值,表达目的蛋白水平。
1.3.2 心肌梗死面积测定再灌注结束后每组随机取6只大鼠,再次结扎LAD,将3%Evans blue 1 ml注射进左心室腔。以预冷生理盐水冲洗残余血液,染料通过冠脉分布于心肌中。快速摘除心脏,-20 ℃保存2 h。以垂直于心肌长轴的方向切片,厚度2 mm,置于1%TTC缓冲液37 ℃避光孵育15 min后,置于4%多聚甲醛固定30 min后扫描拍片。Evans blue蓝染部分为有活力的心肌组织,称为正常心肌组织(非缺血心肌),TTC染色区呈砖红色(缺血心肌),非TTC染色区为灰白(梗死心肌)。每层切片上下两面均拍照,照片以Image-Pro Plus 6.0软件分析不同区域面积大小。测定心肌缺血面积和梗死面积百分比,以缺血心肌面积占左心室面积的百分比(AAR/LV%)和梗死心肌面积占缺血心肌面积的百分比(IA/AAR%)为代表。
1.3.3 心肌组织HE染色再灌注2 h后,切取心尖组织,4%多聚甲醛溶液固定,石蜡包埋后切片机切片,HE染色,显微镜下观察心肌病理学形态。
1.3.4 血糖、胰岛素、甘油三酯(TGs)和游离脂肪酸(FFAs)检测血糖采用one-touch血糖仪和试纸检测。再灌注2 h后,收集血标本,4 ℃,3 000 r/min离心15 min后取血清,保存于-20 ℃冰箱。血清胰岛素检测按照ELISA试剂盒(elabscience)说明书操作。TGS和FFAs检测分别按照甘油三酯测定试剂盒和游离脂肪酸测定试剂盒(南京建成)说明书操作。
1.3.5 氧化应激指标检测再灌注2 h后,收集血标本,4 ℃,3 000 r/min离心15 min后取血清,检测15-F2t-isoprostane浓度, 具体操作按照Cayman公司试剂盒说明书进行。
1.3.6 乳酸脱氢酶(LDH)、磷酸肌酸激酶心型同工酶(CK-MB)及B型利尿肽(BNP)检测再灌注2 h后,收集血标本,4 ℃,3 000 r/min离心15 min后取血清,保存于-20 ℃冰箱。用全自动生化分析仪和分光光度计测定血清中LDH、CK-MB和BNP浓度。具体操作按照试剂盒说明书进行。
1.4 统计学处理采用SPSS 19.0软件建立数据库并进行统计分析,试验数据以均数±标准差(x±s)表示,采用单因素方差分析(One-way ANOVA),后用Tukey’s post hoc进行均数间的多重比较。P<0.05为差异有统计学意义。
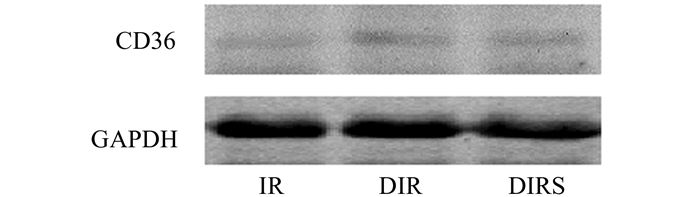
2 结果 2.1 心肌CD36蛋白表达较之非糖尿病大鼠IR组,DIR组的CD36表达增多,呈过表达,DIRS组SSO部分抑制了CD36的过表达。3组之间的CD36蛋白表达均有统计学差异(P<0.05)。见表 1和图 1。
| 表 1 心肌CD36蛋白表达(n=8, x±s) |
|
图 1 心肌细胞膜蛋白CD36的表达结果 |
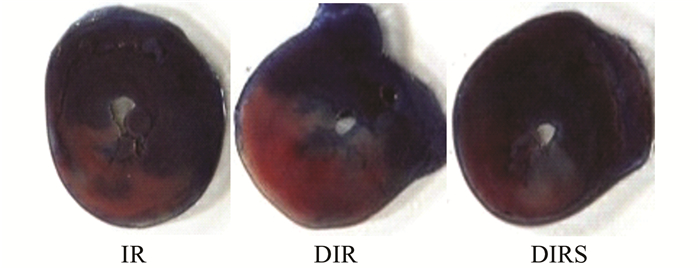
与非糖尿病大鼠心肌缺血/再灌注组(IR组)比较,糖尿病大鼠心肌缺血/再灌注组(DIR组)AAR/LV%和IA/AAR%都增加(P<0.05),在糖尿病大鼠心肌缺血前静脉给予FAT/CD36的抑制剂SSO,能减少心肌缺血面积和梗死面积,DIRS组的AAR/LV%和IA/AAR%都低于DIR组(P<0.05),且与IR组比较无统计学差异。见图 2和表 2。
|
图 2 大鼠心脏Evans blue-TTC染色 |
| 表 2 3组大鼠心肌缺血面积百分比和心肌梗死面积百分比(%,n=6,x±s) |
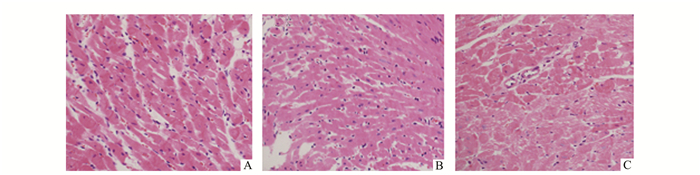
显微镜下HE病理结果,IR组心肌细胞排列紊乱,增生、水肿,部分心肌细胞坏死、断裂,细胞间质水肿伴散在炎性细胞浸润;DIR组心肌损伤较IR更加严重,心肌细胞结构消失、核溶解、坏死,细胞肌质溶解呈网状,局灶性肌浆凝集呈波浪状改变。DIRS组与DIR组比较未见明显差别,可见毛细血管内皮肿胀。见图 3。
|
图 3 光镜下大鼠心肌组织病理改变(×200) A:IR组;B:DIR组;C:DIRS组 |
DIR和DIRS组糖尿病大鼠的胰岛素、甘油三酯和游离脂肪酸的浓度均高于非糖尿病大鼠IR组(P<0.05),SSO处理后的DIRS组大鼠的胰岛素、甘油三酯和游离脂肪酸的浓度均有不同程度下降,差异有统计学意义(P<0.05)。见表 3。
| 表 3 3组大鼠血清血糖、胰岛素、TGs和FFAs浓度(n=8,x±s) |
DIR组的15-F2t-isoprostane、LDH、CK-MB和BNP浓度均高于IR组(P<0.05),而经SSO处理后,DIRS组的血清各指标的浓度均有所下降(P<0.05)。见表 4。
| 表 4 3组大鼠血清15-F2t-isoprostane、LDH、CK-MB和BNP浓度(n=8,x±s) |
已有研究发现糖尿病加重了心脏对IRI的易损性,本研究证实在同样经历心脏缺血/再灌注后,较之非糖尿病大鼠,糖尿病大鼠心肌损伤更重,这很可能与糖尿病糖代谢和脂类代谢异常密切相关,而大量研究表明单纯控制血糖并不能降低糖尿病患者AMI后严重心血管事件发生率及死亡率,因此我们考虑脂类代谢异常很可能是糖尿病心脏对IRI易损性增加的重要原因[4]。CD36广泛分布于肝脏、心肌、骨骼肌、脂肪等多种组织细胞,介导LCFA的转运和代谢[5]。CD36在糖尿病患者的脂肪、肝脏和肌肉等组织细胞表面CD36呈现过表达,其机制是CD36由细胞内向细胞外膜表面转移并重新分布,使脂肪酸分泌增加,干扰胰岛素分泌,使脂肪酸摄取速度增加和脂质堆积。与野生型大鼠相比,CD36剔除大鼠离体心脏对缺血再灌注的耐受明显升高,过表达CD36的离体心脏对缺血的耐受降至与正常大鼠相同,这说明对缺血耐受性的升高与CD36缺乏有关[6]。这些说明CD36参与的脂肪酸摄取和氧化利用是心脏对缺血耐受的重要因素[4]。剔除CD36是否就一定有益,还有争议,研究发现心脏和骨骼肌缺乏CD36会影响能量的生成,在缺血等细胞需能增加的情况下这种影响更明显;而CD36剔除大鼠的心脏在负荷状态下心脏的舒张末压力明显升高,这与血管内皮细胞无CD36表达有关,CD36的缺乏导致心脏、骨骼肌、脂肪组织脂肪酸转运的严重障碍。因此部分抑制糖尿病心肌CD36过表达,使CD36表达恢复接近正常则更有意义。SSO是CD36的一种特异性抑制剂,SSO能与CD36的第164位的赖氨酸特异性结合进而抑制CD36,能减少LCFA氧化[7]。有研究在小鼠模型上采用20 μmol/L SSO抑制CD36表达[8], 最新的研究表明在糖尿病鼠离体心脏模型上,给予SSO能降低脂肪酸代谢[9]。本研究在糖尿病大鼠心脏缺血/再灌注前静脉给予SSO,通过部分抑制CD36的过表达,降低了胰岛素、TGs和FFAs浓度。心肌梗死面积也减少。同时反映心肌损伤的CK-MB和LDH浓度明显降低,反映左心室功能的BNP浓度也降低,反映氧化应激和脂质过氧化水平的15-F2t-isoprostane浓度也低于糖尿病心肌缺血/再灌注组。
综上,SSO抑制CD36过表达来减轻糖尿病大鼠心肌缺血/再灌注损伤,其保护作用机很可能与调节脂肪酸代谢来维持脂质稳态,减轻氧化应激,增加糖尿病心脏对缺血的耐受有关。
| [1] | Danaei G, Singh GM, Paciorek CJ, et al. The global cardiovascular risk transition: associations of four metabolic risk factors with national income, urbanization, and Western diet in 1980 and 2008[J]. Circulation, 2013, 127(14): 1501e-1502e. |
| [2] | Abumrad NA, El-Maghrabi MR, Amri EZ, et al. Cloning of a rat adipocyte membrane protein implicated in binding or transport of long-chain fatty acids that is induced during preadipocyte differentiation. Homology with human CD36[J]. J Biol Chem, 1993, 268(24): 17665-17668. |
| [3] | Kim TT, Dyck JR. The role of CD36 in the regulation of myocardial lipid metabolism[J]. Biochim Biophys Acta, 2016, 1861(10): 1450-1460. DOI: 10.1016/j.bbalip.2016.03.018. |
| [4] | Fukushima A, Lopaschuk GD. Cardiac fatty acid oxidation in heart failure associated with obesity and diabetes[J]. Biochim Biophys Acta, 2016, 1861(10): 1525-1534. DOI: 10.1016/j.bbalip.2016.03.020. |
| [5] | Glatz JF, Nabben M, Heather LC, et al. Regulation of the subcellular trafficking of CD36, a major determinant of cardiac fatty acid utilization[J]. Biochim Biophys Acta, 2016, 1861(10): 1461-1471. DOI: 10.1016/j.bbalip.2016.04.008. |
| [6] | Lopaschuk GD, Ussher JR, Folmes CD, et al. Myocardial fatty acid metabolism in health and disease[J]. Physiol Rev, 2010, 90(1): 207-258. DOI: 10.1152/physrev.00015.2009. |
| [7] | Kuda O, Pietka TA, Demianova Z, et al. Sulfo-N-succinimidyl oleate (SSO) inhibits fatty acid uptake and signaling for intracellular calcium via binding CD36 lysine 164: SSO also inhibits oxidized low density lipoprotein uptake by macrophages[J]. J Biol Chem, 2013, 288(22): 15547-15555. DOI: 10.1074/jbc.M113.473298. |
| [8] | Naville D, Duchampt A, Vigier M, et al. Link between intestinal CD36 ligand binding and satiety induced by a high protein diet in mice[J]. PLoS One, 2012, 7(1): e30686. DOI: 10.1371/journal.pone.0030686. |
| [9] | Mansor LS, Sousa FM, Yea G, et al. Inhibition of sarcolemmal FAT/CD36 by sulfo-N-succinimidyl oleate rapidly corrects metabolism and restores function in the diabetic heart following hypoxia/reoxygenation[J]. Cardiovasc Res, 2017, 113(7): 737-748. DOI: 10.1093/cvr/cvx045. |
 2018, Vol. 39
2018, Vol. 39


