2. 广州市番禺区中心医院呼吸内科 广东 广州 511400;
3. 呼吸疾病国家重点实验室/广州市呼吸疾病研究所 广东 广州 510320
2. Dept. of Respiratory Medicine, Panyu Central Hospital, Guangzhou 511400, China;
3. State Key Laboratory of Respiratory Disease & Guangzhou Institute of Respiratory Disease, Guangzhou 510320, China
机械通气是治疗急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)的根本手段,但应用不当可增加死亡率。传统肺保护通气策略(lung protective ventilation strategy, LPVS),即控制平台压(plateau pressure, Pplat)不超过30-35 cmH2O、适当的呼气末正压(positiveend expiratorypressure, PEEP)、控制潮气量(tidal volume, VT)在6-8 ml/kg,可改善ARDS预后,但仍然存在广泛争议[1, 2]。从呼吸力学角度看,在完全呼吸肌肉松弛情况下,调控Pplat可以控制吸气末肺容量,但在保留自主呼吸条件下,单纯控制Pplat并不能够调控吸气末肺容量,不能实施有效的肺保护,Pplat并非实施LPVS的理想指标。跨肺压(transpulmonary pressure, PL)是最终决定肺容量的压力因素,无论在完全呼吸肌肉松弛和保留自主呼吸情况下,调控PL可以控制吸气末肺容量,实施有效的肺保护[3, 4]。理论上通过监控PL来实施LPVS更为合理,因此我们提出以PL为导向的LPVS,即通过调控PL来实施肺保护通气。本实验通过复制ARDS动物模型,观察以PL为导向的LPVS分别在机控通气和自主呼吸模式下对ARDS呼吸生理功能和氧代谢的影响,并与传统LPVS相比较,探讨以PL为导向的LPVS对ARDS的作用机制,以寻求一种新的LPVS的实施方法。
1 材料与方法 1.1 材料普通级比格犬18只, 体重(18.6±3.5) kg, 均为雄性, 由广州医科大学实验动物中心提供(动物合格证号:粤Scxk2009-009)。
1.2 动物准备和模型制备麻醉成功后行气管插管, 机械通气。右股静脉置如中心静脉导管,20 ml生理盐水和油酸(0.1 ml/kg)经充分混合后,中心静脉导管缓慢注入,20 min注完。90 min后,查动脉血气分析, 如PaO2/FiO2<200 mmH2O并稳定30 min,说明ARDS模型复制成功。
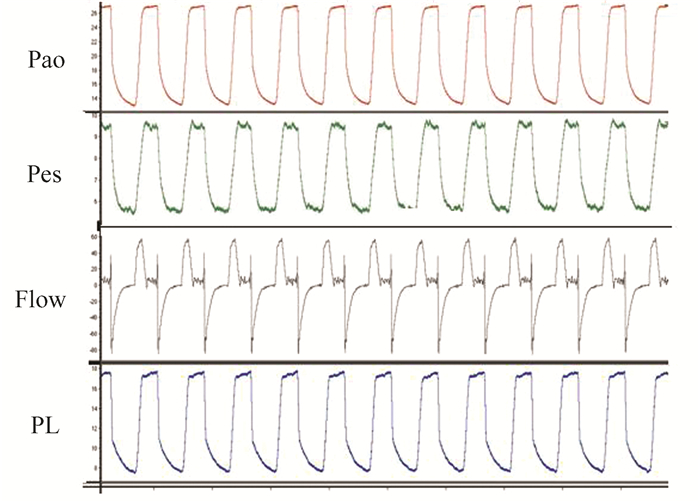
1.3 呼吸力学监测经口在食道引导管引导下依次插入胃和食道囊管,囊管充气后将压力传感器连接于PCLAB生物信号放大器和PowerLab 16导生理记录仪。根据计算机实时监测波形调整囊管位置。插入的食道电极根据肌电图的幅度进行定位,两端肌电信号最大时固定电极。所有信号在Chart 5.2.1软件支持下进行数据采集,信号采样频率为2 000 Hz。实时监测气道压(Pao), 食道压(Pes), PL=Pao-Pes, 见图 1。
|
图 1 机控呼吸状况下呼吸力学曲线 从上至下依次为气道压力(Pao)、食道压(Pes)、流量(Flow)和跨肺压(PL) |
根据呼吸力学原理,在呼吸机控制通气时,完全肌肉松弛的条件下,吸气末平台压Pplat能较好地反映吸气末PL[5]。我们的预实验也证实,PL与Pplat高度相关(R为0.995,P<0.001), 通过相关回归分析我们得到以下方程,Pplat=1.0108 PL+9.8619。根据目前LPVS的推荐,控制吸气末Pplat≤30 cmH2O,即相当于控制吸气末PL≤20 cmH2O。18只比格犬分为3组,每组6只:
A组(镇静组):呼吸机控制通气,应用镇静药和肌松药,使动物达到完全肌松状态,控制Pplat=30 cmH2O(相当于吸气末PL=20 cmH2O)。
B组(控制PL组):保留自主呼吸,控制吸气末PL=20 cmH2O。
C组(控制Pplat组):保留自主呼吸,控制Pplat=30 cmH2O。
呼吸机参数设置:使用Drager Savina呼吸机进行机械通气,采用BIPAP模式,根据上述分组要求来设置高水平压力(Phigh),低压水平(Plow,相当于PEEP)设定为保持呼气末PL≥0 cmH2O,高压持续时间为0.6 s, 呼吸频率(RR)为30次/min。
1.4 监测指标 1.4.1 呼吸力学指标动态监测食道压、胃内压、气道压和呼吸流量。并通过上述指标计算跨肺压(PL)、气道峰压(PIP)、平台压(Pplat)、潮气量(VT)、静态肺顺应性(CL-stat)、动态肺顺应性(CL-dyn)、吸气气道阻力(Rw-ins)。
1.4.2 血气氧合指标氧合指数(OI)、氧分压(PaO2)、动脉二氧化碳分压(PaCO2)、pH值(pH)、动脉血氧饱和度(SaO2)、混合静脉血氧分压(PvO2)、混合静脉血氧饱和度(SvO2)、肺内分流比例(Qs/Qt)、氧输送(DO2)、死腔率(VD/VT)。
1.5 肺组织病理学评分实验结束后将动物处死, 从右上、中和下肺取肺组织放入10%甲醛溶液中固定, 行病理学检查,观察肺损伤程度。采用Smith积分法[6],对肺水肿、肺泡及间质炎症、肺泡及间质出血、肺不张和透明膜形成进行半定量分析评分:无损伤=0分;病变范围 < 25%=1分;病变范围占25%-50%=2分; 病变范围占50%-75%=3分;变满视野=4分, 总肺损伤评分为上述各项之和。每只动物观察10个高倍视野, 取其平均值。
1.6 统计学处理所有数据用SPSS 18.0统计软件进行统计学分析。各组间分别进行方差分析,结果以均数±标准差(x±s)表示,P<0.05为差异有显著性。
2 结果 2.1 不同肺保护通气策略对呼吸力学的影响与A、B两组相比,C组CL-dyn、CL-stat明显低于A组和B组(P<0.05),VT高于A组和B组(P<0.05),Rw、ins、PIP、Pplat和无显著性差异(P>0.05);A、B两组间比较无显著性差异(P>0.05)。提示与保留自主呼吸控制Pplat组相比,无论机控呼吸还是保留自主呼吸条件下,控制PL的LPVS能更好地改善肺顺应性(见表 1)。
| 表 1 各不同肺保护通气策略对呼吸力学的影响(x±s) |
与A、B两组相比,C组DO2明显低于A组和B组,Qs/Qt高于A组和B组(P<0.05),OI、PaO2、PvO2、PaCO2、PvCO2、PaO2和VD/VT无显著性差异(P>0.05);A、B两组间比较无显著性差异(P>0.05)。提示与保留自主呼吸控制Pplat组相比,无论机控呼吸还是保留自主呼吸条件下,控制PL的LPVS能提高氧输送(见表 2)。
| 表 2 各不同肺保护通气策略对氧合功能的影响(x±s) |
肺损伤分类评分中,C组中性中性粒细胞浸润评分高于A组和B组(P<0.05),C组间质水肿评分高于A组(P<0.05),C组肺不张评分均低于A组和B组(P<0.05);A组和B组比较,肺损伤总分和分类评分无显著性差异(P>0.05)。提示同其它两组相比,保留自主呼吸控制Pplat组可加重肺损伤评分(见表 3)。
| 表 3 各组肺损伤组织病理评分的比较(x±s) |
ARDSNet等已证实LPVS可明显降低ARDS的病死率,但目前关于LPVS仍存在很多争议, Eichacker[7]甚至质疑研究中治疗组与对照组之间预后的差异不是由于小潮气量通气的保护效应,而是由于过大潮气量的恶化效应。ARDS是一个临床综合征,由多种因素导致,不同个体不同疾病的肺内病理生理明显不同,设定呼吸参数应该结合每个个体当时呼吸力学特征,才能做到量体裁衣、有的放矢。机械通气时尽可能应用床旁实时监测技术,实施目标指导下的个体化通气策略,减少呼吸机相关性肺损伤(VILI)。食道囊管法作为呼吸力学经典的研究方法,能够密切监测和客观评价各个患者整个呼吸系统的力学特征,理论上是床旁实时呼吸力学监测技术的理想选择[8]。PL是最终决定肺容量的压力因素,是指导机械通气的理想指标。
我们研究发现:三组犬ARDS模型分别采用不同肺保护通气策略通气后,A组和B组的CL-dyn、CL-stat明显高于C组,VT明显低于C组。其机制为[9]:ARDS肺的容量明显减小,顺应性显著降低,LPVS通过正压维持陷闭肺泡的持续开放、增加功能残气量来改善肺顺应性。在自主保留自主呼吸状态下,吸气时胸腔压为负值,气道压力相同的情况下,自主呼吸比机控呼吸能产生更大的PL,所以C组的PL最大, 吸气末肺容积增大,产生的潮气量大于A组和B组,使部分肺泡过度通气,可加重VILI;Gattinoni等研究表明[10],完全肌肉松弛情况下,PL与Pplat呈直线相关,二者均能较为客观的反映肺容积,但在自主呼吸状态下,PL与Pplat无明显相关性,PL与潮气量有很好的相关性。因此通过监控PL可以较好地控制肺容量,同时在P-V曲线指导下,保证通气在顺应性较好的肺容量段进行,从而改善肺的顺应性,所以A组和B组CL-stat和CL-dyn高于C组。提示无论在自主呼吸或机控呼吸,监控PL可改善肺顺应性,同时也说明在自主呼吸状态下监测Pplat, 可能不能真正起到肺保护的作用。
我们研究还发现:给予LPVS后,各实验组OI、PaO2较前明显升高,Qs/Qt、VD/VT有所下降,与既往的实验结果相一致。LPVS显著改善氧合功能的机制包括[11]:① 在理论上,最佳PEEP是使陷闭区肺泡全部开放并能维持其持续开放的压力,陷闭肺泡的持续开放显著降低了肺内动静脉分流量;② 陷闭肺泡的持续开放消除了陷闭肺泡因周期性开闭导致的切变力损伤,也减轻了病变程度不同区域间因顺应性差异导致的切变力损伤,而延缓了肺损伤的进展和氧合功能的恶化;③ 小VT避免或减轻了开放肺泡的扩张性损伤,有利于避免肺换气功能的进一步恶化。这就能很好地解释上述生理指标的变化。各组OI、PaO2无明显差异,说明三种通气方式均能改善氧合。进一步分析发现,C组的DaO2明显低于A组和B组,其机制为:DaO2不仅与PaO2有关,还与血红蛋白(Hb)的含量和CO有关,由于氧离曲线呈S型,在PaO2大于60 mmH2O的情况下,继续增加PaO2对SaO2的增加有限,而Hb的变异性较小,可见DaO2主要受CO的影响[12]。C组的潮气量和PL大于A组和B, 可导致CO的下降,也就能解释C组的DaO2更明显低于其余两组。
另外,我们参照ADRS早期肺损伤的病理特点,从出血、间质水肿、中性粒细胞浸润、透明膜形成和肺不张五方面进行肺损伤病理评分。我们发现C组Smith积分高于A组和B组;在肺损伤分类评分中,C组中性白细胞浸润和间质水肿评分高于A和B组,肺不张评分均低于A和B组。其机制为[13]:自主呼吸条件下,控制Pplat并不能控制吸气末肺容积,肺过度充气区肺泡过度膨胀,肺泡上皮过度牵拉,激发肺的炎症反应,导致肺组织炎症细胞浸润和肺间质水肿, 也可从CT影像学得到证实;过度充气区比例增加,肺不张区域减少,故C组肺不张评分低于其余两组。
总之,我们的研究证实:监控PL无论在自主呼吸或机控呼吸状态下,均能够有效地调控肺容量,改善肺顺应性,提高氧输送,减轻VILI;在保留自主呼吸时,单纯监控Pplat不能有效地调控肺容量,可导致肺组织过度充气和加重肺损伤。
| [1] | Eichacker PQ, Gerstenberger EP, Banks SM, et al. Meta-analysis of acute lung injury and acute respiratory distress syndrome trials testing low tidal volumes[J]. Am J Respir Crit Care Med, 2002, 166: 1 510-1 514. DOI: 10.1164/rccm.200208-956OC. |
| [2] | Wang JT, Chang SC. Severe acute respiratory syndrome[J]. Curr Opin Infect Dis, 2004, 17(2): 143-148. DOI: 10.1097/00001432-200404000-00013. |
| [3] | Sarge T, Talmor D. Targeting transpulmonary pressure to prevent ventilator lung injury[J]. Minerva Anestesiol, 2009, 75(5): 293-299. |
| [4] | Talmor D, Sarge T, Malhotra A, et al. Mechanical Ventilation Guided by Esophageal Pressure in Acute Lung Injury[J]. N Engl J Med, 2008, 389(20): 2 095-2 014. |
| [5] | Talmor D, Sarge T, O'Donnell CR, et al. Esophageal and transpulmonary pressures in acute respiratory failure[J]. Critical Care Medicine, 2006, 34(5): 1 389-1 394. DOI: 10.1097/01.CCM.0000215515.49001.A2. |
| [6] | Smith KM, Mrozek JD, Simonton SC, et al. Prolonged partial liquid ventilation using conventional and high-frequency ventilatory techniques: gas exchange andl ung pathology in animal model of respiratory distress syndrome[J]. Crit Care Med, 1997, 25(11): 1 888-1 897. DOI: 10.1097/00003246-199711000-00030. |
| [7] | Suki B, Hubmayr R. Epithelial and endothelial damage induced by mechanical ventilation modes[J]. Curr Opin Crit Care, 2014, 20(1): 17-24. DOI: 10.1097/MCC.0000000000000043. |
| [8] | Talmor D, Sarge T, O'Donnell CR, et al. Esophageal and transpulmonary pressures in acute respiratory failure[J]. Crit Care Med, 2006, 34(5): 1 389-1 394. DOI: 10.1097/01.CCM.0000215515.49001.A2. |
| [9] | Chiumello D, Cressoni M, Colombo A, et al. The assessment of transpulmonary pressure in mechanically ventilated ARDS patients[J]. Intensive Care Med, 2014, 40(11): 1 670-1 678. DOI: 10.1007/s00134-014-3415-4. |
| [10] | Gattinoni L, Carlesso E, Cadringher P, et al. Physical and biological triggers of ventilator-induced lung injury and its prevention[J]. Eur Respir J, 2003, 47(Suppl): 15-25. |
| [11] | Crotti S, Mascheroni D, Cairomi P, et al. Recruitment and derecruiment during acute respiratory failure:A clinical study[J]. Am J Respir Crit Care Med, 2001, 164(1): 131-140. DOI: 10.1164/ajrccm.164.1.2007011. |
| [12] | Luecke T, Meinhardt JP, Herrmann P, et al. Oleic acid vs saline solution lung lavage-induced lung injury:effects on lung morphology, pressure-volume relationships, and response to positive end-expiratory pressure[J]. Chest, 2006, 130(2): 392-401. DOI: 10.1378/chest.130.2.392. |
| [13] | Suki B, Hubmayr R. Epithelial and endothelial damage induced by mechanical ventilation modes[J]. Curr Opin Crit Care, 2014, 20(1): 17-24. DOI: 10.1097/MCC.0000000000000043. |
 2017, Vol. 38
2017, Vol. 38
