过敏性哮喘是一种多发、常见的慢性气道疾病,持续存在的气道炎症与气道高反应性是其主要特征,其发病机制至今不清楚,但肺局部Th2细胞应答优势化是其公认的重要发病机制[1, 2]。心房钠尿肽(Atrial natriuretic peptide, ANP)是一种多功能血管活性肽,最早被发现于鼠心房肌,并被证实在机体循环内稳态中的调节中发挥重要作用[3]。然而,越来越多的证据表明,心房钠尿肽信号还广泛分布于呼吸系统,并可能参与肺脏免疫及炎症反应的调节过程[4, 5]。既往也有研究发现哮喘患者急性发作期及缓解期外周血心房钠尿肽含量有显著差异[6];而且心房钠尿肽被证实可以影响胸腺细胞的发育,即在加入心房利钠肽共培养7 d后,CD4+CD8+胸腺细胞比例减少而CD4-CD8-胸腺细胞明显增加[7];而我们的前期研究也发现心房钠尿肽具有调节Th17细胞的功能与分化的作用[8],并在动物实验中发现哮喘小鼠肺局部心房钠尿肽水平明显高于对照组[9],但其在哮喘发病中的具体作用仍不清楚。本研究旨在利用小鼠动物模型观察心房钠尿肽在过敏性气道炎症与气道高反应中的作用并探讨其可能机制。
1 材料与方法 1.1 材料SPF级的BALB/c小鼠(雌性,周龄6-8周,体重(20±2) g,桂林医学院动物实验中心提供),Ⅴ级卵清蛋白OVA与氢氧化铝凝胶(美国Sigma公司),小鼠心房钠尿肽(美国Sigma公司),小鼠A71915(心房钠尿肽受体拮抗剂,瑞士Bachem公司),小鼠GATA-3抗体(美国Proteintech公司),小鼠心房钠尿肽ELISA Kit (上海沪宇公司),小鼠IL-4、IL-5、IL-13细胞因子ELISA Kit (武汉华美公司)。
1.2 实验分组及过敏性哮喘小鼠模型的建立与鉴定BALB/c雌性小鼠48只,随机分为对照组、哮喘组、心房钠尿肽组和心房钠尿肽受体拮抗剂组(心房钠尿肽+A71915组,简称拮抗剂组),每组各12只。建模流程参照我们成熟的方案[10],其中:对照组,所有OVA处理均用PBS代替;哮喘组,按实验方案给予OVA和氢氧化铝凝胶(0.01 mg/只小鼠OVA溶在0.2 ml的氢氧化铝凝胶里在第0与第12天经腹腔注射)致敏及反复OVA溶液雾化吸入(利用浓度为5%的OVA溶液每次雾化30 min,从第18天持续到第23天,共6 d):心房钠尿肽组,每次给予OVA溶液雾化激发前30 min进行经鼻滴入心房钠尿肽溶液(0.5 μg/g小鼠),其余同哮喘组;拮抗剂组,在经鼻滴入心房钠尿肽溶液前30 min行腹腔注射A71915(心房钠尿肽受体拮抗剂,0.5 μg/g小鼠),其余同心房钠尿肽组。此外,在结束最后一次雾化激发实验24 h后,进行各组小鼠肺功能检测观察气道高反应情况;并行支气管肺泡灌洗收集灌洗液(BALF)行细胞总数与分类计数,上清液冻存待行ELISA检测细胞因子含量。
1.3 肺组织病理学最后一次雾化激发24 h后,无菌分离小鼠肺组织,放入4%多聚甲醛溶液中固定。乙醇梯度脱水后石蜡包埋切片,行HE染色并采用MIAS-2000医学图像分析系统观察各组小鼠气道改变。选择具有完整的气道横断面的切片3张,参照哮喘小鼠气道炎症评分标准进行气道炎症评分,评分标准为:0分,无炎症细胞浸润;1分,少量炎症细胞浸润;2分,1层炎症细胞围绕气道;3分,2-4层炎症细胞围绕气道;4分,4层以上的炎症细胞围绕气道。同时行PAS染色观察气道黏膜杯状细胞增生和气道黏液分泌情况,以PAS染色阳性的杯状细胞数占气道上皮细胞百分比表示,评分标准为:0分,<5%;1分,5%-25%;2分,25%-50%;3分,50%-75%;4分,>75%。
1.4 Western blot将组织从液氮罐中取出,置于干净研钵中,研磨成粉末,取蛋白裂解液加到研钵中(按每500 mg组织加500 μl蛋白裂解液);将裂解后样品置于4℃冰箱中,每隔5 min拿出来剧烈震荡1 min,重复6次;再将样品4 ℃ 12 000 r/min离心15 min。吸上清即为细胞全蛋白溶液。后续的制作标准曲线、检测样品蛋白含量、电泳、转膜、孵抗体、显色等操作步骤参照标准操作程序实施。完成后扫描胶片,得出目标蛋白和内参照β-actin蛋白图像,再利用Gel-ProAnalyzer软件分析各条带的光密度值,以目标蛋白的光密度值与β-actin蛋白光密度值之比作为目标蛋白的相对表达量,并以此为参数进行统计分析。
1.5 ELISA利用匀浆器将各组肺脏组织标本充分匀浆后,3 000 r/min离心20 min,收集上清液,同时解冻支气管肺泡灌洗液按ELISA检测的标准操作程序进行心房钠尿肽、IL-4、IL-5、IL-13的含量测定。
1.6 统计学处理采用SPSS 19.0软件进行统计分析,各组资料进行正态性检验和方差齐性检验,符合正态性分布和方差齐同的数据,组间比较采用方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 各组小鼠气道高反应性的检测结果(图 1)
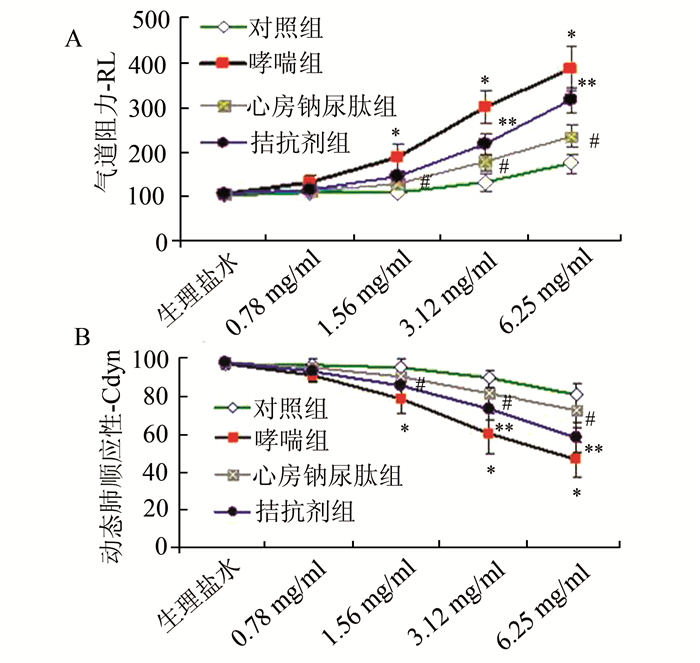
|
图 1 各组小鼠气道高反应的变化 A.气道阻力;B.动态肺顺应性; 与对照组比较,*P<0.01;与哮喘组比较,#P<0.01;与心房钠尿肽组比较,**P<0.05 |
小鼠接受不同浓度的乙酰甲胆碱(Mch)刺激后利用小鼠肺功能仪来记录评价气道高反应的常用指标:气道阻力(RL)及动态肺顺应性(Cdyn)。如图 1所示:与正常组比较,哮喘组小鼠的气道高反应性很明显,低浓度的Mch刺激即可导致气道阻力的明显升高(P<0.01)和动态肺顺应性的下降(P<0.01),而随着Mch浓度的增大气道阻力越来越高,动态肺顺应性亦越来越低;而经鼻滴入心房钠尿肽则可以缓解哮喘小鼠的气道高反应性(P<0.01);而腹腔注射拮抗剂A71915可明显中和心房钠尿肽的效应(P<0.05)。
2.2 各组小鼠支气管肺泡灌洗液中细胞总数及分类计数情况(图 2)

|
图 2 各组小鼠支气管肺泡灌洗液计数细胞总数与分类计数 与对照组比较,*P<0.01;与哮喘组比较,#P<0.05;与心房钠尿肽组比较,**P<0.05 |
为了评估过敏性气道炎症是否成功建立及外源性心房钠尿肽干预后的气道炎症变化情况,我们利用支气管肺泡灌洗液行细胞总数及分类计数。相比较于正常组,哮喘组小鼠BALF中细胞总数显著增加[(27.7±6.8)×104/ml vs (6.79±2.07)×104/ml,P<0.01],分类计数显示嗜酸粒细胞[(4.66±1.84)×104/ml vs 0,P<0.01]、淋巴细胞[(5.68±1.54)×104/ml vs (0.3±0.1)×104/ml,P<0.01]均明显增多;而经鼻滴入心房钠尿肽干预后,我们发现哮喘小鼠支气管肺泡灌洗液中细胞总数、嗜酸粒细胞及淋巴细胞升高更加明显(P均<0.05);阻断心房钠尿肽信号后哮喘小鼠支气管肺泡灌洗液中细胞总数、嗜酸粒细胞及淋巴细胞数均减少(P均<0.05),如图 3所示。
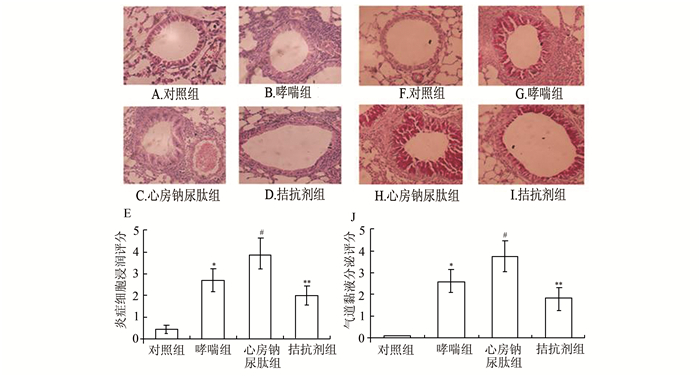
|
图 3 各组小鼠肺脏组织病理学变化 A-E.气道炎症反应;F-J黏液分泌情况; 与对照组比较,*P<0.01;与哮喘组比较,#P<0.05;与心房钠尿肽组比较,**P<0.05 |
为了更直接的观察气道炎症反应变化,取各组小鼠的肺组织分别行HE、PAS染色,结果如下:
对照组:HE染色可见支气管及肺泡结构基本正常,未见明显炎症细胞;PAS染色未见明显的染色阳性上皮细胞(图 3A与3F)。哮喘组:与对照组比较,HE染色可见支气管黏膜充血水肿及坏死脱落的上皮细胞,气道周围可见大量的炎症细胞,炎症细胞浸润程度明显高于对照组(P<0.01),差异有统计学意义。PAS染色可见大量的阳性细胞,细胞轮廓粗大饱满,上皮细胞坏死脱落明显,气道黏液分泌功能亢进(P<0.01),存在显著差异(图 3-B与G)。心房钠尿肽组:与哮喘组比较,HE染色提示支气管黏膜充血水肿更加明显,炎症细胞浸润更严重,炎症反应程度高于哮喘组(P<0.05),差异有统计学意义。PAS染色与哮喘组比较,阳性细胞数量更多,气道黏液分泌更加明显(P<0.05),差异有统计学意义(图 3-C与H)。拮抗剂组:HE染色显示,相较于心房钠尿肽组,炎症细胞浸润程度明显缓解。炎症程度亦明显减轻(P<0.05),差异有统计学意义。PAS染色亦提示阳性细胞少于心房钠尿肽组,气道上皮细胞黏液分泌减少(P<0.05),差异有统计学意义(图 3-D与I)。
2.4 各组小鼠支气管肺泡灌洗液及肺组织匀浆心房钠尿肽(ANP)、IL-4、IL-5、IL-13的含量变化情况(图 4)
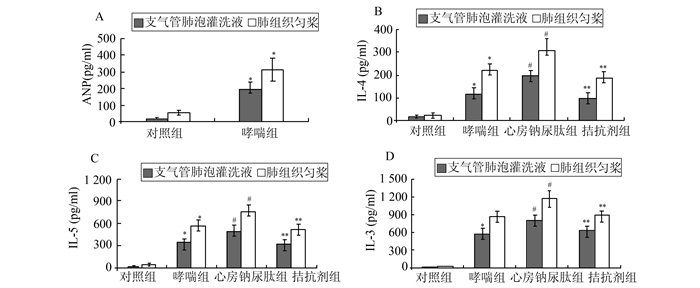
|
图 4 各组小鼠支气管肺泡灌洗液及肺组织匀浆上清中ANP、IL-4、IL-5、IL-13的含量 与对照组比较,*P<0.01;与哮喘组比较,#P<0.05;与心房钠尿肽组比较,**P<0.05 |
我们通过对小鼠支气管肺泡灌洗液和肺组织匀浆中心房钠尿肽含量的检测发现,相较于对照组,哮喘小鼠肺局部的心房钠尿肽水平明显升高。
此外,我们还同时检测了各组小鼠支气管肺泡灌洗液及肺组织匀浆中过敏性相关细胞因子即IL-4、IL-5、IL-13的含量变化。结果显示OVA诱导的过敏性哮喘小鼠肺内IL-4、IL-5、IL-13的水平均较对照组显著升高(P<0.01);而使用心房钠尿肽干预后,发现肺局部的IL-4、IL-5、IL-13升高更加明显(P<0.05);而阻断心房钠尿肽信号则可明显抑制其效应(P<0.05)。
2.5 各组小鼠肺组织中GATA3蛋白表达情况(图 5)
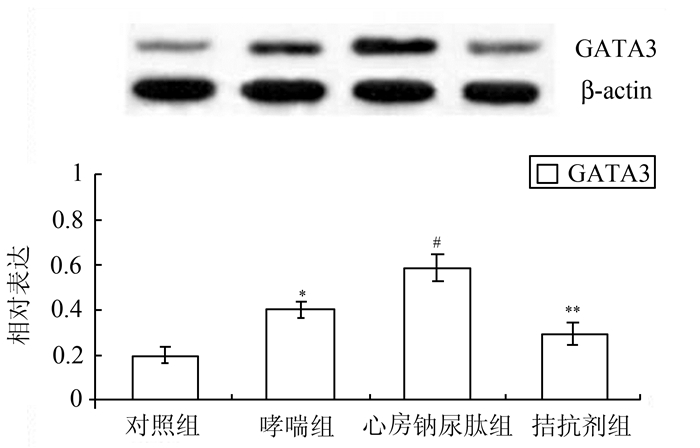
|
图 5 各组小鼠肺组织中GATA3蛋白表达情况 与对照组比较,*P<0.05;与哮喘组比较,#P<0.05;与心房钠尿肽组比较,**P<0.05 |
为了观察心房钠尿肽是否促进过敏性哮喘小鼠肺局部的Th2型应答,我们进一步检测肺组织中GATA3的表达有无变化。Western blot检测结果提示:与既往报道一致,与对照组比较,哮喘组小鼠肺组织中GATA3蛋白的表达明显增加(P<0.05);而当经鼻滴入心房钠尿肽后则检测发现这种趋势更加显著(P<0.05);进一步使用A71915阻断心房钠尿肽信号则可一定程度上逆转(P<0.05)。
3 讨论心房钠尿肽(ANP)作为一种经典的血管活性肽,其在呼吸系统的作用研究甚少。近年来发现心房钠尿肽信号广泛分布于呼吸系统,并且发挥着重要的调节作用如影响肺表面活性物质的产生和功能等[11]。既往有临床观察发现哮喘患者血浆中的心房钠尿肽含量较缓解期含量有显著升高[6],但其在哮喘发病中的具体作用至今不清楚。我们在此次的实验观察中发现哮喘小鼠肺局部的心房钠尿肽水平较对照组明显升高,结果和既往临床观察患者外周血类似,提示心房钠尿肽信号与哮喘发病有关。因此,为了进一步分析心房钠尿肽在过敏性哮喘发病尤其是在过敏性气道炎症及气道高反应性中的作用,我们首次利用经鼻滴入方法在体观察心房钠尿肽在过敏性哮喘发病的作用。肺组织病理学等结果发现外源性给予心房钠尿肽可加剧过敏性气道炎症反应。
我们前期研究也发现,心房钠尿肽信号参与机体免疫调节,在体外可抑制Th17细胞的分化与功能[8]。而气道免疫失衡即Th2细胞应答优势化被公认为过敏性哮喘的主要发病机制,其中Th2相关细胞因子诱导的气道嗜酸粒细胞炎症是其重要特征,也是其病理生理过程形成的驱动和维持因素[1]。因此我们设想,心房钠尿肽是否通过影响Th2型细胞应答而发挥促进过敏性哮喘气道反应的作用。于是,我们通过使用外源性的心房钠尿肽及其拮抗剂进行在体干预,观察过敏性哮喘小鼠在接受干预后,其气道炎症反应及其气道局部Th2型细胞应答的变化情况。结果发现外源性的心房钠尿肽可以明显提升反映气道局部的肺泡灌洗液中以及反映肺组织的匀浆上清中的IL-4、IL-5、IL-13即Th2型细胞因子的分泌水平,暗示ANP可能通过促进Th2型细胞应答从而加剧过敏性气道炎症反应;而提前使用心房钠尿肽受体拮抗剂,其效应基本消失。已知特异性转录因子GATA3的表达是Th2细胞分化及功能成熟的基础,可促进局部IL-4细胞因子的合成分泌,形成有利于Th2细胞分化成熟的微环境,并调节许多过敏相关性细胞因子的表达如IL-5、IL-13,从而诱导嗜酸细胞在气道的趋化浸润[12, 13];而本次研究中证实外源性心房钠尿肽可以促进肺组织中GATA3蛋白的表达,综上提示心房钠尿肽信号可通过影响Th2型应答而参与过敏性气道炎症反应的调节。
但是,经鼻滴入心房钠尿肽却可缓解过敏性哮喘的气道高反应性,似乎与促进气道炎症效应不一致。既往也有研究发现经静脉注射或雾化吸入外源性的心房钠尿肽也可降低哮喘患者的支气管痉挛及对乙酰甲胆碱的高反应性[14, 15],但其作用机制仍不清楚,有研究推测一方面可能与心房钠尿肽信号介导其它细胞释放NO从而舒张气管有关;另一方面则可能源于其对气道平滑肌的直接作用,因为它能降低细胞内Ca2+水平使平滑肌细胞松弛[16]。而心房钠尿肽被证实能增强中性粒细胞的活性和迁移,上调CD11b的表达和过氧化氢的产生[17];并可诱导肥大细胞释放组胺[18],这些证据似乎也与心房钠尿肽的缓解气道高反应作用相悖。因此,心房钠尿肽促进过敏性气道炎症反应的同时可部分缓解气道高反应性,可能具有不同的效应机制和组织微环境差异性[11],值得更进一步的研究。
综上所述,本实验首次通过经鼻滴入观察外源性心房钠尿肽在小鼠过敏性哮喘气道炎症及气道高反应性中的作用,明确了心房钠尿肽具有减轻气道高反应性作用,同时还发现外源性心房钠尿肽可通过诱导肺局部Th2型应答促进过敏性气道炎症反应。因此,鉴于外源性心房钠尿肽可能具有的致炎效应,故探讨心房钠尿肽在哮喘治疗中的潜能需要更深入的研究。
| [1] | Umetsu DT, McIntire JJ, Akbari O, et al. Asthma: an epidemic of dysregulated immunity[J]. Nat Immunol, 2002, 3(8): 715-720. DOI: 10.1038/ni0802-715. |
| [2] | Ngoc PL, Gold DR, Tzianabos AO, et al. Cytokines, allergy, and asthma[J]. Curr Opin Allergy Clin Immunol, 2005, 5(2): 161-166. DOI: 10.1097/01.all.0000162309.97480.45. |
| [3] | Vesely DL. Atrial natriuretic peptides in pathophysiological diseases[J]. Cardiovasc Res, 2001, 51(4): 647-658. DOI: 10.1016/S0008-6363(01)00256-5. |
| [4] | Silberbach M, Roberts Jr CT. Natriuretic peptide signalling: molecular and cellular pathways to growth regulation[J]. Cell Signal, 2001, 13: 221-231. DOI: 10.1016/S0898-6568(01)00139-5. |
| [5] | Perreault T, Gutkowska J. Role of atrial natriuretic factor in lung physiology and pathology[J]. Am J Respir Crit Care Med, 1995, 151(1): 226-242. DOI: 10.1164/ajrccm.151.1.7812560. |
| [6] | 潘金兵, 张铁栓, 侯宇虹, 等. 支气管哮喘患者血浆心钠素、C型利钠肽的水平及临床意义[J]. 中华结核与呼吸杂志, 2000, 30(9): 521. |
| [7] | Vollmar AM. Influence of atrial natriuretic peptide on thymocyte development in fetal thymic organ culture[J]. J Neuroimmunol, 1997, 78(1-2): 90-96. DOI: 10.1016/S0165-5728(97)00086-6. |
| [8] | Ma LB, Li JX, Wang GY, et al. Atrial natriuretic peptide suppresses Th17 development through regulation of cGMP-dependent protein kinase and PI3K-Akt signaling pathways[J]. Regul Pept, 2013, 181: 9-16. DOI: 10.1016/j.regpep.2012.12.003. |
| [9] | Ma LB, Xiang XD. Atrial natriuretic peptide/natriuretic peptide receptor A (ANP/NPRA) signaling pathway: A potential therapeutic target for allergic asthma[J]. Med Hypotheses, 2011, 77(5): 832-833. DOI: 10.1016/j.mehy.2011.07.048. |
| [10] | Gong SB, Li JX, Ma LB, et al. Blockade of dopamine D1-like receptor signalling protects mice against OVA-induced acute asthma by inhibiting B-cell activating transcription factor signalling and Th17 function[J]. FEBS J, 2013, 280(23): 6 262-6 273. DOI: 10.1111/febs.12549. |
| [11] | 张莉, 马礼兵, 向旭东. 利钠肽系统与支气管哮喘免疫[J]. 中华哮喘杂志:电子版, 2010, 4(5): 380-383. |
| [12] | Farrar JD, Ouyang W, LohningM, et al. An instructive component in T helper cell type 2 (Th2) development mediated by GATA3[J]. J Exp Med, 2001, 193(5): 643-650. DOI: 10.1084/jem.193.5.643. |
| [13] | Lee HJ, Takemoto N, Kurata H, et al. GATA3 induces T helper cell type 2(Th2) cytokine expression and chromatin remodeling in committed Th1 cells[J]. J Exp Med, 2000, 192(1): 105-115. DOI: 10.1084/jem.192.1.105. |
| [14] | Angus RM, McCallum MJ, Hulks G, et al. Bronchodilator, cardiovascular, and cyclic guanylyl monophosphate response to high-dose infused atrial natriuretic peptide in asthma[J]. Am Rev Respir Dis, 1993, 147(5): 1 122-1 125. DOI: 10.1164/ajrccm/147.5.1122. |
| [15] | Angus RM, McCallum MJ, Thomson NC. Effect of inhaled atrial natriuretic peptide on methacholine induced bronchoconstriction in asthma[J]. Clin Exp Allergy, 1994, 24(8): 784-788. DOI: 10.1111/cea.1994.24.issue-8. |
| [16] | Hellermann G, Kong X, Gunnarsdóttir J, et al. Mechanism of bronchoprotective effects of a novel natriuretic hormone peptide[J]. J Allergy Clin Immunol, 2004, 113(1): 79-85. DOI: 10.1016/j.jaci.2003.10.009. |
| [17] | Izumi T, Saito Y, Kishimoto I, et al. Blockade of the natriuretic peptide receptor guanylyl cyclase-A inhibits NF-KB activation and alleviates myocardial ischemia/reperfusion injury[J]. J Clin Invest, 2001, 108(2): 203-213. DOI: 10.1172/JCI12088. |
| [18] | Yoshida H, Inagaki Y, Yamaki K, et al. Histamine release induced by human natriuretic peptide from rat peritoneal mast cells[J]. Regul Pept, 1996, 61(1): 45-49. DOI: 10.1016/0167-0115(95)00136-0. |
 2016, Vol. 37
2016, Vol. 37

