动脉粥样硬化(atheroclerosis,AS)是常见的心血管疾病之一, 进而会引发冠心病、脑梗死等严重疾病。研究结果表明,AS是一种慢性炎症疾病:过高的低密度脂蛋白(low density lipoprotein,LDL)在体内的氧化修饰形成氧化型低密度脂蛋白(oxidized LDL, Ox-LDL),促进炎症反应,使血管壁慢慢积累由修饰的脂质、炎症细胞、内皮细胞、泡沫细胞等形成的坏死性斑块,堵塞血管[1],从而诱发AS等一系列疾病,但到目前为止LDL的氧化机制尚未清楚。在本实验室之前研究中,利用高效液相色谱测定Raw264.7细胞经LDL诱导15 min后脂质筏中脂类物质,发现细胞脂质筏中单不饱和脂肪酸(monounsaturated fatty acids, MUFAs)含量增加,多不饱和脂肪酸(polyunsaturated fatty acids, PUFAs)含量减少,而这些不饱和脂肪酸的变化可能由磷脂酶A2(phospholipase A2, PLA2)的活性变化导致。PLA2存在于动物各个组织的细胞膜上,它水解甘油磷脂分子中的Sn-2位的脂酰键, 产物为溶血磷脂和不饱和脂酸,大多数为花生四烯酸[2],在形成AS的过程中内皮损伤、血脂沉积、炎症反应等都有PLA2参与,而不饱和脂肪酸则可以作为第二信使,在各种信号通路中起作用[3, 4]。本实验室的另一研究中发现利用LDL刺激Raw264.7细胞后可以促进脂质筏的聚集与形成,同时促进脂质筏蛋白质组组成发生变化,并且在定量蛋白质组学数据中发现FABP5等各种蛋白质的含量发生改变。FABP5属于脂质结合蛋白超家族的一员,它的分子质量为15 kU, 与多种维生素和长链脂肪酸结合的能力很强,主要参与细胞脂肪酸的代谢、转运,炎症反应和代谢调节[5]。那么利用LDL刺激Raw264.7细胞后FABP5和PLA2会不会发生变化?FABP5在脂筏里会有什么变化呢?利用UFAs刺激Raw264.7细胞后FABP5会发生什么变化呢?我们设计进行了以下实验,并获得了一些实验数据。
1 材料与方法 1.1 主要试剂与仪器Raw264.7细胞为实验室保存, LDL来源于以色列Pro Spec-Tany公司。FABP5兔单克隆抗体购自美国CST公司,小鼠flotilin-1抗体购自美国BD公司;PLA2总活性光度法定量检测试剂盒购自上海杰美基因医药科技公司,油酸、亚油酸、花生四烯酸购自上海晶纯生化科技股份有限公司。
1.2 细胞培养利用含90%DMEM,10%胎牛血清,1%青霉素-链霉素的配制的完全培养基复苏RAW264.7细胞,在90%湿度,5%CO2,37 ℃条件下培养,传代。
1.3 LDL处理RAW264.7细胞细胞密度到达80%左右时,加入无血清的DMEM同步化2 h以上,后加入LDL(终浓度100 μg/ml,含终浓度为1 μmol/L的Cu2+)进行不同时间的孵育。超声破碎仪将LDL刺激的细胞进行破碎,取上清备用。
1.4 PLA2总活性光度法定量检测试剂盒测定细胞内PLA2活性变化收集LDL刺激后的细胞裂解离心取上清,分别将反应工作液加到样品对照孔和样品活性孔,在室温下孵育60 min,分别加入显色液,在室温下孵育5 min,即可放入酶标仪检测:获得背景和样品活性读数。活性计算如下:
[(样品读数—背景读数)×样品稀释倍数×0.20(体系容量;ml)]÷[0.02(样品容量;ml)×13.6(mmol吸光系数)×0.6(光径距离;cm)×60(反应时间;min)]=U/ml÷(样品蛋白浓度)mg/ml=U/ml(单位=μmol巯基磷脂酸胆碱/min)
1.5 利用Real-Time PCR检测FABP5 mRNA的水平提取细胞总RNA, 设计引物18S rRNA上游引物为5′-CGGCTACCACATCCAAGGAA-3′, 下游引物为5′-GCTGGAATTACCGCGGCT-3′;FABP5上游引物5′-ACGGTCAAAACCGAGAGCA-3′,下游引物5′-CACTCTGGCAGCTAACTCCT-3′;逆转录42 ℃ 60 min,70 ℃ 10 min, 16 ℃ 4 min。配制qPCR反应体系,设定PCR扩增程序,上机。结果处理的方法如下:相对定量2—ΔΔCt法, ΔCt(实验组)= Ct(实验组目的基因)-Ct(实验组内参基因); ΔCt(对照组)= Ct(对照组目的基因)-Ct(对照组内参基因); ΔΔCt=ΔCt(实验组)-ΔCt(对照组); 表达倍数=2-ΔΔCt。
1.6 提取细胞脂筏和非脂筏采用本实验室参照文献建立的蔗糖密度梯度超高速离心法提取脂质筏[6]。顶替法铺梯度:将4 ml Base Buffer置于12 ml离心管管底,4 ml含20% OpliprepTM分离液的Base Buffer置于管底顶替底部4 ml Base Buffer,再将含25% OpliprepTM分离液的细胞裂解上清Base Buffer置于管底顶替底部含20% OpliprepTM分离液的Base Buffer。超高速冷冻离心机52 000 g, 4 ℃离心1.5 h。用移液枪从顶部每667 μl为一层共取18层,6, 7, 8层经标志蛋白Flotillin-1的鉴定为脂质筏,其余为非脂筏层。将脂筏层和非脂筏层冷冻干燥浓缩后备用。
1.7 不同浓度的油酸(OA)、亚油酸(ALA)、花生四烯酸(AA)刺激细胞油酸溶解于无水乙醇中配成200 mmol/L油酸储存液于-80 ℃备用。BSA溶于DMEM中配成0.1 mmol/L BSA/DMEM溶液,滤器过滤无菌保存在4 ℃。用配好的BSA/DMEM将油酸储存液稀释成1 mmol/L的油酸工作液。用以上办法同时配制500 μmol/L的亚油酸工作液和100 μmol/L花生四烯酸工作液,分别处理细胞1, 3, 5, 12 h。收集细胞裂解液备用。
1.8 利用Western Blot检测FABP5表达将LDL刺激的细胞样品、提取细胞脂筏和非脂筏、不同浓度的OA, ALA, AA刺激细胞后这三种样品进行SDS-PAGE电泳后,150 mA横流转膜2 h,脱脂奶粉封闭2 h,附一抗4 ℃过夜。附二抗2 h,显影后进行条带分析。
1.9 统计学分析用统计分析软件SPSS进行统计学分析,实验数据以均数±标准差表示,采用Graphpad Prism5统计软件进行作图,用t检验比较两组间均数,以P < 0.05为差异有统计学意义。
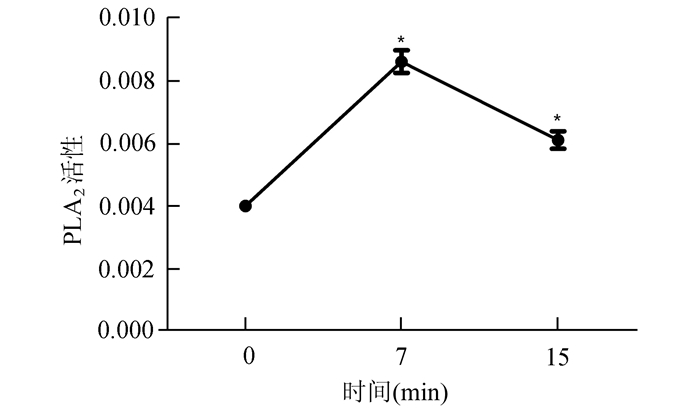
2 结果 2.1 LDL刺激使细胞内PLA2活性增加浓度为100 μg/ml的LDL分别刺激Raw264.7细胞0, 7, 15 min,利用PLA2总活性分光光度法定量检测试剂盒测定细胞内PLA2活性变化:刺激后酶的活性均增高,刺激7 min后酶的活性增高大约两倍(0.008 60±0.000 36, P < 0.05),刺激15 min后酶的活性增高大约1.5倍(0.000 61±0.000 28, P < 0.05)(图 1)。
|
图 1 LDL刺激Raw264.7细胞0, 7, 15 min后PLA2活性变化图 n>3, *P < 0.05 |
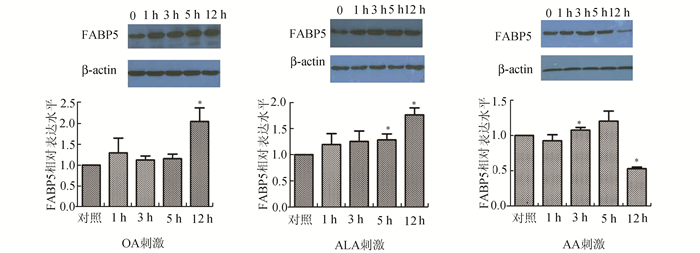
分别用浓度为1 mmol/L的OA、500 μmol/L的ALA和100 μmol/L AA刺激Raw264.7细胞1, 3, 5, 12 h后收集细胞,利用Western Blot技术分析细胞内FABP5表达的情况,数据表明:OA刺激细胞12 h后,FABP5的表达量上升(2.059±0.317,P<0.05)。ALA刺激细胞5 h后FABP5的表达量上升(1.280±0.126,P<0.05),刺激细胞12 h后FABP5的表达量也上升(1.743±0.167,P<0.05)。AA刺激细胞3 h后,FABP5的表达量上升(1.091±0.333,P<0.05)。刺激细胞12 h后,FABP5的表达量下降(0.537±0.008,P<0.01)(图 2)。
|
图 2 油酸、亚油酸、花生四烯酸刺激后细胞内FABP5表达变化 n=3, *P < 0.05 |
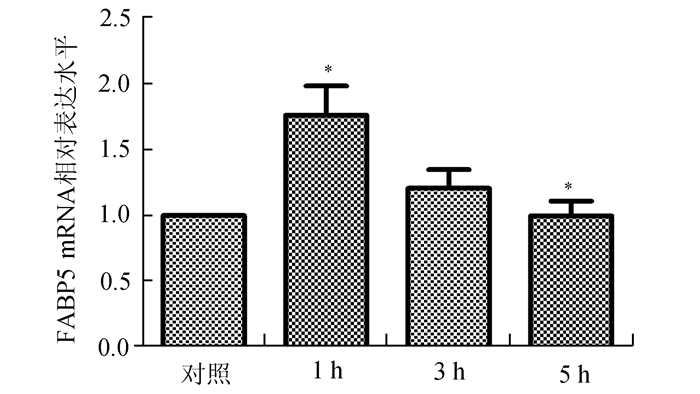
利用浓度为100 μg/ml的LDL诱导RAW264.7细胞1, 3, 5 h后real time-PCR检测FABP5 mRNA的表达水平(图 3)。与对照组比较,LDL刺激细胞1 h FABP5 mRNA表达升高(1.752 1±0.315 7,P<0.05),在刺激5 h后mRNA出现回落(1.036±0.107,P<0.05)。
|
图 3 LDL刺激RAW264.7细胞后FABP5 mRNA的表达变化 n=3, *P<0.05 |
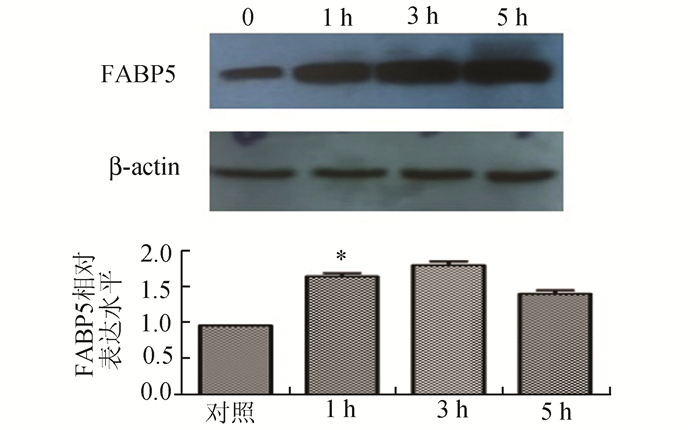
利用浓度为100 μg/ml的LDL刺激细胞1, 3, 5 h后,收集细胞,利用Western Blot技术分析细胞内FABP5表达的情况,数据表明:刺激细胞1 h后FABP5的表达量上升(1.707±0.040,P<0.05)(图 4)。
|
图 4 LDL刺激Raw 264.7细胞后FABP5表达的变化 n=3, *P<0.05 |
提取脂筏和非脂筏冷冻干燥浓缩后,Western Blot技术分析细胞内FABP5表达的情况。FABP5的变化量如图 5:脂筏FABP5的表达量较对照组增加(2.620±0.065,P<0.05),LDL刺激Raw 264.7 15 min非脂筏FABP5的表达量较对照组减少(0.661±0.073,P<0.05)。这可以间接证明LDL刺激后FABP5发生了从非脂质筏到脂质筏的转位。
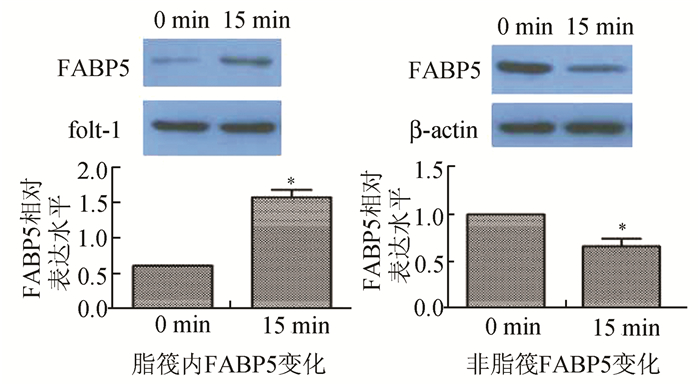
|
图 5 LDL刺激Raw 264.7细胞后FABP5从非脂筏到脂筏的转位变化 n=3, *P<0.05 |
研究表明,在巨噬细胞中FABP5的表达可以加快代谢调节反应和炎症反应[7],FABP5与脂肪酸存在很强的亲和力,而PLA2又是膜磷脂脂肪酸代谢的关键酶,在许多的神经退行性疾病的发病机制中,PLA2的激活与其炎症反应和氧氮化应激十分相关[8],而LDL的氧化过程是一个多因子参与的过程。所以我们认为这几种因子相互联系在LDL的氧化过程中起作用,这些也在实验中得到了证明。
有文献发现长链脂肪酸尤其是多不饱和脂肪酸(PUFAs)如花生四烯酸、棕榈酸油酸、亚油酸激活PPARs,同时FABP5能增强核受体PPAR受体β的转录活性[9]。PPARs属于配体激活核激素受体超家族,有三个不同的亚型:α、β、γ,PPARs与心血管疾病如心律失常、心肌肥大等联系密切,并参与代谢调节氧化应激炎症反应等过程[9],它与相应的配体结合后转位到细胞核并改变自身构象,再与维甲酸X受体(RXR)形成异二聚体识别并结合目标基因及其周围序列构成的反应元件PPRE,调控下游基因的表达,从而产生包括氧化应激在内的多种生物学效应[10]。基于以上文献参考和实验研究,我们对于LDL在细胞中的氧化提出了新的思路:使PLA2(也可能是其他的磷脂酶)活性升高,磷脂酶水解脂肪酸形成油酸、亚油酸、花生四烯酸等不饱和脂肪酸作为第二信使,它们会招募并结合FABP5作为配体与PPARs特异性位点结合后:再与维甲酸X受体(RXR)形成异二聚体识别并结合目标基因反应元件PPRE调控下游基因的表达,从而产生包括LDL氧化在内的多种生物学效应。
在本实验中我们还发现LDL刺激细胞15 min后,FABP5发生了从非脂筏到脂筏的转位,进一步证实了LDL氧化的部位可能在脂筏内。另外在LDL主动氧化的过程中应该存在一个氧化修饰标签,结合了标签的LDL分子就一定会被相关细胞捕获并氧化的LDL,破坏血管稳态。近期的文献报道,人血管紧张素Ⅱ(angiotensinⅡ, AgⅡ)与人血中LDL水平密切相关。而且在高脂血症中,AgⅡ上调血管紧张素Ⅱ受体(AT1)的表达、促进泡沫细胞的形成[11],我们有理由预测AgⅡ可能就是这个标签。在后续的实验中我们将会利用UFAs刺激细胞,测定脂筏内FABP5的表达的变化以及转位情况,也会继续对AgⅡ,磷脂酶A1,A2,B1和PPARs作更细致的研究,探究它们与LDL氧化之间的关系,揭示LDL氧化机制,进而构建血管稳态调控网络。
| [1] | Galkina E, Ley K. Immune and inflammatory mechanisms of atherosclerosis[J]. Annu Rev Immunol, 2009, 27: 165-197. DOI: 10.1146/annurev.immunol.021908.132620. |
| [2] | Sun GY, Chuang DY, Zong Y, et al. Role of cytosolic phospholipase A2 in oxidative and inflammatory signaling pathways in different cell types in the central nervous system[J]. Mol Neurobiol, 2014, 50(1): 6-14. DOI: 10.1007/s12035-014-8662-4. |
| [3] | Murakami M, Taketomi Y, Miki Y, et al. Recent progress in phospholipase A(2) research: from cells to animals to humans[J]. Prog Lipid Res, 2011, 50(2): 152-192. DOI: 10.1016/j.plipres.2010.12.001. |
| [4] | Calder PC. The relationship between the fatty acid composition of immune cells and their function[J]. Prostaglandins Leukot Essent Fatty Acids, 2008, 79(3-5): 101-108. DOI: 10.1016/j.plefa.2008.09.016. |
| [5] | Ohata T, Yokoo H, Kamiyama T, et al. Fatty acid-binding protein 5 function in hepatocellular carcinoma through induction of epithelial-mesenchymal transition[J]. Cancer Med, 2017, 6(5): 1049-1061. DOI: 10.1002/cam4.1020. |
| [6] | Song J, Ping LY, Duong DM, et al. Native low density lipoprotein promotes lipid raft formation in macrophages[J]. Mol Med Rep, 2016, 13(3): 2087-2093. DOI: 10.3892/mmr.2016.4781. |
| [7] | Furuhashi M, Ishimura S, Ota H, et al. Lipid chaperones and metabolic inflammation[J]. Int J Inflam, 2011, 2011: 642612. |
| [8] | Sun GY, Chuang DY, Zong Y, et al. Role of cytosolic phospholipase A2 in oxidative and inflammatory signaling pathways in different cell types in the central nervous system[J]. Mol Neurobiol, 2014, 50(1): 6-14. DOI: 10.1007/s12035-014-8662-4. |
| [9] | Lee WS, Kim J. Peroxisome proliferator-activated receptors and the heart: lessons from the past and future directions[J]. PPAR Res, 2015, 2015: 271983. |
| [10] | Drakaki A, Hatziapostolou M, Polytarchou C, et al. Functional microRNA high throughput screening reveals miR-9 as a central regulator of liver oncogenesis by affecting the PPARA-CDH1 pathway[J]. BMC Cancer, 2015, 15: 542. DOI: 10.1186/s12885-015-1562-9. |
| [11] | Long H, Wang L, Su H, et al. Increased circulatory RAS activity can be inhibited by statins in patients with hypercholesterolemia[J]. J Renin Angiotensin Aldosterone Syst, 2015, 16(1): 126-130. DOI: 10.1177/1470320313483349. |
 2018, Vol. 39
2018, Vol. 39


