2. 中国科学院心理研究所 北京 100101;
3. 中国科学院自动化研究所 北京 100190
2. Institute of Psychology, Chinese Academy of Sciences, Beijing 100101, China;
3. Institute of Automation, Chinese Academy of Sciences, Beijing 100190, China
精神分裂症是临床上常见的精神障碍性疾病,其病因至今未明,终身发病率约1%。据报道,脑结构的改变是精神分裂症的病理生理基础。精神分裂症患者在前扣带回、额叶、颞叶、海马、杏仁核、丘脑及脑岛等多个脑区存在灰质体积下降[1-5]。有荟萃分析发现[6, 7],慢性精神分裂症患者脑萎缩区域与首发精神分裂症患者存在明显差异,前者范围较后者明显扩展增大。这些均提示精神分裂症为一种进行性疾病[8],在疾病的不同阶段会累积不同的脑区, 而疾病的反复发作可能为其中影响因素之一。由于慢性精神分裂症患者脑结构影响因素的复杂性,一些研究也未发现首发精神分裂症患者脑结构的进行性变化[9-11],使得上述观点仍然受到争论[12]。
本研究采用基于体素的形态测量学(voxel-based morphometry, VBM)方法[13]对首发和复发精神分裂症患者灰质体积进行比较,以期验证首发精神分裂症患者灰质体积减少区域和这些区域是否同样出现在复发患者中并出现扩大。
1 资料与方法 1.1 受试者一般情况本研究纳入的28例首发及27例复发精神分裂症病人,均来自武汉大学人民医院住院病人。入组标准包括:①符合DSM-Ⅳ精神分裂症的诊断标准;②经DSM-Ⅳ-TR轴Ⅰ障碍临床定式检查评定为精神分裂症;③对于首次发作,病程少于3年,规律服用药物时间少于2周者纳入首发组,对于有超过一次明显发作史者纳入复发组;④排除器质性脑部疾病, 无电休克和严重躯体疾病史;⑤均为右利手;⑥无毒品服用史,无烟酒滥用史;⑦愿意配合;⑧无核磁共振成像检查的禁忌证。正常受试者均来源于社会招募,共纳入40例。入组标准为:①无精神障碍及精神障碍家族病史;②右利手;③无毒品服用史及烟酒滥用史;④无严重躯体器质性疾病;⑤无核磁共振成像检查的禁忌证。所有受试者均来自武汉及其周边地区且均已签署知情同意书,病人组采用阳性和阴性症状量表(PANSS)对其精神症状进行评定。记录所有病人在采集影像数据时的用药情况并计算为等效氯丙嗪剂量[14]。本研究已获得武汉大学人民医院伦理审查委员会批准。
1.2 影像数据的采集本研究采用3.0T GE Singa HDxt磁共振成像仪进行扫描,扫描线圈为八通道头线圈,由武汉大学人民医院一名放射科医生完成,扫描时要求受试者闭眼平卧,将头部固定以避免头动而产生伪影。首先进行常规T1、T2加权扫描,由一名经验丰富的放射科医生阅读以排除明显的脑器质性改变,然后以矢状位3D BRAVO扫描序列扫描以获得3D T1图像。扫描参数如下:TR=7.8 ms,TE=3.0 ms,翻转角(FA)=7 °,层厚=1.0 mm,矩阵256×256,体素大小=1.00 mm×1.00 mm×1.00 mm,共扫描188层。
1.3 影像数据预处理首先对所有受试者原始T1数据进行伪影检查和分辨率检查,在使用MRIcron将原始数据转化为可用格式后,使用SPM8(http://www.fil.ion.ucl.ac.uk/spm/software/spm8/)将所有受试者图像的原点校正到前联合以减少误差,然后使用MATLAB 8.2(The Math Works Inc,USA)、SPM8及VBM8工具箱(http://dbm.neuro.uni-jena.de/)对T1数据进行处理[13],然后将得到的经过调制的,即代表灰质体积的图像进行平滑处理,即使用各向同性10 mm半极大值处全宽度(full width at half-maximum,FWHM)高斯核进行平滑。
1.4 统计学分析将受试者分为对照组、首发组和复发组,使用SPM8对3组图像数据进行协方差分析,将性别、年龄、教育年限和颅内体积作为不感兴趣因素加入协变量,得到3组间的总体差异结果(FWE校正,P<0.05)。然后将上述总体差异区域中的各个团块作为感兴趣区(region of interest, ROI),利用Easy Volumes (http://www.sbirc.ed.ac.uk/cyril/index.html)测量所有被试各ROI的灰质体积,并采用方差分析比较3组之间差异。一般人口学资料均使用SPSS 20.0进行统计分析。
2 结果 2.1 一般资料分析首发组、复发组及对照组在性别、年龄、教育年限等方面无统计学差异(表 1)。首发组和复发组在首发年龄及等效氯丙嗪剂量方面无统计学差异。首发组平均病程为(13.6±10.1)月,远小于复发组的(60.4±44.2)月,且两者在PANSS评分方面无明显差异。
| 表 1 受试者一般资料表 |
与正常对照相比,首发组和复发组均有显著灰质体积下降,而首发组和复发组之间未见明显差异(表 2)。
| 表 2 3组之间灰质体积差异峰值点 |
如图 1及表 2所示,3组之间的差异主要在如下3个区域:①双侧内侧前额叶、前扣带回;②右侧罗兰氏岛盖及缘上回;③左侧额中回。
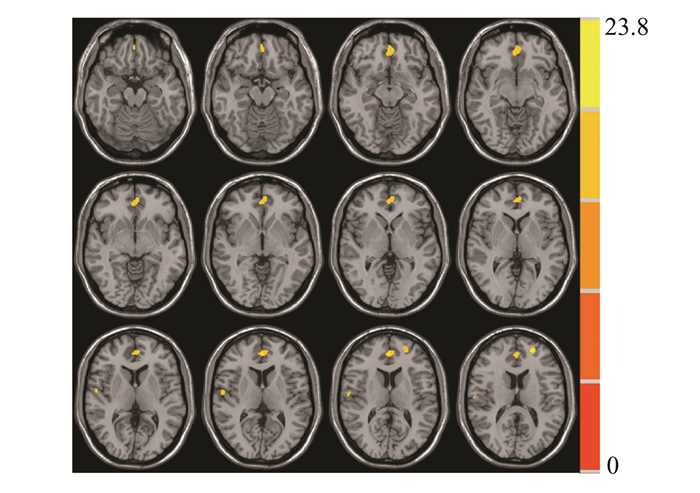
|
图 1 3组之间灰质体积存在差异的区域 |
根据VBM分析结果,将上述3个差异区域作为感兴趣区分别测量灰质体积,其方差分析结果如图 2所示,精神分裂症病人在内侧前额叶区域、左侧额中回区域及右侧罗兰氏岛盖部区域较对照组确实存在灰质体积下降,但复发病人相较首发病人仅在右侧罗兰氏岛盖部区域(包括右侧缘上回)存在灰质体积下降。
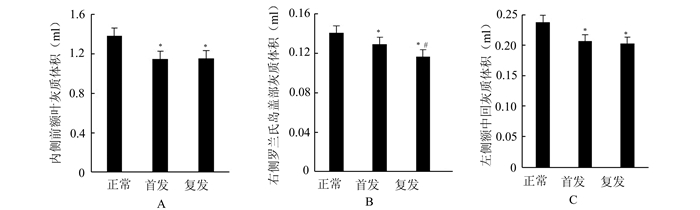
|
图 2 ROI灰质体积在3组之间的差异 与正常组相比,*P<0.05;与首发组相比,#P<0.05 |
不同于过往的感兴趣区分析方法,VBM方法不需要先验假设,可客观的在体素水平上对整个大脑结构进行自动的分析[15],从而极大地减少了研究者主观因素的影响。
本研究中,一些可对灰质体积产生影响的因素(如首发年龄、扫描时的氯丙嗪等效剂量、精神病理等)在病例组之间无明显差异。研究结果显示,与正常对照相比,首发精神分裂症病人存在较广泛的灰质体积下降区域,包括前扣带回、双侧内侧前额叶、右侧罗兰氏岛盖、左侧额中回等。首发组排除了长期使用抗精神病药物对灰质结构的影响,从而可尽可能的显示疾病本身的自然发展过程。据研究显示,高危人群或处于发病前期的精神分裂症患者就已经存在较明显脑结构改变[16-19],并且某些脑结构的改变可对高危人群随后的发病起到一定的预测作用[20, 21]。因此,随着类似研究的不断进展,精神分裂症的神经发育学说[22]已得到了广泛认可,人们逐渐认识到精神分裂症是在遗传和神经发育缺陷基础上产生的。
而对于复发精神分裂病人,其灰质体积下降的脑区不仅包含所有在首发组中受影响的区域而且右侧罗兰氏岛盖部和缘上回的体积出现进一步下降。可见,在平均病程相差4年的两组之间,仅缘上回和罗兰氏岛盖部出现进一步的灰质改变。与国外一类似研究的结果有些不符[23],可能是受到样本差异、平滑核的大小及病例组之间平均病程的间隔时间等的影响。虽然不能完全肯定,但由于本研究中,首发组和复发组在各项影响因素之间均为匹配,可以认为两者可代表同一人群同一疾病的不同发展阶段,而不是两个完全不同的疾病人群[23]。
本研究中,无论首发组还是复发组均存在广泛脑结构改变,且大部分处于默认网络中,如内侧前额叶。默认网络具有监控内外环境的属性,当有外在任务活动时负激活,而静息状态下进行内部心理活动时则正激活[24-26]。有研究发现[27-31],精神分裂患者的默认网络可出现结构和功能异常,提示默认网络脑区的异常可能是精神分裂症的神经病理机制之一。
本研究可进一步加强过往研究的结果[6-8],即精神分裂症为一种进行性发展疾病。病人在首次发作后,灰质体积仍会有进行性的降低,且疾病发展的最初几年往往是部分脑区萎缩最快的时期。虽然长期使用抗精神病药可引起脑灰质体积的改变[32-35],但其报道最一致的脑区主要为额颞叶、扣带回、脑岛和基底核,而罗兰氏岛盖部和缘上回少有报道,因此,我们更有理由相信,罗兰氏岛盖部和缘上回是受到疾病本身的发展所致。同时,本研究也与最近一研究结果相一致[36],均提示复发可对大脑结构的完整性产生负面作用。这就提示我们,在临床的治疗过程中,应注意避免患者病情的复发。
本研究同时也存在一些不足。首先,我们不能排除不同病情和预后对灰质体积的影响,并不是所有首发病人都会进入慢性期,且病情越重的病人其灰质体积下降程度也越大,累积的脑区也越大[37],因此,病情较重,预后较差的病人在首发时就有可能较病情轻者存在更广泛的脑结构损害。其次,精神分裂症患者脑结构还是属于微小的变化,为避免犯第二类错误,需要较大的样本数,因此,本研究中较少的病例数也是不足之处之一。
总之,在本研究中,我们发现首发精神分裂症患者存在较广泛灰质体积下降,而复发患者也存在同样形式的脑结构改变并在某些脑区出现进一步的扩大。因此,本研究可进一步证明,精神分裂症患者在首次发作后仍会有脑结构的进行性改变,且默认网络结构的改变可能是精神分裂症的病理生理机制之一。
| [1] | Fornito A, Yucel M, Patti J, et al. Mapping grey matter reductions in schizophrenia:an anatomical likelihood estimation analysis of voxel-based morphometry studies[J]. Schizophr Res, 2009, 108(1-3): 104-113. DOI: 10.1016/j.schres.2008.12.011. |
| [2] | Bora E, Fornito A, Radua J, et al. Neuroanatomical abnormalities in schizophrenia:a multimodal voxelwise meta-analysis and meta-regression analysis[J]. Schizophr Res, 2011, 127(1-3): 46-57. DOI: 10.1016/j.schres.2010.12.020. |
| [3] | Honea R, Crow TJ, Passingham D, et al. Regional deficits in brain volume in schizophrenia:a meta-analysis of voxel-based morphometry studies[J]. Am J Psychiatry, 2005, 162(12): 2 233-2 245. DOI: 10.1176/appi.ajp.162.12.2233. |
| [4] | Shepherd AM, Laurens KR, Matheson SL, et al. Systematic meta-review and quality assessment of the structural brain alterations in schizophrenia[J]. Neurosci Biobehav Rev, 2012, 36(4): 1 342-1 356. DOI: 10.1016/j.neubiorev.2011.12.015. |
| [5] | Adriano F, Spoletini I, Caltagirone C, et al. Updated meta-analyses reveal thalamus volume reduction in patients with first-episode and chronic schizophrenia[J]. Schizophr Res, 2010, 123(1): 1-14. DOI: 10.1016/j.schres.2010.07.007. |
| [6] | Vita A, De Peri L, Silenzi C, et al. Brain morphology in first-episode schizophrenia:a meta-analysis of quantitative magnetic resonance imaging studies[J]. Schizophr Res, 2006, 82(1): 75-88. DOI: 10.1016/j.schres.2005.11.004. |
| [7] | Ellison-Wright I, Glahn DC, Laird AR, et al. The anatomy of first-episode and chronic schizophrenia:an anatomical likelihood estimation meta-analysis[J]. Am J Psychiatry, 2008, 165(8): 1 015-1 023. DOI: 10.1176/appi.ajp.2008.07101562. |
| [8] | Vita A, De Peri L, Deste G, et al. Progressive loss of cortical gray matter in schizophrenia:a meta-analysis and meta-regression of longitudinal MRI studies[J]. Transl Psychiatry, 2012, 2: e190. DOI: 10.1038/tp.2012.116. |
| [9] | DeLisi LE, Hoff AL. Failure to find progressive temporal lobe volume decreases 10 years subsequent to a first episode of schizophrenia[J]. Psychiatry Res, 2005, 138(3): 265-268. DOI: 10.1016/j.pscychresns.2005.02.005. |
| [10] | Whitworth AB, Kemmler G, Honeder M, et al. Longitudinal volumetric MRI study in first-and multiple-episode male schizophrenia patients[J]. Psychiatry Res, 2005, 140(3): 225-237. DOI: 10.1016/j.pscychresns.2005.07.006. |
| [11] | Roiz-Santianez R, Perez-Iglesias R, Ortiz-Garcia DLFV, et al. One year longitudinal study of the straight gyrus morphometry in first-episode schizophrenia-spectrum patients[J]. Psychiatry Res, 2012, 202(1): 80-83. DOI: 10.1016/j.pscychresns.2011.10.001. |
| [12] | Zipursky RB, Reilly TJ, Murray RM. The myth of schizophrenia as a progressive brain disease[J]. Schizophr Bull, 2013, 39(6): 1 363-1 372. DOI: 10.1093/schbul/sbs135. |
| [13] | Good CD, Johnsrude IS, Ashburner J, et al. A voxel-based morphometric study of ageing in 465 normal adult human brains[J]. Neuroimage, 2001, 14(1 Pt 1): 21-36. |
| [14] | Andreasen N C, Pressler M, Nopoulos P, et al. Antipsychotic dose equivalents and dose-years:a standardized method for comparing exposure to different drugs[J]. Biol Psychiatry, 2010, 67(3): 255-262. DOI: 10.1016/j.biopsych.2009.08.040. |
| [15] | Perlini C, Bellani M, Brambilla P. Structural imaging techniques in schizophrenia[J]. Acta Psychiatr Scand, 2012, 126(4): 235-242. DOI: 10.1111/acps.2012.126.issue-4. |
| [16] | Borgwardt SJ, McGuire PK, Aston J, et al. Structural brain abnormalities in individuals with an at-risk mental state who later develop psychosis[J]. Br J Psychiatry Suppl, 2007, 51: s69-s75. |
| [17] | Borgwardt SJ, McGuire P, Fusar-Poli P, et al. Anterior cingulate pathology in the prodromal stage of schizophrenia[J]. Neuroimage, 2008, 39(2): 553-554. DOI: 10.1016/j.neuroimage.2007.08.047. |
| [18] | Borgwardt SJ, Riecher-Rossler A, Dazzan P, et al. Regional gray matter volume abnormalities in the at risk mental state[J]. Biol Psychiatry, 2007, 61(10): 1 148-1 156. DOI: 10.1016/j.biopsych.2006.08.009. |
| [19] | Fusar-Poli P, Borgwardt S, Crescini A, et al. Neuroanatomy of vulnerability to psychosis:a voxel-based meta-analysis[J]. Neurosci Biobehav Rev, 2011, 35(5): 1 175-1 185. DOI: 10.1016/j.neubiorev.2010.12.005. |
| [20] | Haller S, Borgwardt SJ, Schindler C, et al. Can cortical thickness asymmetry analysis contribute to detection of at-risk mental state and first-episode psychosis? A pilot study[J]. Radiology, 2009, 250(1): 212-221. DOI: 10.1148/radiol.2501072153. |
| [21] | Smieskova R, Fusar-Poli P, Allen P, et al. Neuroimaging predictors of transition to psychosis--a systematic review and meta-analysis[J]. Neurosci Biobehav Rev, 2010, 34(8): 1 207-1 222. DOI: 10.1016/j.neubiorev.2010.01.016. |
| [22] | Rapoport JL, Giedd JN, Gogtay N. Neurodevelopmental model of schizophrenia:update 2012[J]. Mol Psychiatry, 2012, 17(12): 1 228-1 238. DOI: 10.1038/mp.2012.23. |
| [23] | Meisenzahl EM, Koutsouleris N, Bottlender R, et al. Structural brain alterations at different stages of schizophrenia:a voxel-based morphometric study[J]. Schizophr Res, 2008, 104(1-3): 44-60. DOI: 10.1016/j.schres.2008.06.023. |
| [24] | Andrews-Hanna JR, Reidler JS, Sepulcre J, et al. Functional-anatomic fractionation of the brain's default network[J]. Neuron, 2010, 65(4): 550-562. DOI: 10.1016/j.neuron.2010.02.005. |
| [25] | Buckner RL, Andrews-Hanna JR, Schacter DL. The brain's default network:anatomy, function, and relevance to disease[J]. Ann N Y Acad Sci, 2008, 1 124: 1-38. |
| [26] | Foster BL, Dastjerdi M, Parvizi J. Neural populations in human posteromedial cortex display opposing responses during memory and numerical processing[J]. Proc Natl Acad Sci USA, 2012, 109(38): 15 514-15 519. DOI: 10.1073/pnas.1206580109. |
| [27] | Garrity AG, Pearlson GD, McKiernan K, et al. Aberrant "default mode" functional connectivity in schizophrenia[J]. Am J Psychiatry, 2007, 164(3): 450-457. DOI: 10.1176/ajp.2007.164.3.450. |
| [28] | Orliac F, Naveau M, Joliot M, et al. Links among resting-state default-mode network, salience network, and symptomatology in schizophrenia[J]. Schizophr Res, 2013, 148(1-3): 74-80. DOI: 10.1016/j.schres.2013.05.007. |
| [29] | Palaniyappan L, Mallikarjun P, Joseph V, et al. Regional contraction of brain surface area involves three large-scale networks in schizophrenia[J]. Schizophr Res, 2011, 129(2-3): 163-168. DOI: 10.1016/j.schres.2011.03.020. |
| [30] | Pomarol-Clotet E, Canales-Rodriguez EJ, Salvador R, et al. Medial prefrontal cortex pathology in schizophrenia as revealed by convergent findings from multimodal imaging[J]. Mol Psychiatry, 2010, 15(8): 823-830. DOI: 10.1038/mp.2009.146. |
| [31] | Pomarol-Clotet E, Salvador R, Sarro S, et al. Failure to deactivate in the prefrontal cortex in schizophrenia:dysfunction of the default mode network?[J]. Psychol Med, 2008, 38(8): 1 185-1 193. |
| [32] | Fusar-Poli P, Smieskova R, Kempton MJ, et al. Progressive brain changes in schizophrenia related to antipsychotic treatment? A meta-analysis of longitudinal MRI studies[J]. Neurosci Biobehav Rev, 2013, 37(8): 1 680-1 691. DOI: 10.1016/j.neubiorev.2013.06.001. |
| [33] | Konopaske GT, Dorph-Petersen KA, Pierri JN, et al. Effect of chronic exposure to antipsychotic medication on cell numbers in the parietal cortex of macaque monkeys[J]. Neuropsychopharmacology, 2007, 32(6): 1 216-1 223. DOI: 10.1038/sj.npp.1301233. |
| [34] | Leung M, Cheung C, Yu K, et al. Gray matter in first-episode schizophrenia before and after antipsychotic drug treatment. Anatomical likelihood estimation meta-analyses with sample size weighting[J]. Schizophr Bull, 2011, 37(1): 199-211. DOI: 10.1093/schbul/sbp099. |
| [35] | Torres US, Portela-Oliveira E, Borgwardt S, et al. Structural brain changes associated with antipsychotic treatment in schizophrenia as revealed by voxel-based morphometric MRI:an activation likelihood estimation meta-analysis[J]. BMC Psychiatry, 2013, 13: 342. DOI: 10.1186/1471-244X-13-342. |
| [36] | Andreasen NC, Liu D, Ziebell S, et al. Relapse duration, treatment intensity, and brain tissue loss in schizophrenia:a prospective longitudinal MRI study[J]. Am J Psychiatry, 2013, 170(6): 609-615. DOI: 10.1176/appi.ajp.2013.12050674. |
| [37] | Veijola J, Guo JY, Moilanen JS, et al. Longitudinal changes in total brain volume in schizophrenia:relation to symptom severity, cognition and antipsychotic medication[J]. PLoS One, 2014, 9(7): e101689. DOI: 10.1371/journal.pone.0101689. |
 2016, Vol. 37
2016, Vol. 37

 ,
,