2. 湖北省黄冈市中心医院 湖北 黄冈 438000
2. Dept. of Oncology, Central Hospital of Huanggang City, Huanggang 438000, Hubei, China
宫颈癌是女性生殖系统最常见的恶性肿瘤之一, 根治性放疗是中晚期和部分不能手术的早期宫颈癌患者的标准治疗方式,主要包括体外放射治疗和近距离放射治疗[1]。盆腔外照射(external beam radiotherapy, EBRT)联合高剂量率的腔内放疗(high dose rate intracavitary brachytherapy, HDRICBT)可以使宫颈癌患者获得较好的疗效[2],但放疗引起的放射性直肠炎较为常见。放射性直肠炎临床表现主要包括腹痛、腹泻、便血、瘘管形成等。重度慢性放射性直肠炎(severe late rectal toxicity, SLRT)患者症状重,治疗费用高,病情多呈进展性,难以自愈,严重影响着患者的生活质量[3]。本研究对我院211例行根治性放疗的宫颈癌患者的临床资料进行回顾性分析,探讨引起SLRT发生的可能因素,以期为临床医生预防和减少SLRT的发生提供经验。
1 资料与方法 1.1 病人资料搜集2008年1月-2013年12月武汉大学中南医院收治的宫颈癌患者的病例资料。病例纳入标准:① 病理证实为宫颈癌;② 分期为ⅡA-ⅢB期[按国际妇产科联盟(International Federation of Gynecology and Obstetrics, FIGO)诊断标准];③ 入院前未经历手术和放疗;④ 行EBRT联合HDRICBT的根治性放疗;⑤ 具有完整的随访资料。最终有211例宫颈癌患者纳入本研究。
电话或门诊进行随访,中位随访时间53(36-87) 个月。211例宫颈癌患者≥50岁者139例,<50岁者72例。ⅡA期21例,ⅡB期90例,ⅢA期53例,ⅢB期47例。MRI评估肿瘤大小,放疗前肿瘤直径≥4 cm者119例,<4 cm者92例。所有患者入院后均接受全程EBRT联合HDRICBT的根治性放疗。A点相当于2 Gy分次的生物等效剂量(the equivalent dose in 2 Gy fractions of A point, EQD2A)平均值为(90.1±6.1) Gy10,其中SLRT组为(91.4±3.6) Gy10,NSLRT组为(90.0±6.2) Gy10,直肠点相当于2 Gy分次的生物等效剂量(the equivalent dose in 2 Gy fractions of rectal point, EQD2R)平均值为(69.5±10.4) Gy3,其中SLRT组为(93.2±11.1) Gy3,NSLRT组为(67.2±7.0) Gy3。早反应组织α/β=10, 晚反应组织α/β=3。患者同步化疗≥3次者126例,<3次者85例,放疗总疗程≥56 d者125例,<56 d者86例。211例宫颈癌患者中,114例采用四野盒式照射联合HDRICBT,97例行调强放疗(intensity modulated radiation therapy, IMRT)联合HDRICBT,放疗过程中或放疗结束后3个月内有56(26.5%)例患者出现≥2度急性放射性直肠炎(acute rectal toxicity, ART),155(73.5%)例未或仅出现Ⅰ度ART。
1.2 放疗方案所有患者均采用EBRT联合HDRICBT的根治性放疗。EBRT包括四野盒式照射和调强放疗。四野照射时处方剂量给予45-50 Gy/23-25 F,当照射40/20 Gy后盆腔中央挡铅,并加入后装治疗。IMRT放疗靶区包括宫颈肿块(gross tumor volume, GTV)、直径≥1 cm的盆腹腔肿大的淋巴结(gross tumor volume node, GTVnd)、临床靶区(clinical target volume,CTV)和计划靶体积(planning target volume, PTV)。GTV给予50.4-56 Gy,GTVnd给予60-66 Gy,CTV给予45-50.4 Gy,超过98% PTV接受≥95%处方剂量,处方剂量给予45-50.4 Gy/23-28F。危及器官剂量限定:直肠V50<50%,膀胱V50<50%,股骨头V50<5%,小肠V50<10%。V50为各危及器官接受的>50 Gy剂量照射的体积百分数。当IMRT照射约16次时,开始加入腔内后装。
腔内后装治疗每周1次,单次6 Gy,共4-6次,使A点总剂量达24-36 Gy。A点为阴道穹窿垂直向上2 cm与子宫轴线外2 cm的交点。本研究中宫颈肿块≥4 cm者,内外照射后A点总剂量达85 Gy或以上,而肿块<4 cm者,A点总剂量<85 Gy。所有患者均完成了放射治疗,腔内后装加体外照射总治疗时间一般为56 d,但由于患者个体差异、节假日、机器故障等原因,患者放疗时间会有差异。
1.3 放射性直肠炎的分级使用美国肿瘤放射治疗协作组(radiation therapy oncology group, RTOG)的评价标准对急性和慢性放射性直肠炎进行放射性损伤分级[4]。SLRT为≥3度的慢性放射性直肠炎患者。
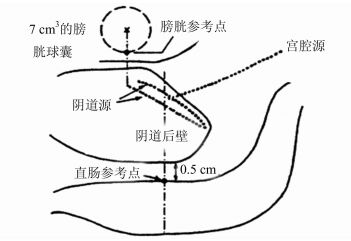
1.4 放疗参数计算由于后装分割剂量大,产生的生物效应与常规分割差异明显,因此,放疗参数均采用相当于2 Gy分次的生物等效剂量EQD2表示。EQD2=分割次数×每次分割剂量×(每次分割剂量+α/β)/(2+α/β),总EQD2 = EQD2EBRT+ EQD2HDRICBT[5],按此公式计算A点和直肠参考点剂量。ICRU 38报告中直肠参考点剂量为直肠前壁最大点剂量,侧卧位摄片时,大约在阴道容器轴线与阴道后壁焦点后0.5 cm[5]。直肠参考点位置如图 1所示。
|
图 1 宫颈癌放疗时直肠参考点的位置 |
使用Excel表格录入数据,SPSS 17.0软件进行统计学分析。计量资料以x±s表示,单因素分析采用t检验,计数资料单因素分析采用χ2检验,Logistic回归模型进行多因素分析,受试者工作特征(ROC)曲线确定诊断和预测SLRT的危险因素的临界值,以P<0.05为差异有统计学意义。
2 结果 2.1 SLRT组与NSLRT组之间3年生存率的分析随访后,18(8.5%)例患者发生SLRT, 193(91.5%)例为NSLRT。患者总的3年生存率为85.3%(180/211),SLRT组和NSLRT组3年生存率分别为88.9%(16/18)、85.0%(164/193),χ2分析示两组间3年生存率无统计学差异(χ2=0.01,P>0.05)。
2.2 放疗计划分析四野盒式放疗组中,10.5%患者(12/114) 出现SLRT, 3年生存率为81.6%(93/114);IMRT放疗组中,6.2%的患者(6/97) 出现SLRT, 3年生存率为89.7%(87/97)。统计学分析显示四野盒式照射组和IMRT组间EQD2A、EQD2R、SLRT的发生率及3年生存率无统计学差异(P>0.05),故本研究中放疗方式对参考点剂量和放疗结果的影响无统计学意义(P>0.05)。见表 1。
| 表 1 四野照射组与IMRT放疗组的比较结果 |
SLRT的相关性分析单因素分析示患者SLRT的发生与年龄、EQD2A、疾病分期、肿瘤大小、总疗程及同步化疗次数等均无明显相关性(P>0.05),而与EQD2R(t=14.307) 及ART(χ2=35.819) 的严重程度明显相关(P<0.05)。Logistic回归模型分析示EQD2R(OR=1.293, P<0.05) 及ART(OR=3.484, P<0.05) 的严重程度为SLRT发生的独立危险因素。单因素和Logistic回归模型分析结果分别见表 2和表 3。
| 表 2 单因素分析结果 |
| 表 3 Logistic回归模型分析结果 |
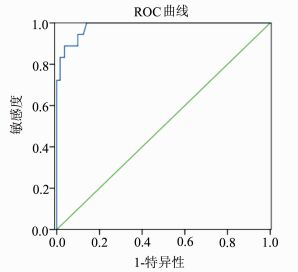
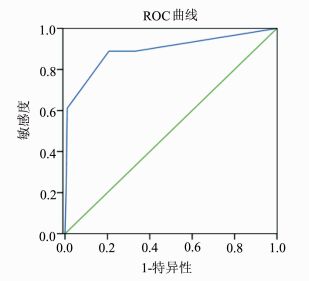
多因素回归分析显示EQD2R和ART的严重程度为SLRT发生的独立危险因素。将211例患者的EQD2R和ART分别输入统计软件中绘制ROC曲线图(图 2, 3)。ROC曲线分析结果示EQD2R曲线下面积(the area under the curve, AUC)为0.983,预测度较高,敏感度与特异性之和的最大值为1.860(敏感性=1.00,特异度=0.860,P<0.05),对应EQD2R值为74.3 Gy3。ART的AUC=0.892,预测度中等,敏感度加特异性之和的最大值为1.691(敏感度=0.889,特异性=0.802, P<0.05),对应ART值为2度。EQD2R和ART的ROC曲线分析分析结果见表 4。
|
图 2 EQD2R预测SLRT的ROC曲线分析 |
|
图 3 ART预测SLRT的ROC曲线 |
| 表 4 EQD2R和ART的ROC曲线分析结果 |
放射性直肠炎是宫颈癌患者最常见的放疗副反应,主要包括急性和慢性。急性放射性直肠炎是放射线直接作用于肠壁,导致肠壁出现急性损伤的结果,经药物保留灌肠和止泻后大多可以缓解。慢性放射性直肠炎放疗后肠壁出现不可逆损伤,患者病情迁延不愈,治疗周期长且效果差,治疗方法主要包括药物保留灌肠、抗炎止泻、营养、止血、激素、中药等,重度且保守治疗无好转者则转外科行手术治疗。目前,国内外已有大量文献报道了关于慢性放射性直肠炎≥2度的防治方法,而对≥3度的研究甚少,使得SLRT尚无标准治疗方案可循,且SLRT严重影响患者的生活质量,故预防其发生尤为重要。
本研究中SLRT组与NSLRT组间患者3年生存率均较高且无明显统计学差异(P>0.05),因此我们重点探讨了宫颈癌根治性放疗后引起的SLRT的可能因素,以期在保证肿瘤控制率的情况下减少SLRT的发生率,使病人最大获益。统计学分析示患者外照射方式对患者A点剂量、直肠点剂量、3年生存率及SLRT发生率的影响均无明显统计学意义(P>0.05)。排除外照射方式的影响后进一步分析引起患者SLRT发生的可能因素,结果表明SLRT的发生与患者年龄、肿瘤大小、同步化疗次数、总疗程、疾病分期及EQD2A均无明显相关(P>0.05),而与EQD2R和ART的严重程度有关(P<0.05),且EQD2R和ART是SLRT发生的独立危险因素(P<0.05)。
一般来讲,放射性直肠炎是盆腔内外照射联合作用的结果,其发生主要与直肠的总受照剂量有关。先进的放疗设备和技术可使A点剂量达85 Gy以上,但较高的A点剂量会使位置固定的直肠不可避免地受到较大剂量的照射,从而引起放射性直肠炎的发生。Chopra等研究指出当EQD2R>60 Gy3时,放射性直肠炎发生率会显著上升[6]。Tharavichtikul等发现当EQD2R>65 Gy3时,发生≥2度慢性放射性直肠炎的可能性较大[7]。本研究中单因素和多因素分析结果均表明EQD2R是SLRT发生的危险因素,ROC曲线分析示EQD2R对SLRT的预测度较高(AUC=0.983, P<0.05),当EQD2R等于74.3 Gy3时,灵敏度与特异度之和最大。因此我们建议将EQD2R控制在74.3 Gy3以内,以预防和减少SLRT的发生。
ART常常发生于放疗过程中或放疗结束后3个月内,其症状主要包括腹痛、腹泻、便血、肛门部坠胀疼痛等。一些研究表明ART是慢性放射性直肠炎较好的预测因素[8, 9]。Hovdenak等发现患者行盆腔放疗2周时直肠发生的病理变化最大,并建议在放疗第2周时采取干预措施来修复直肠黏膜的损伤,以预防慢性放射性直肠炎的发生[10]。本研究的211名宫颈癌患者中,有56名患者发生ART。其中SLRT患者中有16(16/18) 例患2-4度ART,NSLRT患者中有40(40/193) 例患2-4度ART。χ2分析示两组ART发生率具有显著差异(P<0.05)。Logistic多因素回归分析表明,ART患者患SLRT的风险是无ART患者的3.484倍,ROC曲线分析结果提示ART≥2度的患者SLRT的发生的可能性较大。
因此,Ⅱ-Ⅲ期宫颈癌患者,采用EBRT联合HDRICBT进行根治性放疗时,在保证治疗靶区接受足够剂量照射的情况下,也需控制直肠的照射剂量,尽量使EQD2R<74.3 Gy3。放疗过程中或放疗结束后3月出现≥2度ART者,发生SLRT的可能性较大,建议积极治疗ART≥2度者,以减少SLRT发生的风险。
| [1] | Vordermark D. Radiotherapy of Cervical Cancer[J]. Oncol Res Treat, 2016, 39(9): 516-520. DOI: 10.1159/000448902. |
| [2] | Bohr ML, Karlsson L, Bärmark B, et al. Combined external and intracavitary irradiation in treatment of advanced cervical carcinomas: predictive factors for treatment outcome and early and late radiation reactions[J]. International Journal of Gynecological Cancer, 2014, 24(7): 1268-1275. DOI: 10.1097/IGC.0000000000000208. |
| [3] | Kirchheiner K, Pötter R, Tanderup K, et al. Health-related quality of life in locally advanced cervical cancer patients after definitive chemoradiation therapy including image guided adaptive brachytherapy: An analysis from the EMBRACE study[J]. Int J Radiat Oncol Biol Phys, 2016, 94(5): 1088-1098. DOI: 10.1016/j.ijrobp.2015.12.363. |
| [4] | Kapoor R, Bansal A, Kumar N, et al. Dosimetric correlation of acute and late toxicities in high-risk prostate cancer patients treated with three-dimensional conformal radiotherapy followed by intensity modulated radiotherapy boost[J]. Indian J Urol, 2016, 32(3): 210-215. DOI: 10.4103/0970-1591.185098. |
| [5] | Hashim N, Jamalludin Z, Ung NM, et al. CT based 3-dimensional treatment planning of intracavitary brachytherapy for cancer of the cervix: comparison between dose-volume histograms and ICRU point doses to the rectum and bladder[J]. Asian Pac J Cancer Prev, 2014, 15(13): 5259-5264. DOI: 10.7314/APJCP.2014.15.13.5259. |
| [6] | Chopra S, Dora T, Engineer R, et al. Late rectal toxicity after image-based high-dose-rate interstitial brachytherapy for postoperative recurrent and/or residual cervical cancers: EQD2 predictors for Grade ≥Ⅱ toxicity[J]. Brachytherapy, 2015, 14(6): 881-888. DOI: 10.1016/j.brachy.2015.08.007. |
| [7] | Tharavichtikul E, Meungwong P, Chitapanarux T, et al. The association of rectal equivalent dose in 2 Gy fractions (EQD2) to late rectal toxicity in locally advanced cervical cancer patients who were evaluated by rectosigmoidoscopy in Faculty of Medicine, Chiang Mai University[J]. Radiation Oncology Journal, 2014, 32(2): 57-62. DOI: 10.3857/roj.2014.32.2.57. |
| [8] | Campostrini F, Musola R, Marchiaro G, et al. Role of early proctoscopy in predicting late symptomatic proctitis after external radiation therapy for prostate carcinoma[J]. Int J Radiat Oncol Biol Phys, 2013, 85(4): 1031-1037. DOI: 10.1016/j.ijrobp.2012.07.2373. |
| [9] | Arcangeli G, Fowler J, Gomellini S, et al. Acute and late toxicity in a randomized trial of conventional versus hypofractioned three-dimensional conformal radiotherapy for prostate cancer[J]. Int J Radiat Oncol Biol Phys, 2011, 79(4): 1013-1021. DOI: 10.1016/j.ijrobp.2009.12.045. |
| [10] | Hovdenak N, Fajardo LF, Hauer-Jensen M. Acute radiation proctitis: a sequential clinicopathologic study during pelvic radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2000, 48(4): 1111-1117. DOI: 10.1016/S0360-3016(00)00744-6. |
 2017, Vol. 38
2017, Vol. 38

