2. 发育源性疾病湖北省重点实验室 湖北 武汉 430071;
3. 湖北省妇幼保健院生殖医学中心 湖北 武汉 430070
2. Hubei Provincial Key Laboratory of Developmentally Originated Disease, Wuhan 430071, China;
3. Reproductive Medicine Center of Hubei Maternal and Child Health Hospital, Wuhan 430070, China
双酚A (Bisphenol A,BPA)是一种常见的环境内分泌干扰物,结构类似己烯雌酚且具有弱雌激素样活性。有研究显示,BPA可降低卵母细胞质量、影响细胞减数分裂、增加睾酮分泌,从而影响卵泡正常发育[1]。细胞核过氧化物酶体增殖激活受体γ(peroxisome proliferators-activated receptor γ,PPAR-γ)属于细胞核受体超家族,是配体激活转录因子。PPAR-γ通过参与血管生成、组织重建、细胞周期调控和凋亡等维持卵巢正常功能,同时通过调节类固醇激素的分泌,影响卵泡的发育、排卵及卵子质量[2, 3]。雌激素由颗粒细胞产生,参与卵泡发育,芳香化酶是其生成的限速酶。课题组前期研究发现,不同浓度的BPA对滋养细胞的增殖能力及侵袭能力有不同程度的影响,且存在U型效应[4, 5], 并探讨了其中的影响机制,本研究在前期研究基础上,试图通过建立人卵巢颗粒细胞体外培养模型,进一步研究不同浓度的BPA暴露干扰颗粒细胞雌二醇(E2)生成的可能途径,从卵泡发育角度探讨BPA对女性生殖功能的影响。
1 材料与方法 1.1 材料 1.1.1 研究对象的选取选取武汉大学中南医院生殖门诊行超促排卵体外受精-胚胎移植(IVF-ET)助孕的妇女。所有受试者均签署知情同意书。受试者纳入标准:①年龄25-40岁,近1年月经周期正常;②基础激素水平正常,月经第2-3天测卵泡刺激素(FSH)≤10 mIU/ml,黄体生成素(LH)≤10 mIU/ml,E2≤50 pg/ml;③不孕原因证实为输卵管因素或男方不孕因素;④控制性超排卵方案为标准长方案。研究方案经武汉大学中南医院医学伦理委员会批准。
1.1.2 主要试剂及仪器双酚A (纯度>99%, 国药集团化学试剂有限公司);PBS、PPAR-γ抑制剂GW9662(美国Sigma-Aldrich公司);DMEM/F12培养液、青-链双抗溶液(美国HyClone公司);胎牛血清(美国Gibco公司);Percoll液(美国Biosharp公司);红细胞裂解液(拜易尔公司);雄烯二酮溶液(aladdin公司);免疫组化试剂盒、DAB溶液(福州迈新生物技术开发公司);CCK-8液(美国Sigma公司);Trizol (德国Invitrogen公司);ELISA试剂盒(深圳欣博盛公司);定量PCR试剂盒(TOYOBO公司)。
1.2 方法 1.2.1 人卵巢颗粒细胞的培养将取卵后的卵泡液于冰上保存迅速转移至实验室进行颗粒细胞的提取,低温离心后取细胞沉淀,置于50%(体积分数) percoll细胞分离液中,离心后吸取细胞层于PBS中洗去percoll液,再取细胞沉淀三倍体积红细胞裂解液去除少许残留的红细胞,离心后取沉淀于PBS中洗去红细胞裂解液再离心得细胞沉淀,用于细胞培养。
用DMEM/F12[15%(体积分数)胎牛血清,1%双抗,终浓度为1 μmol/L雄烯二酮溶液]细胞培养液调整细胞浓度为105/ml;用台盼蓝鉴定细胞活力大于95%,取6孔细胞培养板,每孔2 ml培养体系,置于37 ℃、5%CO2培养箱培养72 h。弃旧培养液,换不含雄烯二酮且加有不同浓度BPA (0.1, 1, 10, 100 mg/L)和GW9962 1 μmol/L培养液,其中用含0.1%无水乙醇培养液作为空白对照组,继续培养48 h。
1.2.2 人卵巢颗粒细胞的鉴定将细胞悬液接种在预先置好盖玻片的6孔培养板中,置于37 ℃、5%(体积分数) CO2培养箱培养,每24 h观察细胞贴壁及生长情况,适时更换培养液。细胞培养到第4天时取出细胞爬片,按免疫组化试剂盒说明操作。其中一抗(FSHR抗体)浓度为1:50,PBS代替一抗为阴性对照。
1.2.3 人卵巢颗粒细胞生长曲线的测定分离得到的原代颗粒细胞以105均匀接种于96孔板,每孔200 μl,培养24, 48, 72, 96, 120, 144 h,每孔加入CCK-8液10 μl,继续孵育2 h后终止培养;置于Rayto酶联免疫检测仪上测定450 nm波长处吸光度值(OD)。
1.2.4 上清液雌二醇的测定ELISA法试剂盒检测上清液E2的浓度,操作参照试剂盒说明。酶联免疫分析在450 nm处读吸光值,用标准曲线计算出培养液中的E2浓度值。
1.2.5 人卵巢颗粒细胞细胞色素P450芳香化酶(P450arom) mRNA表达的检测取经过药物处理的细胞沉淀,Trizol提取细胞总RNA,按照TOYOBO试剂盒说明逆转录为cDNA、检测颗粒细胞P450arom mRNA表达。P450arom mRNA引物(序列号NM000103.3),上游引物:5’-CAGCCTGTCGTGGACTTGGT-3’,下游引物:5’-GGCGATGTACTTTCCTGCACA-3’,内参ACTIN引物(序列号NM001101), 上游引物:5’-GTCCACCGCAAATGCTTCTA-3’,下游引物:5’-TGCTGTCACCTTCACCGTTC-3’;PCR程序为:首轮循环1次:预变性:95 ℃、1 min;退火:95 ℃、15 s,58 ℃、20 s,延伸:72 ℃、20 s,共40循环;终末延伸:72 ℃、5 min。
1.3 统计学分析统计学分析采用GraphPad软件进行,数据以x±s表示,多组间均数比较采用单因素方差分析,两组间均数比较用t检验。P<0.05为有差异具有统计学意义。
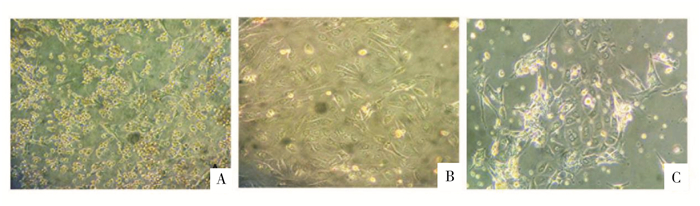
2 结果 2.1 人卵巢颗粒细胞体外培养细胞形态观察倒置显微镜下可见新鲜分离细胞形态为均一圆形单核细胞,培养24 h后可见细胞贴壁生长(图 1A),培养第3天可见细胞明显增殖,贴壁良好,细胞间可见延长的丝状突起互相连接(图 1B),培养第5天左右达增殖高峰,可见细胞呈梭形或多边形,细胞间有延长的伪足相互连接(图 1C)。
|
图 1 原代培养人卵巢颗粒细胞形态(×200) A.培养1 d;B.培养3 d;C.培养5 d |
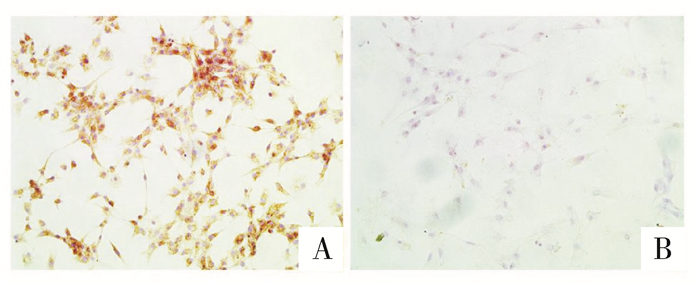
细胞爬片染色结果显示,阳性染色定位于细胞膜和细胞质,呈棕褐色着色,细胞核呈蓝色(图 2A),经鉴定可见95%以上为颗粒细胞;阴性对照组表达阴性(图 2B)。
|
图 2 体外培养人卵巢颗粒细胞(FSHR免疫组织化学染色×200) A.阳性细胞;B.阴性细胞 |
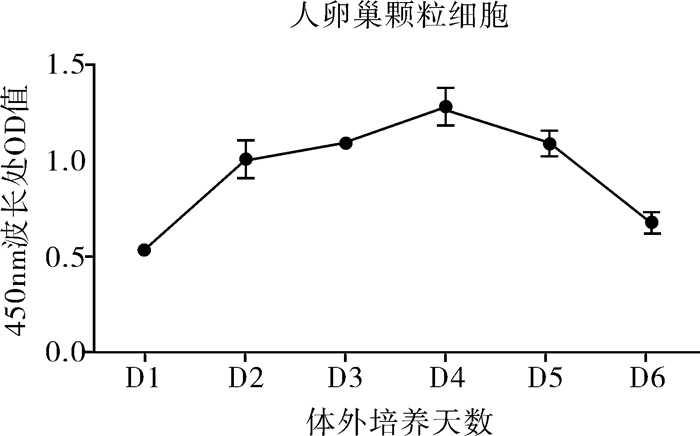
采用CCK-8增殖实验测定人卵巢颗粒细胞体外增殖能力,细胞体外培养24 h开始贴壁生长,培养到第3-5天细胞达到增殖高峰,第6天细胞开始逐渐退化(图 3)。
|
图 3 体外培养人卵巢颗粒细胞生长曲线 |
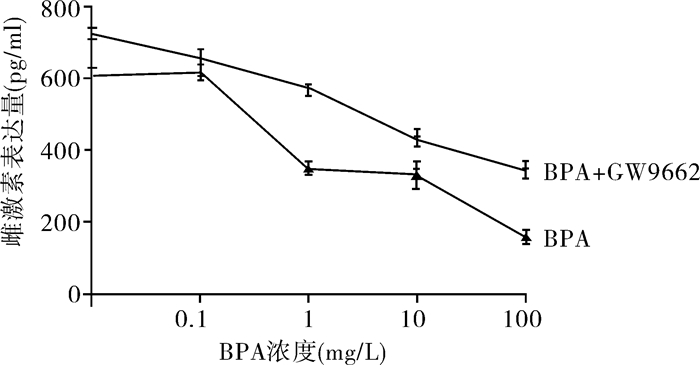
空白对照组与各药物处理组分别收集细胞上清培养液后,采用ELISA法测定上清液中E2的表达,结果显示:当BPA浓度为0.1 mg/L时,E2表达量较对照组升高(P < 0.05),当BPA浓度为1, 10, 100 mg/L时,E2表达量随BPA浓度升高而降低,组间比较有统计学差异(P < 0.05)。加入GW9662处理, 与相应仅添加BPA组比较,E2表达量升高,组间比较有统计学意义(P < 0.05)(图 4)。
|
图 4 不同药物处理后上清液E2的表达量 |
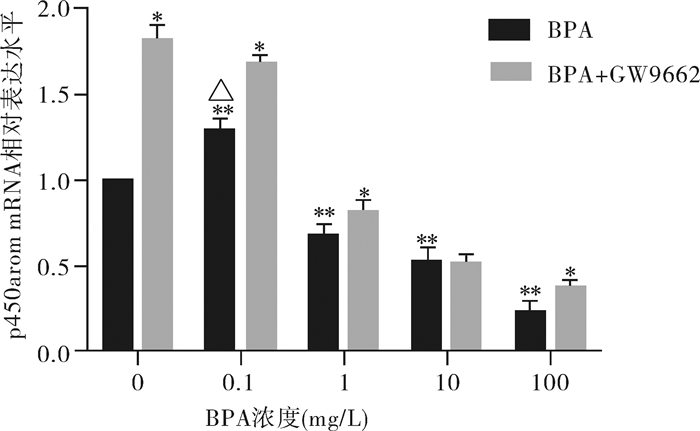
RT-PCR通过计算2-ΔΔCT法来检测各组经BPA或BPA+GW9662处理后的P450arom mRNA的表达量,结果显示:单独BPA处理组,当BPA浓度为0.1 mg/L时,P450arom表达量较对照组升高(*P < 0.05),当BPA浓度为1, 10, 100 mg/L时,P450arom表达量随BPA浓度升高而降低,差异有统计学意义(*P < 0.05)。加入GW9662处理后,当BPA浓度为10 mg/L时,我们发现与BPA单独处理组相比差异无统计学意义,但其余各组P450arom mRNA表达量均较单独BPA处理增高,差异有统计学意义(**P < 0.05)。P450arom表达趋势与E2趋势类似(图 5)。
|
图 5 不同浓度药物处理组中P450arom mRNA的表达改变 与对照组比较,△P < 0.05;不同BPA浓度组比较,**P < 0.05;与同浓度BPA组比较;*P < 0.05 |
双酚A (BPA)是全球使用量最高的化学物质之一,每年生产超过350万吨,在生产、生活中应用广泛,其安全性问题逐渐成为焦点。BPA主要通过皮肤接触、呼吸吸入及吞咽三种途径被人体吸收[6]。尽管BPA半衰期短,但多次、反复接触可造成部分BPA排出延迟,维持体内高水平状态[7],事实上,BPA已经在卵泡液、胎盘组织、尿液及血液等组织及体液中被检测到[1]。人群研究显示人体血清BPA浓度(最高30 nmol/L)与行IVF-ET助孕妇女的受精率成负相关,同时BPA可干扰卵泡正常发育,与流产率、不孕率及多囊卵巢发生率增加等密切相关[8]。卵巢是环境内分泌干扰物作用的特有靶器官, 颗粒细胞作为卵巢中主要的功能细胞,它的增殖与分化在卵泡发育、类固醇激素的合成及为卵子存活提供营养的过程中占有重要地位。我们的研究将人卵巢颗粒细胞直接暴露于不同浓度BPA,结果显示,BPA干扰人卵巢颗粒细胞内P450arom的表达以及E2的生成。当BPA浓度为0.1 mg/L时促进卵巢颗粒细胞E2的表达,当BPA浓度为1, 10, 100 mg/L时抑制颗粒细胞中E2的表达,P450arom mRNA表达趋势类似,说明BPA干扰E2的合成和分泌,且不存在明显的浓度依赖性。这个结果与Zhou[9]及Grasselli[10]等动物实验研究结果类似。我们前期研究结果同样显示BPA对BeWo细胞系增殖能力的干扰不具有浓度依赖性,说明BPA干扰机制复杂[4]。我们认为,这是颗粒细胞的一种激素反应,BPA具有一定的毒物兴奋效应,即高浓度表现出抑制作用,而低浓度表现出刺激作用,此效应经常在具有雌激素效应的环境内分泌干扰物中表现[11]。
PPAR-γ在卵巢组织中主要表达于发育期卵泡的颗粒细胞,通过与颗粒细胞上雌激素应答元件结合,竞争性结合受体,调节雌激素分泌,参与卵巢正常生理功能调节[12]。它还能刺激雌激素受体α泛化作用,导致雌激素受体α作用的降解,影响雌激素分泌[9]。但是BPA是否会通过此核受体途径影响芳香化酶及类固醇激素表达下调目前还缺乏足够证据。因此,我们建立体外细胞培养模型,通过在卵巢颗粒细胞BPA处理组加入PPAR-γ抑制剂GW9662,与单独BPA处理组相比,P450arom mRNA水平明显升高,E2合成量显著升高,说明BPA可能通过调节PPAR-γ的表达干扰芳香化酶及E2的正常合成,最终影响卵泡正常发育,同时也显示PPAR-γ对E2生成的负调控作用。研究显示尽管芳香化酶近端启动子缺乏蛋白激酶C-Nuclear κB (NF-κB)的结合域,但BPA可能通过抑制NF-κB激活PPAR-γ进而导致芳香化酶表达的下调[13],其他核受体如SF-1,CREB,GATA4等也可竞争性调节芳香化酶表达。BPA还可能诱导非基因途径的快速表达,如丝裂源活化蛋白激酶MAPK途径,并且通过活化一系列信号瀑布,进而调控PPAR-γ活性[14]。BPA也可能通过调节细胞外信号调节激酶1/2(Erk1/2)的磷酸化过程,激活Erk1/2后导致PPAR-γ的磷酸化,从而与NK-κB的亚基p65联合,调节芳香化酶表达[15]。
综上所述,BPA作为环境内分泌干扰物,通过一系列复杂的途径来干扰卵巢颗粒细胞的正常功能。我们的研究发现,BPA通过PPAR-γ途径影响P450arom表达从而抑制E2的正常合成,为BPA对人类固醇激素的合成及潜在生育功能的影响提供了一个新的研究思路。
| [1] | Huo X, Chen D, He Y, et al. Bisphenol-A and Female Infertility: A Possible Role of Gene-Environment Interactions[J]. Int J Environ Res Public Health, 2015, 12(9): 11101-11116. DOI: 10.3390/ijerph120911101. |
| [2] | Komar CM. Peroxisome proliferator-activated receptors (PPARs) and ovarian function-implications for regulating steroidogenesis, differentiation, and tissue remodeling[J]. Reprod Biol Endocrinol, 2005, 3(4): 1-14. |
| [3] | Froment P, Gizard F, Defever D, et al. Peroxisome proliferator-activated receptors in reproductive tissues: from gametogenesis to parturition[J]. J Endocrinol, 2006, 189(2): 199-209. DOI: 10.1677/joe.1.06667. |
| [4] | Wang ZY, Lu J, Zhang YZ, et al. Effect of Bisphenol A on invasion ability of human trophoblastic cell line BeWo[J]. Int J Clin Exp Pathol, 2014, 8(11): 14355-14364. |
| [5] |
刘腾, 瞿鑫兰, 王子一, 等. 多氯联苯暴露对着床期子宫内膜组织中组蛋白甲基化转移酶的影响[J].
武汉大学学报:医学版, 2015, 36 (6): 849-852.
Liu T, Qu XL, Wang ZY, et al. Effect of chronic exposure to polychlorinated biphenyls on the expression of histone methylation transferase during implantation period in CD-1 mice[J]. Medical Journal of Wuhan University, 2015, 36(6): 849-852. |
| [6] | Gregoraszczuk EL, Ptak A. Endocrine-Disrupting Chemicals: Some Actions of POPs on Female Reproduction[J]. Int J Endocrinol, 2013, 2013: 828532. |
| [7] | Ginsberg G, Rice DC. Does rapid metabolism ensure negligible risk from bisphenol A[J]. Environ Health Perspect, 2009, 117(11): 1639-1643. DOI: 10.1289/ehp.0901010. |
| [8] | Machtinger R, Orvieto R. Bisphenol A, oocyte maturation, implantation, and IVF outcome: Review of animal and human data[J]. Reprod Biomed Online, 2014, 29(4): 404-410. DOI: 10.1016/j.rbmo.2014.06.013. |
| [9] | Zhou W, Liu J, Liao L, et al. Effect of bisphenol A on steroid hormone production in rat ovarian theca-interstitial and granulosa cells[J]. Mol Cell Endocrinol, 2008, 283(1-2): 12-18. DOI: 10.1016/j.mce.2007.10.010. |
| [10] | Grasselli F, Baratta L, Baioni L, et al. Bisphenol A disrupts granulosa cell function[J]. Domest Anim Endocrinol, 2010, 39(1): 34-39. DOI: 10.1016/j.domaniend.2010.01.004. |
| [11] | Calabrese EJ. Hormesis: why it is important to toxicology and toxicologists[J]. Environ Toxicol Chem, 2008, 27(7): 1451-1474. DOI: 10.1897/07-541.1. |
| [12] | Rubin BS. Bisphenol A: An endocrine disruptor with widespread exposure and multiple effects[J]. J of Steroid Biochem Mol Biol, 2011, 127(1-2): 27-34. DOI: 10.1016/j.jsbmb.2011.05.002. |
| [13] | Fan W, Yanase T, Morinaga H, et al. Activation of peroxisome proliferator-activated receptor-γ and retinoid X receptor inhibits aromatase transcription via nuclear factor-κB[J]. Endocrinology, 2005, 146(1): 85-92. DOI: 10.1210/en.2004-1046. |
| [14] | Kwintkiewicz J, Nishi Y, Yanase T, et al. Peroxisome proliferator-activated receptor-γ mediates bisphenol A inhibition of FSH-stimulated IGF-1, aromatase, and estradiol in human granulosa cells[J]. Environ Health Perspect, 2014, 118(3): 400-406. |
| [15] | Chen F, Wang M, O'Connor JP, et al. Phosphorylation of PPARγ via active ERK1/2 leads to its physical association with p65 and inhibition of NF-κB[J]. J Cell Biochem, 2003, 90(4): 732-744. DOI: 10.1002/(ISSN)1097-4644. |
 2016, Vol. 37
2016, Vol. 37

