细胞融合,是指两个或两个以上细胞通过浆膜融合而形成的过程[1],也被称为细胞杂交。它被认为是发生概率很低并且高度规律的现象。而目前对肿瘤的研究很多,Hanahan等[2]认为,人类肿瘤的形成是一个多步骤的复杂过程,这些过程由基因的突变导致,从而使正常人类细胞转向高度恶性的肿瘤细胞。而肿瘤转移则是一个十分复杂的过程,其步骤一般为:原发肿瘤生长与血管生成;肿瘤侵入周围组织和基底膜;侵入血管、淋巴管或腹膜空隙并在其中生存;最后实现肿瘤的转移;目前数据显示,90%以上的癌症病人死于肿瘤的转移[3]。
1 细胞融合与肿瘤转移的早期研究最早关于细胞融合与肿瘤关系的报道要追溯到1911年,Aichel提出假设,他认为恶性肿瘤的产生很可能是因为体细胞与白细胞发生融合而导致。接着,Mekler将Aichel的理论进行了扩展,认为白细胞与原发性肿瘤细胞的融合可能导致肿瘤发生转移;Warner认为,肿瘤细胞之间的融合可能导致肿瘤发生转移,并且可能导致肿瘤表型的多样性[4]。目前关于细胞融合与肿瘤关系的报道已经有很多,有学者认为肿瘤发展的过程类似达尔文的进化论,由于基因型的改变,新的基因型更能适应环境,导致正常人体细胞逐渐转换为肿瘤细胞[2]。而巨噬细胞[5]、淋巴细胞[6]、内皮细胞[7]等与肿瘤细胞的融合在不同程度上参与了肿瘤的转移过程,因此直接或者间接地促进了肿瘤细胞转移至新的器官或组织。
肿瘤的转移过程复杂,并且有一些病人的原发肿瘤在数年或者数十年之后才发生转移。这使得肿瘤的转移机制研究较困难。关于肿瘤转移机制的研究,目前有很多模型假设,最为普遍接受的模型是Nowell[8]提出的肿瘤进展模型,Nowell认为一系列的基因变异导致了一小部分肿瘤细胞获得了转移潜能。而细胞融合模型[9],目前获得了普遍的关注。模型认为:肿瘤细胞要形成转移,必须获得很多相应的能力。例如:无限制增殖的能力[2];使细胞间连接如紧密连接[10]、黏附连接[11]等能力下降甚至丧失的能力;促血管生成的能力[12];侵入血管或者淋巴管并生存的能力[6];从血管或淋巴管中渗出的能力[9];以及远行转移的能力[2, 9]等等。那么,肿瘤细胞如何获取这么多的能力则值得深究。细胞融合模型能够解释这个问题。在过去的几十年间,细胞融合不断取得进展,从自发融合到诱发融合,从肿瘤细胞与正常体细胞融合到肿瘤细胞之间的融合,人们对细胞融合逐渐开始了解。Mortensen等[12]研究表明,内皮细胞位于血管与淋巴管内层,肿瘤细胞要到达循环系统必须穿过这层内皮细胞。因此,他们利用乳腺癌细胞以及内皮细胞进行联合培养,体内和体外的实验均证明,乳腺癌细胞与内皮细胞进行融合,使得肿瘤细胞能够穿过内皮细胞屏障入侵血液,然后进行转移。Powell等[13]实验研究表明,血液循环系统来源的细胞与肿瘤上皮细胞融合可发生于肿瘤形成阶段,通过将免疫细胞 (如巨噬细胞等) 与肿瘤细胞的融合,可导致迁移性巨噬细胞的形成,而这可导致肿瘤细胞逃避免疫系统的防御反应。Pawelek[15]则提出假设,肿瘤细胞与骨髓来源细胞融合才导致肿瘤的发展与转移。他提出证据认为,第一,两者融合细胞的基因型可以被检测到;第二,肿瘤细胞与骨髓来源细胞两者在很多方面的分子表达和信号通路一致,如血管生成过程中的VEGF和其他因子,免疫信号通路中的核因子κB,肾肿瘤抗原1,Toll样受体等,以及巨噬细胞免疫标记物、细胞-机制降解和沉积物、细胞动度等方面。第三,融合细胞与当前关于肿瘤转移的现象及观点相符合;第四,融合细胞与上皮-间质转化 (EMT) 理论相符合,且能够解释EMT理论。
2 细胞融合与其它相关学说 2.1 细胞融合与EMT的相互促进EMT是一个多步骤的复杂过程,包括细胞间、细胞与胞外基质间接触改变,上皮细胞从周围组织分离;细胞骨架重建;诱导新的转录过程以维持间质形态等等[16]。常见于胚胎发育过程,也与肿瘤细胞的侵袭和远处转移有着密切的联系[16, 17]。EMT主要变化有三个,即形态学改变,标记物改变以及功能改变[17]。
细胞融合理论与EMT理论在很多方面存在相互促进协调的作用,因此,有理由认为两者之间存在相互联系。①在胚胎发育过程中,通过EMT实现三胚层的形成,并且EMT与器官的发育关系密切;而Al-Nasiry等[18]研究发现,间质滋养层细胞在侵入胎盘床的时候会与多核巨细胞融合,从而实现胚胎的发育;②EMT的发生与多种蛋白分子,生长因子、转录因子等有关,同时涉及的信号通路和分子机制也较复杂[16],例如肝细胞生长因子 (HGF),表皮生长因子 (EGF),转化生长因子 (TGF-β),血管内皮生长因子 (VEGF) 等等生长因子均通过不同的信号通路参与EMT,同时这些生长因子也是细胞融合过程中的重要参与分子;E-钙黏蛋白均为两者的重要参与蛋白;③恶性肿瘤的特点是从原来不具有侵袭能力的组织中分离出具有转移能力的肿瘤细胞并进行播散。EMT通过实现细胞的转换,使得上皮细胞转化成间质细胞,获得了间质细胞的游走能力;而肿瘤细胞通过与间质细胞如巨噬细胞等的融合,使得肿瘤细胞具有了巨噬细胞的侵袭、游走以及吞噬等能力[19];这两者的改变具有异曲同工之处;④Kalluri等[20]认为,EMT可分为三种类型,Ⅰ型与胚胎发育和器官形成有关;Ⅱ型与伤口愈合、组织再生和器官纤维化有关;Ⅲ型则与肿瘤形成相关;肿瘤细胞可通过EMT,从而使细胞保持三种形态,即上皮细胞形态、间质细胞形态以及两者兼有的形态;而Lluis等[21]研究证明,当组织受到损伤时,自发性细胞融合活动将增多,从而促进伤口愈合与组织再生;肿瘤细胞与骨髓源性细胞[19]、多能间充质干细胞[22]等的融合,将使得细胞形态发生改变;由此可见,细胞融合理论与上皮-间质转化理论之间存在密切的联系。
2.2 细胞融合导致染色体非整倍性的产生非整倍体作为染色体数目变异的一种类型,是指细胞中的染色体数目不是以染色体为单位成倍地增减,而是个别的染色体增加或减少一条或几条而致其数目不是整倍数,所以叫非整倍体,是细胞分裂时染色体丢失、染色体分离及易位异常的产物[23],也是肿瘤细胞与正常细胞明显的区别之一。从1890年,von Hansemann观察到肿瘤细胞中有丝分裂异常,到2008年,Boveri提出,异常的有丝分裂导致染色体异常分离,可能导致非整倍性的产生,从而促进肿瘤的产生和发展。越来越多的学者开始探究两者之间的关系。
Storchova等[23]认为,人肿瘤细胞中的染色体数目可变性很大,从亚二倍体 (小于46条) 到高倍体 (高达200条),即染色体不稳定性;目前比较统一的观点认为,细胞异常分裂,导致四倍体的产生,然后导致非整倍性。不同学者对非整倍性的机制进行了不同的研究,但是学者普遍认为细胞融合是导致四倍体产生的重要原因之一。
细胞融合导致非整倍性的机制尚不明了,目前可能的机制有很多,主要有:①细胞融合导致细胞原癌基因与抑癌基因平衡发生改变[24];②细胞融合后有丝分裂的调节因子异常;主要包括端粒功能失调,纺锤体检查点缺陷,纺锤体组装缺陷,染色体重排、断裂和融合异常,胞质分裂失败等等[23]。③细胞融合导致DNA复制与修复功能发生改变[15]。
2.3 细胞融合与血管生成的相互促进Busund等[24]将巨噬细胞与肉瘤细胞进行自发融合,结果发现融合细胞微血管密度 (MVD)、血管成熟度 (VMI) 等均高于亲代肿瘤细胞,且VEGF、TGF-β的分泌也比亲代肿瘤细胞高,这表明,两者融合产生的细胞血管生成增强;Pawelek提出,恶性肿瘤细胞的某些特征与骨髓细胞类似,例如血管生成增加,细胞动度增加等,因此,他认为,骨髓细胞与肿瘤细胞的融合可导致肿瘤的恶变;同时认为,应该把所有的癌细胞当作是融合细胞[15]。这种观点为肿瘤的治疗提供了新的思路。图 1为细胞融合相关学说的研究示意图。
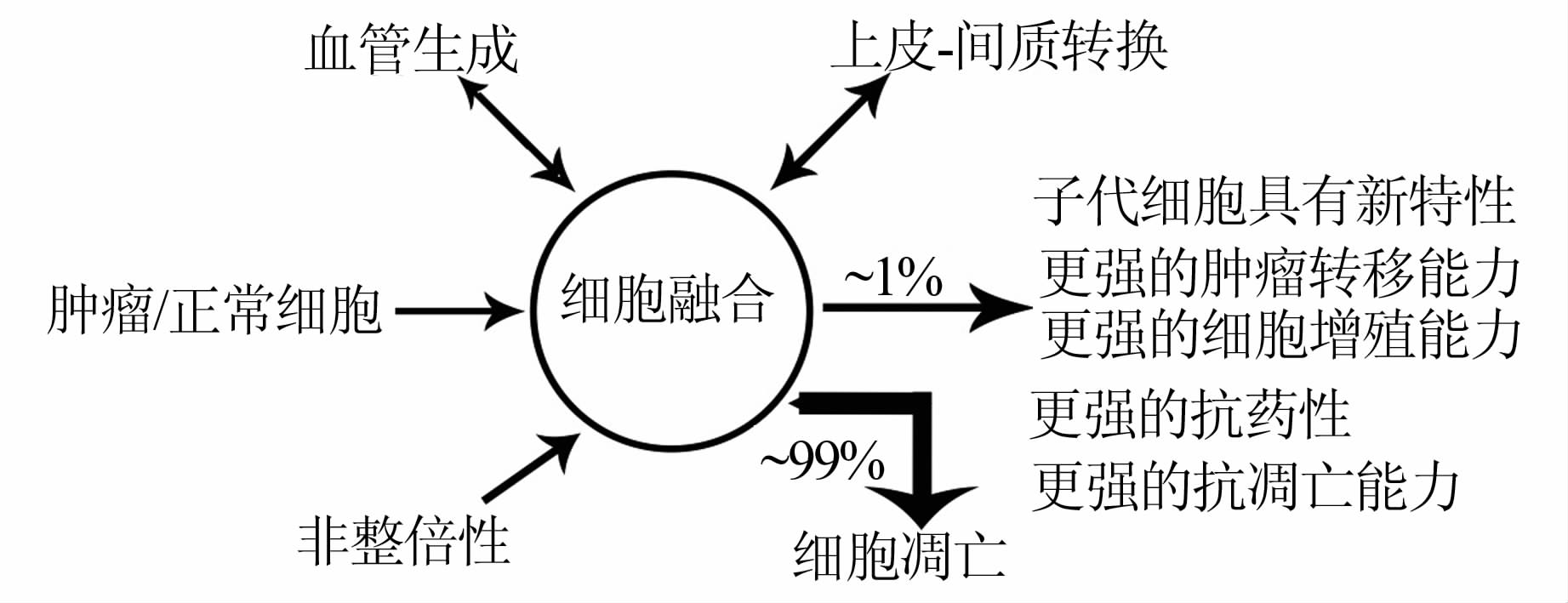
|
图 1 细胞融合与肿瘤关系的研究示意图 |
总之,虽然对细胞融合与肿瘤之间的关系研究取得了一定的进展,但是目前对他们的了解仍然有限。在细胞融合与肿瘤转移关系上还有很多问题亟待解决。例如,对于细胞融合促进肿瘤转移的机制仍不清楚。有部分学者认为,体细胞 (如巨噬细胞、白细胞等) 与肿瘤细胞融合,可以使血管增生,从而促进肿瘤发生转移。但是也有学者认为,肿瘤转移也与EMT、异质性等相关,因此有可能他们之间相互作用导致肿瘤发生转移[15]。另外,相关体外实验研究表明,当细胞发生自发融合时,融合率一般都比较低。如此低的融合率,却与肿瘤的转移密切相关,其中的相互作用及机制值得深入研究;同时,越来越多的文献表明,细胞融合与肿瘤干细胞密切相关,并且融合细胞与肿瘤干细胞具有一定的相似性。因此,为了更深入的了解,需要建立更多的动物实验模型,并且还需要更多临床数据的观察以及总结。这些实验及观察,将促进肿瘤的早期发现及治疗,对新兴的融合细胞肿瘤免疫疗法、肿瘤血管生成抑制疗法等,将产生重大而深远的影响。
| [1] | Clawson GA. Cancer fusion for moving[J]. Science, 2013, 342: 699-700. DOI: 10.1126/science.1244270. |
| [2] | Hanahan D, Weinberg RA. The hallmarks of cancer[J]. Cell, 2000, 100(1): 57-70. DOI: 10.1016/S0092-8674(00)81683-9. |
| [3] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI: 10.3322/caac.21338. |
| [4] | Rhee I, Davidson D, Souza CM, et al. Macrophage fusion is controlled by the cytoplasmic protein tyrosine phosphatase PTP-PEST/PTPN12[J]. Mol and Cell Biol, 2013, 33(12): 2458-2469. DOI: 10.1128/MCB.00197-13. |
| [5] | Song G, Ren J, Stojadinovic A, et al. Conjunction of tumor cells with lymphocytes: Implications for tumor invasion and metastasis[J]. Cancer Epidemiology, 2012, 36: 354-363. DOI: 10.1016/j.canep.2011.12.006. |
| [6] | Song K, Song Y, Zhao XP, et al. Oral cancer/endothelial cell fusion experiences nuclear fusion and acquisition of enhanced survival potential[J]. Experimental Cell Research, 2014, 328: 156-163. DOI: 10.1016/j.yexcr.2014.07.006. |
| [7] | Nowell PC. The clonal evolution of tumor cell populations[J]. Science, 1976, 194: 23-28. DOI: 10.1126/science.959840. |
| [8] | Hunter KW, Crawford NP, Alsarraj J. Mechanisms of metastasis[J]. Breast Cancer Research: BCR, 2008, 10(Suppl 1): S2. |
| [9] | Salvador E, Burek M, Forster CY. Tight junctions and the tumor microenvironment[J]. Current Pathobiology Reports, 2016, 4: 135-145. DOI: 10.1007/s40139-016-0106-6. |
| [10] | Jannie KM, Stipp CS, Weiner JA. Alcam regulates motility, invasiveness, and adherens junction formation in uveal melanoma cells[J]. PLoS One, 2012, 7: e39330. DOI: 10.1371/journal.pone.0039330. |
| [11] | Carnekuet P, Jain RK. Angiogenesis in cancer and other diseases[J]. Nature, 2000, 407(6801): 249-257. DOI: 10.1038/35025220. |
| [12] | Mortensen K, Lichtenberg J, Thomsen PD, et al. Spontaneous fusion between cancer cells and endothelial cells[J]. Cell Mol Life Sci, 2004, 61: 2125-2131. |
| [13] | Powell AE, Anderson EC, Davies PS, et al. Fusion between intestinal epithelial cells and macrophages in a cancer context results in nuclear reprogramming[J]. Cancer Research, 2011, 71: 1497-1505. DOI: 10.1158/0008-5472.CAN-10-3223. |
| [14] | Zhang S, Shpall E, Willerson JT, et al. Fusion of human hematopoietic progenitor cells and murine cardiomyocytes is mediated by alpha 4 beta 1 integrin/vascular cell adhesion molecule-1 interaction[J]. Circulation Research, 2007, 100: 693-702. DOI: 10.1161/01.RES.0000260803.98329.1c. |
| [15] | Pawelek JM. Tumour-cell fusion as a source of myeloid traits in cancer[J]. The Lancet Oncology, 2005, 6: 988-993. DOI: 10.1016/S1470-2045(05)70466-6. |
| [16] | Gonzalez DM, Medici D. Signaling mechanisms of the epithelial-mesenchymal transition[J]. Science Signaling, 2014, 7(344): re8. DOI: 10.1126/scisignal.2005189. |
| [17] | Yang J, Weinberg RA. Epithelial-mesenchymal transition: At the crossroads of development and tumor metastasis[J]. Developmental Cell, 2008, 14: 818-829. DOI: 10.1016/j.devcel.2008.05.009. |
| [18] | Al-Nasiry S, Vercruysse L, Hanssens M, et al. Interstitial trophoblastic cell fusion and e-cadherin immunostaining in the placental bed of normal and hypertensive pregnancies[J]. Placenta, 2009, 30: 719-725. DOI: 10.1016/j.placenta.2009.05.006. |
| [19] | Pawelek JM, Chakraborty AK. Fusion of tumour cells with bone marrow derived cells: a unifying explanation for metastasis[J]. Nat Rev Cancer, 2008, 8: 377-386. DOI: 10.1038/nrc2371. |
| [20] | Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition[J]. The Journal of Clinical Investigation, 2009, 119: 1420-1428. DOI: 10.1172/JCI39104. |
| [21] | Lluis F, Cosma MP. Cell-fusion-mediated somatic-cell reprogramming: A mechanism for tissue regeneration[J]. Journal of Cellular Physiology, 2010, 223: 6-13. |
| [22] | Rappa G, Mercapide J, Lorico A. Spontaneous formation of tumorigenic hybrids between breast cancer and multipotent stromal cells is a source of tumor heterogeneity[J]. The American Journal of Pathology, 2012, 180: 2504-2515. DOI: 10.1016/j.ajpath.2012.02.020. |
| [23] | Storchova Z, Kuffer C. The consequences of tetraploidy and aneuploidy[J]. Journal of Cell Science, 2008, 121: 3859-3866. DOI: 10.1242/jcs.039537. |
| [24] | Busund LT, Killie MK, Bartnes K, et al. Spontaneously formed tumorigenic hybrids of meth a sarcoma and macrophages grow faster and are better vascularized than the parental tumor[J]. International Journal of Cancer, 2002, 100: 407-413. DOI: 10.1002/(ISSN)1097-0215. |
 2017, Vol. 38
2017, Vol. 38

