2. 湖北省咸宁市中心医院眼科 湖北 咸宁 437100;
3. 武汉大学人民医院眼科中心 湖北 武汉 430060
2. Dept. of Ophthalmology, Xianning Central Hospital, Xianning 437100, Hubei, China;
3. Dept. of Ophthalmology, Renmin Hospital of Wuhan University, Wuhan 430060, China
视网膜色素上皮细胞(retinal pigment epithelium, RPE)是视网膜神经细胞和脉络膜之间的单层上皮细胞层,不仅对光感受器的有支持作用[1],而且由于细胞的极性以及非突触式的紧密连接构成视网膜生物屏障[1, 2]。它对视网膜的内在平衡至关重要,如血-视网膜屏障,光吸收,营养物质的运输及免疫赦免[3]。因此,RPE细胞的损伤及破坏会引起光感受器的退化及视力的丧失,最终导致多种疾病的发生例如增殖性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)、年龄相关性黄斑变性等[4]。一般来说,PVR是视网膜脱离少见并发症之一,发病率约为8%-10%。其发生是由于RPE细胞、巨噬细胞、纤维母细胞的大量增殖[5]。其中,RPE细胞被认为是关键所在,不受控制的RPE细胞增殖使其迁移至玻璃体腔和玻璃体视网膜交界处,逐渐形成视网膜前膜,牵拉视网膜,引起视网膜脱离及视力损害[6, 7]。而且,即使PVR发展之前,RPE与迁移及增殖相关的表型也难以回到正常状态[8]。因此,如何早期制止PVR的发生仍是一个难题。
MicroRNAs (miRNA或miR)于1993年被Lee RC等首次在新杆状线虫中发现。它是一类长约18-25核苷酸的小分子非编码RNA,通过抑制蛋白翻译和降解mRNA影响生物进程,调控30%以上的基因并参与一些关键的生理过程如细胞生长、凋亡及分化[9, 10]。不像其他一些小分子干扰mRNA,例如siRNA对单一基因起作用,miRNA使多个基因沉默,与mRNA的3’-UTR端结合,最终导致mRNA的降解和蛋白翻译的停止[11, 12]。其中,近年来miR-145多被研究于肿瘤细胞,如乳腺癌、结肠癌、肺癌等等。研究表明它对多种肿瘤均有抑制作用。但其在眼科学这一领域的作用还未阐明。本文通过研究miR145对RPE细胞增殖和凋亡的影响,进一步探索其对RPE细胞增殖造成的多种疾病的意义。
1 材料与方法 1.1 材料DMEM/F12培养基(美国Gibco),hRPE细胞(美国American Type Culture Collection) Transwell试剂盒(3422 corning),台盼蓝(上海捷倍思基因技术有限公司), 250 bp DNA ladder Marker (捷瑞公司),限制性内切酶(NEB公司),In-FusionTM PCR Cloning Kit (clontech),Taq polymerase (SinoBio),Plasmid抽提Kit (Promega),Opti-MEM (Invitrogen),MTT (北京鼎国生物技术有限责任公司),DMSO (上海国药集团),Annexin V/PI细胞凋亡试剂盒(中国联科生物),荧光显微镜(奥林帕斯公司micropublisher 3.3RTV),酶标仪(Biotek Elx800)1 kb DNA ladder Marker (Fermentas公司),PCR仪(Applied Biosystems公司),positive clone测序(美季生物技术),细菌摇床(华利达实验设备公司),细菌培养箱(上海一恒科学仪器有限公司),Gilson移液器(吉尔森公司),高速离心机(日立公司),流式细胞仪(FACX Calibur,美国Becton-Dickinson公司)。
1.2 RPE细胞培养和传代将复苏的hRPE细胞制成细胞悬液,接种于DMEM/F12培养基,置于37 ℃、5%CO2培养箱培养,次日更换一次培养液后继续培养,每3-4 d更换1次培养液, 直至细胞融合,胰蛋白酶消化传代。
1.3 miR-145慢病毒载体的转染及表达获取miR-145序列后,通过载体酶切、目的基因的扩增、构建重组质粒,最后基因测序比对鉴定重组质粒。将慢病毒转染293T细胞,48 h后收集上清液,通过离心的方式提取病毒浓缩液,并测定其滴度。处于对数生长期的hRPE细胞制成细胞悬液接种于6-well中,培养待细胞融合度达到约30%;根据细胞MOI值,实验组加入3.0 μl病毒(滴度8E+8TU/ml),阴性对照组加入1.0 μl阴性对照病毒(滴度3E+8TU/ml),12 h后观察细胞状态:如果没有明显的细胞毒性作用,继续培养24 h后更换培养基;如果有明显的细胞毒性作用,立即更换培养基;感染5 d后观察慢病毒上报告基因GFP的表达情况,荧光率大于80%,拍照。
实验分组:空白对照组:RPE细胞、未感染任何病毒的细胞组;阴性对照组:RPE细胞、加阴性对照病毒感染的细胞组;miR-145组:RPE细胞、加miR-145病毒感染的细胞组。用TRIzol RNA抽提试剂(美国Gibco公司)抽提各组细胞总RNA,RT-PCR检测转染后细胞内成熟miR-145的表达,并与对照组比较,评价转染的可靠性。相对定量采用比较Ct法:U6作为内参照,ΔCt=CtmiR-145-CtU6,ΔΔCt=ΔCt实验组-ΔCt对照组,根据公式可以计算出实验组中miR-145基因表达倍数(Fold)=2-ΔΔCt。
1.4 MTT检测慢病毒转染RPE细胞后细胞增殖状态慢病毒转染后5 d,将各实验组细胞重悬成细胞悬液并计数,铺板,共5张96孔板,连续检测5 d。培养终止前4 h加入20 μl 5 mg/ml的MTT,后再加150 μl DMSO酶标仪490 nm检测OD值。
1.5 慢病毒转染RPE细胞后细胞周期和凋亡检测离心获取转染后48 h的各组细胞,PBS重悬,70%冷乙醇4 ℃固定,静置30 min,离心后PBS悬浮细胞,加入RNase A至终质量浓度为50 mg/ml,37 ℃孵育1 h,加入50 μl碘化丙啶溶液,避光,4 ℃染色30 min后用流式细胞仪检测细胞周期。采用Annexin Ⅴ/PI细胞凋亡试剂盒,离心转染后48 h的各组细胞,PBS重悬后,每组取500 μl细胞悬液,加入5 μl Annexin Ⅴ-FITC和10 μl PI,避光,室温下孵育15 min,将悬液滴加到干净的载玻片上,荧光显微镜下观察,照相并用流式细胞术检测细胞凋亡。
1.6 统计学方法采用SPSS 11.5统计学软件进行统计学处理。每种实验重复3次,相关数据取平均值,均以x±s表示,各组的数据资料用配对样本t检验,P<0.05为差异有统计学意义。
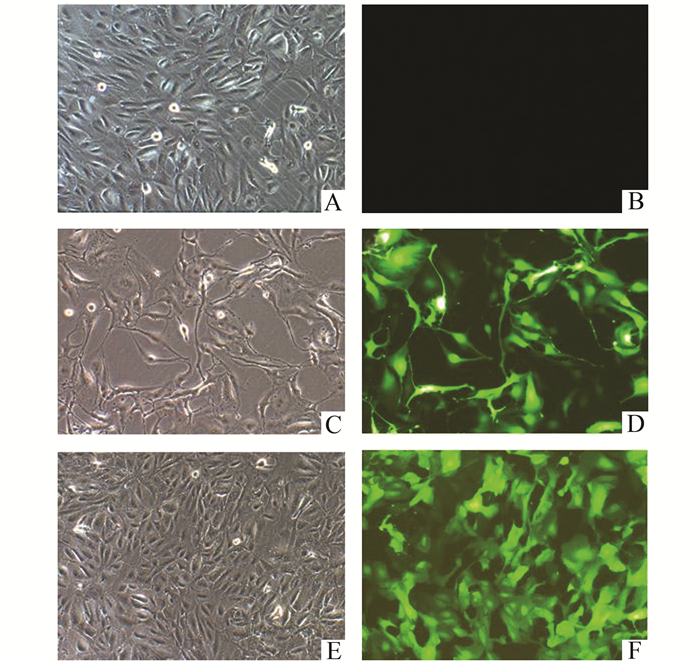
2 结果 2.1 miR-145慢病毒载体转染RPE细胞后表达情况将成功构建的miR-145慢病毒载体转染入hRPE后,miR-145组细胞感染后细胞与阴性对照组细胞及空白对照组细胞比较明显有形变,拉丝变长(图 1)。RT-PCR检测各组miR-145含量后,miR-145组的miR-145表达明显增加,与空白对照组(0.53±0.04)比较,差异具有统计学意义(t=20.47,P<0.05),与阴性对照组(1.01±0.13)比较,miR-145组(1 003.08±84.80)差异具有统计学意义(t=20.44,P<0.05)。
|
图 1 各组hRPE细胞镜下观和荧光表达(×100) A:空白对照组镜下观;B:空白对照组荧光表达;C:阴性对照组镜下观;D:阴性对照组荧光表达;E:miR-145慢病毒转染组镜下观;F:miR-145慢病毒转染组荧光表达 |
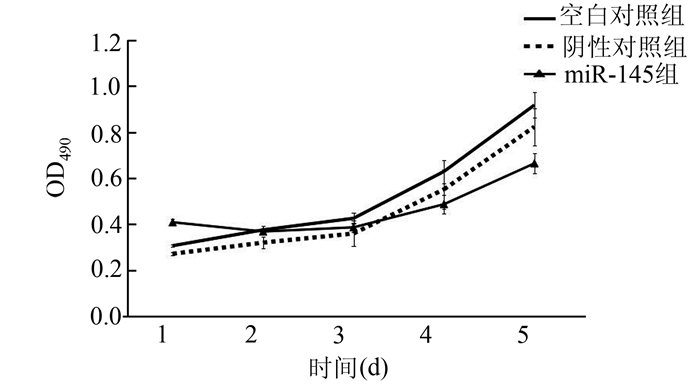
与空白对照组、阴性对照组比较,miR-145对RPE细胞增殖有明显抑制作用。相较其余两组miR-145组RPE细胞增殖缓慢(图 2)。
|
图 2 各组细胞增殖曲线 |
miR-145组细胞的细胞周期各时相群体百分数比例发生了变化,G0/G1期细胞减少,S期细胞增加,G2/M期细胞增加,miR-145抑制RPE细胞周期于G1期(P<0.01)(表 1)。
| 表 1 miR-145对RPE细胞周期影响 |
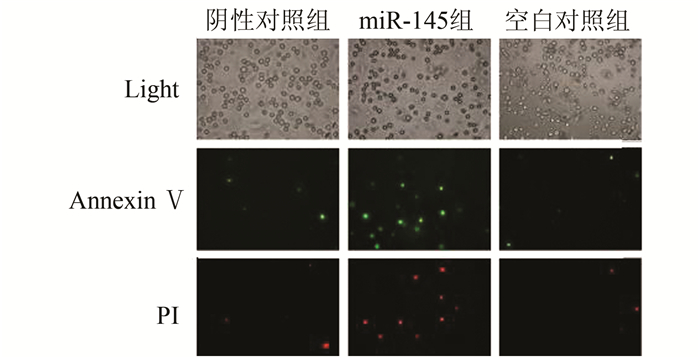
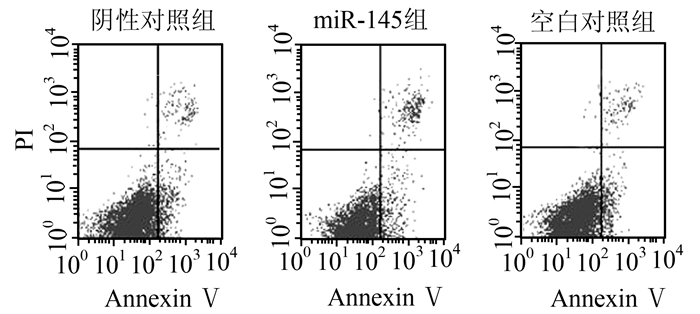
正常活细胞Annexin Ⅴ-FITC/PI均为低染,细胞膜和细胞核均不着色;miR-145组:Annexin Ⅴ和PI均高染,细胞膜呈绿色荧光,细胞核呈红色荧光,提示已出现细胞凋亡特征;阴性对照组及空白对照组:Annexin Ⅴ与PI均低染,提示细胞具有活性。与流式细胞检测的凋亡分析的趋势相一致(图 3, 4)。
|
图 3 Annexin Ⅴ/PI双标染色后于倒置荧光显微镜下观察细胞凋亡情况(×100) |
|
图 4 流式细胞术检测各组RPE细胞的凋亡 |
如今,关于miR-145的研究大多是关于各类肿瘤细胞,经证实,miR-145对乳腺癌、肺癌、前列腺癌、脑膜瘤等肿瘤细胞均有抑制增殖的作用[13]。近年来, 微小RNA与RPE细胞的关联在眼科的研究中逐渐兴起。比如Yoon等认为miR-155与RPE细胞的血管生成相关[14]。多个研究表明miR-125b, miR-24, miR-320, miR-23b,miR-204,miR-211,miR-204, miR-302s均被证实与RPE细胞的生长分化有关[4, 15, 16]。另外,miR-34a在视网膜及RPE表达随着年龄的增长而增长。并与线粒体DNA的损伤程度相一致。提示miR-34a与视网膜及RPE细胞的凋亡相关[17]。不仅是miR-34a, miR-133a-3p, miR-17-5p, miR-21-5p, miR-221-3p也同样涉及RPE凋亡[18]。值得一提的是miR-29b对TGF-β1介导的上皮-间质转变有抑制作用,而上皮-间质转变是PVR的形成的主要原因[19]。
即便如此,仍较少有关于miR-145在眼科领域的研究报道。本文中我们在研究miR-145对RPE细胞增殖和凋亡的影响的过程中,发现若miR-145在RPE细胞内持续表达,则参与基因调控,阻断蛋白翻译,能阻止细胞增殖,加速其凋亡。因此,通过慢病毒转染的方式使miR-145在RPE细胞中表达后,miR-145改变各个细胞周期细胞数的分布,减少处于G1期的细胞数,增加RPE细胞的凋亡,使细胞较正常时数量变少,细胞增殖减缓。
采用慢病毒作为载体,携带miR-145的基因信息,成功转染入RPE细胞后,RPE细胞过表达miR-145,含量明显高于正常细胞,导致细胞的凋亡率也远远高于正常细胞。可能在细胞正常生理过程中,miR-145处于持续低表达状态,未能发挥其作用。但在PVR进展的过程中,多种细胞包括RPE细胞大量增殖形成增殖膜牵拉视网膜,增殖膜导致视力的急剧丧失及预后差。增殖膜主要是由纤维组织构成,电子显微镜下可见胶原纤维,而RPE细胞被证实能在体内产生多种亚型的胶原纤维,因此,RPE产生大量增殖膜中的胶原纤维[20]。增殖膜产生的整个过程中显然miR-145仍处于低表达状态。若这种情况下miR-145表达增加,减少细胞增殖,则能阻断疾病的进一步恶化。因此,研究何种机制或物质在恰当时机能激发miR-145的表达,阻止病变细胞的增殖,加快其凋亡,对PVR等疾病亦是一种具有前景的治疗方式。
| [1] | Alexander P, Thomson HA, Luff AJ, et al. Retinal pigment epithelium transplantation: concepts, challenges, and future prospects[J]. Eye (Lond), 2015, 29(8): 992-1002. DOI: 10.1038/eye.2015.89. |
| [2] | Pfeffer BA, Philp NJ. Cell culture of retinal pigment epithelium: Special Issue[J]. Experimental Eye Research, 2014, 126: 1-4. DOI: 10.1016/j.exer.2014.07.010. |
| [3] | Murad N, Kokkinaki M, Gunawardena N, et al. miR-184 regulates ezrin, LAMP-1 expression, affects phagocytosis in human retinal pigment epithelium and is downregulated in age-related macular degeneration[J]. FEBS J, 2014, 281(23): 5251-2564. DOI: 10.1111/febs.2014.281.issue-23. |
| [4] | Adijanto J, Castorino JJ, Wang ZX, et al. Microphthalmia-associated Transcription Factor (MITF) Promotes Differentiation of Human Retinal Pigment Epithelium (RPE) by Regulating microRNAs-204/211 Expression[J]. J Biol Chem, 2012, 287(24): 20491-20503. DOI: 10.1074/jbc.M112.354761. |
| [5] | Morescalchi F, Duse S, Gambicorti E, et al. Proliferative vitreoretinopathy after eye injuries: an overexpression of growth factors and cytokines leading to a retinal keloid[J]. Mediators of Inflammation, 2013, 2013: 269787. |
| [6] | Hou Q, Tang J, Wang Z, et al. Inhibitory effect of microRNA-34a on retinal pigment epithelial cell proliferation and migration[J]. Invest Ophthalmol Vis Sci, 2013, 54(10): 6481-6488. DOI: 10.1167/iovs.13-11873. |
| [7] | Wang Y, Yuan Z, You C, et al. Overexpression p21WAF1/CIP1 in suppressing retinal pigment epithelial cells and progression of proliferative vitreoretinopathy via inhibition CDK2 and cyclin E[J]. BMC Ophthalmol, 2014, 14: 144. DOI: 10.1186/1471-2415-14-144. |
| [8] | Liou GI, Pakalnis VA, Matragoon S, et al. HGF regulation of RPE proliferation in an IL-1beta/retinal hole-induced rabbit model of PVR[J]. Mol Vis, 2002, 8: 494-501. |
| [9] | Bertoli G, Cava C, Castiglioni I. MicroRNAs: New Biomarkers for Diagnosis, Prognosis, Therapy Prediction and Therapeutic Tools for Breast Cancer[J]. Theranostics, 2015, 5(10): 1122-1143. DOI: 10.7150/thno.11543. |
| [10] | Xing AY, Wang B, Shi DB, et al. Deregulated expression of miR-145 in manifold human cancer cells[J]. Experimental and Molecular Pathology, 2013, 95: 91-97. DOI: 10.1016/j.yexmp.2013.05.003. |
| [11] | Sachdeva M, Zhu S, Wu F, et al. p53 represses c-Myc through induction of the tumor suppressor miR-145[J]. PNAS, 2009, 106(9): 3207-3212. DOI: 10.1073/pnas.0808042106. |
| [12] | Cai J, Yin G, Lin B, et al. Roles of NFκB-miR-29s-MMP-2 circuitry in experimental choroidal neovascularization[J]. J Neuroinflammation, 2014, 11: 88. DOI: 10.1186/1742-2094-11-88. |
| [13] | La Rocca G, Bin Shi, Audia A, et al. Regulation of microRNA-145 by growth arrest and differentiation[J]. Experimental Cell Research, 2011, 317: 488-495. DOI: 10.1016/j.yexcr.2010.11.010. |
| [14] | Yoon C, Kim J, Park G, et al. Delivery of miR-155 to retinal pigment epithelial cells mediated by Burkitt's lymphoma exosomes[J]. Tumor Biol, 2015[Epub ahead of print]. |
| [15] | Li WB, Zhang YS, Lu ZY, et al. Development of retinal pigment epithelium from human parthenogenetic embryonic stem cells and microRNA signature[J]. Invest Ophthalmol Vis Sci, 2012, 53(9): 5334-5343. DOI: 10.1167/iovs.12-8303. |
| [16] | Kutty RK, Samuel W, Jaworski C, et al. MicroRNA expression in human retinal pigment epithelial (ARPE-19) cells: Increased expression of microRNA-9 by N-(4-Hydroxyphenyl) retinamid[J]. Mol Vis, 2010, 16: 1475-1486. |
| [17] | Smit-McBride Z, Forward KI, Nguyen AT, et al. Age-dependent increase in miRNA-34a expression in the posterior pole of the mouse eye[J]. Mol Vis, 2014, 20: 1569-1578. |
| [18] | Wang HC, Greene WA, Kaini RR, et al. Profiling the microRNA Expression in Human iPS and iPS-derived Retinal Pigment Epithelium[J]. Cancer Inform, 2014, 13(Suppl 5): 25-35. |
| [19] | Li M, Li H, Liu X, et al. MicroRNA-29b regulates TGF-β1-mediated epithelial-mesenchymal transition of retinal pigment epithelial cells by targeting AKT2[J]. Exp Cell Res, 2014, [Epub ahead of print]. |
| [20] | Hiscott P, Sheridan C, Magee RM, et al. Matrix and the retinal pigment epithelium in proliferative retinal disease[J]. Progress in Retinal and Eye Research, 1999, 18(2): 167-190. DOI: 10.1016/S1350-9462(98)00024-X. |
 2016, Vol. 37
2016, Vol. 37
