非ST段抬高型心肌梗死(non-ST-segment elevation myocardial infarction, NSTEMI)又称心内膜下心肌梗死,指具有缺血性胸痛症状,血清心肌坏死标记物升高,但心电图ST段不抬高而表现为正常或压低的一类急性心肌梗死[1]。心电图难以区分NSTEMI患者与无症状心肌缺血患者,常规超声心动图肉眼识别NSTEMI节段性心肌运动异常不显著,基于二维斑点追踪成像(2-dimensional speckle-tracking echocardiography,2D-STE)技术的分层应变参数分析为识别NSTEMI这种心内膜下心肌功能异常的疾病提供了可能[2, 3]。本研究旨在应用二维斑点追踪技术检测NSTEMI患者左室各层心肌收缩期应变特点,拟探讨分层应变参数识别NSTEMI的临床应用价值。
1 资料与方法 1.1 研究对象2014年10月至2015年5月我院就诊的急性心肌梗死(AMI)患者60例,所有患者均根据心电及超敏肌钙蛋白I (cTnI)确诊首次发作AMI,所有患者均接受选择性冠脉造影(selective coronary arteriography, SCA)。依据心电图(ECG)中ST段有无抬高将急性心肌梗死患者分为NSTEMI组和STEMI组,①非ST段抬高型心梗(NSTEMI):新发或一过性ST段压低≥0.1 mV,或T波倒置≥0.2 mV,②ST段抬高型心梗(STEMI):ST段明显抬高,弓背向上[1]。其中,NSTEMI组30例,男14例,女16例,年龄(56.0±13.3)岁;STEMI组30例,男17例,女13例,年龄(55.5±10.8)岁。选择同时期来我院拟诊冠心病且冠脉造影阴性患者30例作为对照组,其中男14例,女16例,年龄(56.4±8.3)岁。本研究各组排除标准:①心脏外科手术史患者;②严重心肌病或瓣膜病患者;③严重心律失常患者。
1.2 仪器与方法 1.2.1 仪器GE VIVID E9及GE VIVID Q彩色多普勒超声成像仪,M5S探头,探头频率1.7-3.3 MHz。配有Echo Pac科研工作站及分析软件。
1.2.2 图像采集受检者左侧卧位,连接心电图,嘱患者平静呼吸,调节仪器帧频60-80帧/s,常规超声分别采集左室心尖纵向、心尖四腔、心尖两腔及二尖瓣水平、乳头肌水平、心尖水平短轴切面清晰二维图像,存盘供脱机分析,每个切面的图像记录5个连续心动周期。
1.2.3 图像分析及测量参数①常规二维超声参数的测量:分别在收缩末期、舒张末期描记左室心尖两腔和四腔切面心内膜边界,运用双平面Simpson’s法获取左室收缩末容积(left ventricular end systolic volume,LVESV),左室舒张末容积(left ventricular end diastolic volume LVEDV)及左室射血分数(left ventricular ejection fraction,LVEF)。由有经验的医师评价室壁运动,获取室壁运动积分指数(wall motion score index,WMSI)[4]。②2D-STE应变参数的测量:应用2D-STE在心尖纵向、心尖四腔、心尖两腔及二尖瓣水平、乳头肌水平、心尖水平切面二维图像勾画心内膜轮廓,生成感兴趣区,调节感兴趣区宽度使其与心肌厚度一致,对显示不佳的节段可进行手动微调,直至追踪成功,即可得出左室三层心肌整体纵向收缩期峰值应变(global longitudinal strain,GLS)、整体环向收缩期峰值应变(global circumferential strain,GCS)及节段纵向收缩峰值应变(territorial longitudinal strain, TLS)、节段环向收缩峰值应变(territorial circumferential strain, TCS),依据SCA结果,选择冠脉狭窄中度及以上的节段为受累节段[5],统计受累节段三层心肌TLS、TCS,计算其相应外膜应变与内膜应变的差值,得到相应跨壁应变梯度△GLS、△GCS、△TLS、△TCS。
1.3 统计学分析使用SPSS 20.0统计软件进行数据分析。所有呈正态分布的计量资料以均数±标准差表示,两组计量资料间比较采用独立样本均数t检验;3组计数资料间比较采用卡方检验,3组计量资料间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 3组间临床资料比较NSTEMI组、STEMI组及对照组间年龄、性别、高血压史、糖尿病史、吸烟史、饮酒史无显著差异;NSTEMI组心率与对照组、STEMI组无显著差异,STEMI组较对照组间心率加快(P<0.05);NSTEMI组与STEMI组冠脉受累情况无显著差异;对照组cTnI为阴性,NSTEMI组及STEMI组较对照组cTnI明显增高(P<0.05)(见表 1)。
| 表 1 3组间患者临床资料的比较 |
与对照组比较,NSTEMI组WMSI、LVEDV、LVESV无显著差异,STEMI组WMSI、LVEDV、LVESV显著增加(P<0.05);与NSTEMI组比较,STEMI组WMSI、LVEDV、LVESV显著增加(P<0.05)。对照组、NSTEMI组、STEMI组LVEF依次减低(P<0.05)(见表 2)。
| 表 2 常规超声心动图参数的比较(x±s) |
与对照组比较,NSTEMI组左室三层心肌GLS、GCS以及跨壁应变梯度△GLS、△GCS显著减低(P<0.05),STEMI组左室三层心肌GLS、GCS以及跨壁应变梯度△GLS、△GCS显著减低(P<0.05);与NSTEMI组比较,STEMI组心外膜下心肌GCS显著减低(P<0.05),余分层应变指标在该两组间无统计学差异(见表 3、图 1、图 2)。
| 表 3 左室心肌分层纵向应变及环向应变的比较(x±s) |
|
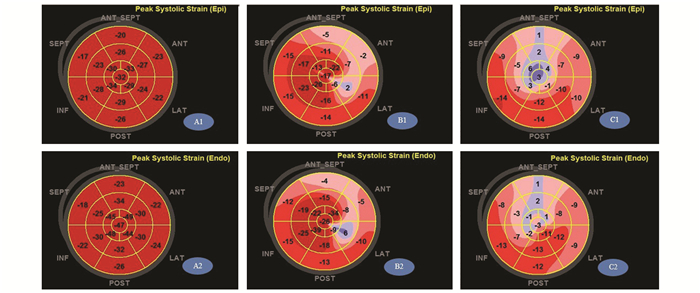
图 1 左室纵向收缩期峰值应变牛眼图 从左向右分别为对照组、NSTEMI组、STEMI组其中一例患者,A1、B1、C1为心外膜下心肌(27.0%、14.2%、5.6%),A2、B2、C2为心内膜下心肌(32.9%、17.2%、8.1%)。A1、A2牛眼图颜色较均一,B1、B2、C1、C2颜色相对纷杂 |
|
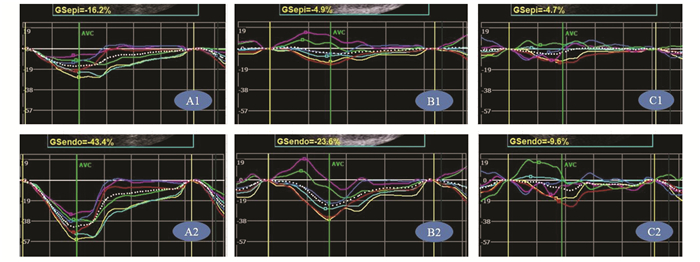
图 2 乳头肌水平环向应变 从左向右分别为对照组、NSTEMI组、STEMI组其中一例患者,A1、B1、C1为心外膜下心肌(16.2、4.9%、4.7%),A2、B2、C2为心内膜下心肌(43.4%、23.6%、9.6%)。A1、A2曲线较规则、一致,B1、B2、C1、C2曲线较为不规则、紊乱 |
根据SCA结果将NSTEMI组和STEMI组患者左室节段分为正常节段和受累节段,NSTEMI组、STEMI组纵向应变受累节段数分别为375、395,30例对照组,每例左室分为17节段,相应纵向应变节段数合计510。与对照组比较,NSTEMI组左室受累节段三层心肌TLS以及跨壁应变梯度△TLS显著减低(P<0.05),STEMI组左室受累节段三层心肌TLS以及跨壁应变梯度△TLS显著减低(P<0.05);与NSTEMI组比较,STEMI组左室受累节段三层心肌TLS以及跨壁应变梯度△TLS并无显著差异(见表 4)。
| 表 4 左室受累节段心肌分层纵向应变的比较(x±s) |
NSTEMI组、STEMI组环向应变受累节段数分别为419、390,30例对照组,每例左室分为18节段,相应环向应变节段数合计540。与对照组比较,NSTEMI组左室受累节段三层心肌TCS以及跨壁应变梯度△TCS显著减低(P<0.05),STEMI组左室受累节段三层心肌TCS以及跨壁应变梯度△TCS显著减低(P<0.05);与NSTEMI组比较,STEMI组左室受累节段三层心肌TLS以及跨壁应变梯度△TLS并无显著差异(见表 5)。
| 表 5 左室受累节段心肌分层环向应变的比较(x±s) |
冠心病心肌梗死是在冠状动脉病变的基础上,发生冠状动脉血供急剧减少或中断,使相应的心肌严重而持久地急性缺血导致心肌坏死,多由于冠状动脉粥样硬化斑块破裂、血栓形成,并导致病变血管的完全栓塞所致,根据其累及心肌层次范围可分为透壁型心肌梗死(STEMI)和非透壁型心肌梗死(NSTEMI),NSTEMI主要为一些心内膜下的心肌细胞坏死,但损伤未扩展至整个心室壁[1, 6]。NSTEMI的早期诊断及评价对冠心病患者后续治疗及预后评价意义重大,但心电图难以区分NSTEMI患者与无症状心肌缺血患者,而常规超声又难以肉眼准确识别,不利于及时采取相应的治疗措施,导致延误病情[7],因此寻找敏感及时识别NSTEMI患者心肌病变的参数尤为重要。
2D-STE是近年发展起来的一项超声新技术,有研究表明其可以准确地评价心肌梗死患者的左室功能及其变化,为临床治疗及判断预后提供参考[8]。左室壁包括三层心肌:内层斜肌、中层环肌、外层斜肌,正常人不同心肌层之间结构和功能不同。应用2D-STE技术能分层评价心肌三层结构的应变,为及时而敏感地协助诊断NSTEMI提供可能[2]。
本研究中,常规二维超声参数诸如WMSI、LVEDV、LVESV在NSTEMI与对照组之间无显著差异,因此难以直接筛选出NSTEMI患者。对三层心肌的应变参数进行比较,发现NSTEMI组纵向应变和环向应变各参数均较对照组显著减低,同时,NSTEMI心外膜下心肌GCS显著高于STEMI组,一方面提示STEMI患者较NSTEMI患者心外膜下心肌缺血损伤更为严重,与STEMI型心肌梗死累及心肌全层的病理特点相符合;另一方面提示该心外膜下心肌GCS可作为鉴别NSTEMI和STEMI的依据。而对于临床上难以识别的有胸痛症状的疑诊心肌梗死患者,当已有cTnI水平升高而ECG又无典型表现时,心内膜下心肌纵向或环向应变减低可协助诊断。
本研究中,NSTEMI组患者三层心肌应变较对照组均有受损,可能有以下几种原因:①因心肌梗死产生的心肌损伤不是独立的,各层心肌之间相互牵拉,每一层的形变都是自身形变与邻近心肌形变的综合效应;②非透壁心梗患者可能有不同程度的透壁缺血;③三层心肌之间无明显的界限,在描画心内膜测量应变时,横向分辨率的限制很可能也是一个重要影响因素。这可能也是大多2D-STE指标在透壁心肌梗死与非透壁心肌梗死间无显著差异的重要原因。本研究在分析过程中发现,部分NSTEMI患者,心内膜下心肌应变低于心外膜下心肌应变,提示非透壁心肌梗死(NSTEMI)患者心内膜下心肌较心外膜下心肌受损更为显著,但这样的例数较少,不具备统计学意义。
正常人中,收缩时心内膜下心肌在纵向应变和环向应变的变化都高于心外膜下心肌,即存在一定的跨壁梯度[9],本研究中,NSTEMI组、STEMI组此心肌跨壁应变梯度依然存在,但显著低于对照组。其可能原因是,冠心病患者左室三层心肌中,内层斜肌对缺血最为敏感,心肌缺血坏死导致的形态学和功能的改变也主要发生在这一层,随着病变的加重,缺血和坏死逐渐由心内膜下心肌延伸至心外膜下心肌[8, 9],但心内膜下心肌缺血和受损程度更严重,因此心内膜下心肌应变减低较心外膜下心肌更为显著,跨壁梯度减低甚至反向。
本研究局限性:鉴于本研究所纳入的患者多为急性心肌梗死,所以超声图像多为床边仪器采集,图像质量有限;只分析了纵向和环向收缩期峰值应变,未分析径向收缩期峰值应变,有研究认为径向应变不易准确测量,且识别心肌梗死时特异性有限[10];本研究所纳入的患者在采集图像之前不可避免地服用过少量治疗药物,如抗凝药等,可能对本研究结果有一些影响;三层心肌并不一定线性分界,软件却默认将其线性分层,这可能也会影响研究结果。
综上所述,2D-STE技术左室心肌分层应变参数能准确评价心肌梗死患者左室各层心肌纵向及环向运动,为临床识别NSTEMI提供有价值信息。
| [1] | 中华医学会. 临床诊疗指南·心血管分册[M]. 北京: 人民卫生出版社, 2013: 67-69. |
| [2] | Sarvari SI, Haugaa KH, Zahid W, et al. Layer-specific quantification of myocardial deformation by strain echocardiography may reveal significant CAD in patients with non-ST-segment elevation acute coronary syndrome[J]. JACC:Cardiovascular Imaging, 2013, 6(5): 535-544. DOI: 10.1016/j.jcmg.2013.01.009. |
| [3] | 胡波, 郭瑞强, 周青, 等. 二维斑点追踪技术预测急性心肌梗死患者介入治疗后左心室功能改善程度[J]. 中华超声影像学杂志, 2012, 9: 751-756. |
| [4] | Lang RM, Bierig M, Devereux RB, et al. Recommendations for chamber quantification:a report from the American Society of Echocardiography's Guidelines and Standards Committee and the Chamber Quantification Writing Group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology[J]. J Am Soc Echocardio Img, 2005, 18: 1 440-1 463. DOI: 10.1016/j.echo.2005.10.005. |
| [5] | 周永昌, 郭万学, 燕山, 等. 超声医学[M]. 第6版. 北京: 人民军医出版社, 2014: 622-623. |
| [6] | 胡大一等译.马歇尔·S·朗格, 马格努斯·奥赫曼·奈特.心脏病学彩色图谱[M].北京:人民卫生出版社, 2007:84-90. |
| [7] | Damman P, van GN, Wallentin L, et al. Timing of angiography with a routine invasive strategy and long-term outcomes in non-ST-segment elevation acute coronary syndrome:a collaborative analysis of individual patient data from the FRISC Ⅱ (Fragmin and fast revascularization during instability in coronary artery disease), ICTUS (Invasive Versus Conservative Treatment in Unstable Coronary Syndromes), and RITA-3 (Intervention Versus Conservative Treatment Strategy in Patients With Unstable Angina or Non-ST Elevation Myocardial Infarction) Trials[J]. J Am Coll Cardiol Int, 2012, 5: 191-199. DOI: 10.1016/j.jcin.2011.10.016. |
| [8] | Biering-Soensen T, Hoffmann S, Mogelvang R, et al. Myocardial strain analysis by 2-Dimensional speckle tracking echocardiography improves diagnostic of coronary artery stenosis in stable angina pectoris[J]. Circ:Cardiovasc Imaging, 2014, 7: 58-65. DOI: 10.1161/CIRCIMAGING.113.000989. |
| [9] | Leitman M, Lysiansky M, Lysyansky P, et al. Circumferential and longitudinal strain in 3 myocardial layers in normal subjects and in patients with regional left ventricular dysfunction[J]. J Am Soc Echocardiogr, 2010, 23(1): 64-70. DOI: 10.1016/j.echo.2009.10.004. |
| [10] | Gjesdal O, HelleValle T, Hopp E, et al. Noninvasive separation of large, medium, and small myocardial infarcts in survivors of reperfused ST elevation myocardial infarction:a comprehensive tissue Doppler and speckle-tracking echocardiography study[J]. Circ Cardiovasc Imaging, 2008, 1: 189-196. DOI: 10.1161/CIRCIMAGING.108.784900. |
 2016, Vol. 37
2016, Vol. 37

