小细胞肺癌(small cell lung cancer,SCLC)起源于支气管及细支气管黏膜上皮及黏膜下腺体的神经内分泌嗜银细胞,是最常见的肺神经内分泌肿瘤(neuroendocrine tumor,NET),约占肺NET的80.0%-90.0%[1],通常发病隐匿,对它的CT影像学征象报道相对较少,早期诊断和鉴别诊断比较困难。笔者通过对SCLC的胸部CT表现进行回顾性分析,旨在提高对其CT征象的认识。
1 资料与方法 1.1 一般资料搜集本院2006年1月-2014年12月经病理证实为SCLC且临床及胸部CT影像资料齐全的病例,临床资料主要包括:性别、年龄、吸烟史、病理资料、原发灶及转移灶情况。
1.2 胸部CT扫描及影像分析方法采用西门子的Somatom Sensation 16排CT,层厚/层距为5 mm,120 kV,100 mA,螺距1.0。增强扫描:高压注射器经肘静脉注入300 mg I/100 ml非离子型碘对比剂80-100 ml,流率3.0 ml/s,注射后45-60 s行实质期扫描。两名高级职称医师共同观察图像,记录病灶部位、大小、形状、边缘、密度、分叶征、毛刺征、胸膜凹陷征、磨玻璃征、胸腔积液、增强强化程度、合并肺不张、肺门及纵隔淋巴结肿大、胸膜转移等结果。
2 结果 2.1 临床资料符合要求的SCLC病例164例,男134例(81.7%),女30例(18.3%),年龄27-80岁,平均(60.2±10.4) 岁,110例有20支/d吸烟10年史。其中穿刺活检101例,手术22例,纤维支气管镜活检41例。肺部原发灶大小9-123 mm,平均(46.0±18.3) mm。有远处转移66例(40.2%),其中肝转移36例,骨转移29例,脑转移16例,肾上腺转移12例,腹膜后淋巴结转移5例,颌下腺、脾脏、胰腺、乳腺及皮下转移各1例,单部位转移36例,多部位转移30例。病灶单侧积液39例(23.8%),双侧胸腔积液2例(1.2%),心包积液17例(10.37%),心包并胸腔积液13例(7.9%)。120例行免疫组化染色。
2.2 CT表现32例仅行CT平扫检查,132例行CT平扫加增强扫描检查。病灶位于气管1例,左上叶40例、左下叶39例、左上叶并左下叶2例;右下叶35例、右上叶31例,右中叶13例、右中叶并右下叶1例,右上叶并右中叶1例,右全肺1例。病灶平扫CT值(23-49) Hu,平均值(37.4±5.1) Hu;增强后CT值增加(6-47) Hu,平均增加(18.8±5.6) Hu。病灶密度均匀119例(72.6%)、不均匀45例(27.4%),钙化3例(2.4%)。出现淋巴结肿大144例(87.8%),其中第1组13例,第2组37例,第3组9例,第4组91例,第5组42例,第6组58例,第7组92例,第8组48例,第9组48例,第10组125例,第11组2例。
中央型SCLC 121例(图 1) ,其中气管受侵1例,左主支气管4例,左下叶支气管29例(图 1) ,左上叶支气管30例,右主支气管2例,右中叶支气管12例,右下叶支气管18例,右上叶支气管23例,右上叶并右中叶支气管1例,右中叶并右下叶支气管1例;合并肺不张44例(36.4%);胸膜转移3例(1.8%),淋巴结肿大120例(99.2%)。
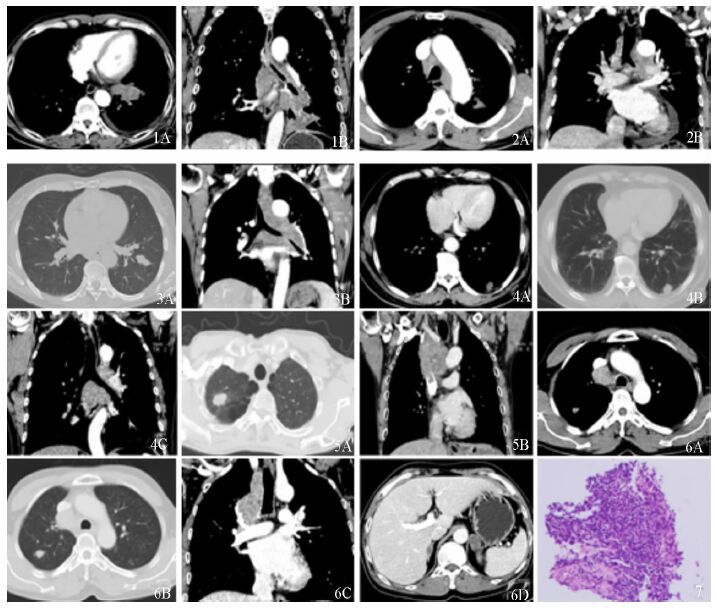
|
图 1-7 小细胞肺癌CT及病理表现 图 1,男性863(M/63) ,左下肺中央型SCLC,1A示左下肺门轻度强化肿块,1B示肺门、纵隔淋巴结肿大呈“冰冻纵隔”。图 2,M/71,左上肺周围型SCLC,2A示左上肺锥形小结节,2B示肺门及纵隔淋巴结肿大、心包积液。图 3,F/55,左下肺周围型SCLC,3A示左下肺边缘光滑、串珠状结节,3B示肺门及纵膈融合成团淋巴结肿大呈“冰冻纵隔”。图 4,M/70,左下肺周围型SCLC ,4A左下肺胸膜下轻度强化结节,局部胸膜增厚;4B示结节边缘光滑,4C示第5、7组淋巴结肿大。图 5,M/58,右上肺周围型SCLC,5A示右上肺周围型分叶状肿块,内可见空泡征,边缘见毛刺征,周围见肺气肿及肺大泡;5B示纵隔淋巴结肿大并侵入上腔静脉。图 6,M/58,右上肺周围型SCLC,6A示右上肺轻度强化小结节、第4组淋巴结肿大,6B示结节外侧边缘可见磨玻璃样密度影,6C示纵隔淋巴结肿大,6D示双侧肾上腺转移。图 7,病理显示光镜下细胞体积小而均一,高核浆比、无核仁或核仁不明显,癌细胞弥漫分布,无器官样结构(HE×40) 。 |
周围型SCLC 43例(图 2-6) ,形状类圆形40例(93.0%)(图 3-6) ,边缘光滑37例(86.0%)(图 3、4) ,分叶征31例(72.1%)(图 5) ,血管聚束征15例(34.9%),磨玻璃征11例(25.6%)(图 6) ,毛刺征5例(11.6%),胸膜凹陷征3例(7.0%),空泡征2例(4.7%),胸膜转移14例(32.6%),淋巴结肿大24例(55.8%)(图 2-6) 。
2.3 病理特征22例手术的SCLC大体标本表面凸凹不平,呈灰褐色,切面呈鱼肉状,可见坏死和出血。光镜下细胞体积小而均一,高核浆比、细颗状核染色质、无核仁或核仁不明显,有丝分裂像高,癌细胞弥漫分布,无器官样结构,坏死广泛(图 7) 。电镜下癌细胞内见有少数神经内分泌颗粒。免疫组织化学:神经内分泌标志物如嗜铬素A、突触素或神经细胞黏附分子CD56阳性,Ki-67增殖指数通常为80%-100%。
3 讨论 3.1 临床特点SCLC约占肺恶性肿瘤的20%-25%,是恶性程度最高的肺癌,5年生存率<5.0%[2]。好发于中老年人,平均65岁,80.0%以上为男性,其发生与吸烟密切相关,几乎均为重度吸烟者[2]。临床表现缺乏特异性,常见为咳嗽、咳痰、胸痛、体重下降等。本组平均年龄为60.3岁,男性占81.7%,67.1%有重度吸烟史,与文献报道相近。SCLC病理诊断多需要结合免疫组织化学检测,嗜铬素A、突触素或神经细胞黏附分子CD56阳性,Ki-67增殖指数通常为80%-100%,当其<25%时可排除SCLC的诊断[3]。
3.2 CT表现SCLC肿瘤CT密度多较均匀,一般无明显液化、坏死及钙化,Chong等报道23%伴有类癌成分时可以出现钙化[5]。肿瘤增强扫描多呈轻中度强化,平均CT值增加(19.2±11.0)Hu[6]。纵隔及肺门淋巴结转移发生早,约80%以上在初诊时即有肺门及纵隔淋巴结转移,大部分融合成团,占据纵隔脂肪间隙,使纵隔固定呈冰冻状,形成“冰冻纵隔”[6](图 1、3)。Rekhtman报道约84%的SCLC伴肺门淋巴结肿大,92%的SCLC伴纵隔淋巴结肿大,肿瘤本身及肿大淋巴结容易累及相应区域气管,使气管被包绕、受压、移位、变形、管腔闭塞,约30%伴有阻塞性肺不张,约38%伴有胸腔积液[2]。本组病例CT检查时有40.2%出现远处转移、87.8%有淋巴结肿大,其中第10组、7组及4组淋巴结肿大最为常见; 36.4%合并肺不张,钙化率为1.8%,增强后CT值平均增加(18.8±5.6)Hu,与文献报道相仿。按肿瘤发生部位,SCLC可分为中心型和周围型,90.0%-95.0%为中央型,主要起源于大的叶支气管及主支气管,少数为周围型[4]。中央型SCLC在CT上最常表现为肺门肿块影,肿瘤形态上以不规则形、多结节聚合状多见,肿块通常较大,多为4-5 cm左右,边缘一般呈分叶状(图 1)。
周围型SCLC常常原发灶小甚至未显示而肺门、纵隔淋巴结明显肿大,肺内病灶分期早而肺门、纵隔病变大分期晚[8](图 2-6)。周围型SCLC小病灶时常常呈梭形、分支状,提示病变环绕支气管、沿支气管黏膜下蔓延。病灶密度均匀无坏死,多数边界清楚,圆形或分叶,反映肿瘤快速生长[9]。Sone等报道5例早期SCLC小结节特征为梭形或锥形(图 2)、软组织密度、沿支气管长轴生长,而大结节增大时呈不规则形软组织密度、蠕虫状(vermiform)或菠萝果状(pine-cone-like)或串珠状(tandem-like)(图 3),伴有支气管征和分叶状轮廓,瘤结节体积倍增时间为38-217 d[10]。在CT追踪复查中肺内软组织结节生长快、边界清楚、明显分叶,常常提示SCLC[11]。磨玻璃密度可能为肺泡水肿、出血或癌细胞浸润,细毛刺征提示有血管、淋巴管或肺泡瘤细胞浸润[9]。本组周围型肺癌43例,93.0%形状为类圆形,86.0%边缘光滑,72.1%有分叶征,34.9%有血管聚束征,磨玻璃征25.6%,毛刺征1.6%,胸膜凹陷征7.0%,空泡征4.7%,32.6%出现胸膜转移,55.8%出现肺门、纵隔淋巴结转移,这些表现与其它周围型肺癌明显不同[6, 8]。
3.3 鉴别诊断肺NET分为类癌(包括典型类癌及非典型类癌)、大细胞神经内分泌癌及SCLC。类癌多见于中年女性、非吸烟者,多表现为腔内外结节或肿块,边界清楚,钙化较常见,增强显著均匀强化。大细胞神经内分泌癌多为周围型,直径多>4 cm,多数肿瘤内有坏死。当原发灶较小伴有明显广泛的肺门、纵隔淋巴结肿大和远处转移,它们不难鉴别。SCLC与两种最常见的周围型肺腺癌、鳞癌的对比研究中发现,胸膜凹陷征发生率明显低于腺癌、鳞癌; 磨玻璃征更常见于腺癌,其次为SCLC,鳞癌相对少见[7]; SCLC几乎不出现空洞,而鳞癌常因中心坏死的组织与支气管相通排出,故空洞形成率稍高。SCLC缺乏典型征象时在影像学上与肺内其它恶性肿瘤鉴别困难,确诊需要取材活检及免疫组化检查。因SCLC发现时多已出现转移,穿刺活检是诊断的重要方式,本组病例61.6%通过穿刺活检证实。
总之,有重度吸烟史的中老年男性,肺内病灶小并早期出现肺门、纵隔多发淋巴结肿大及远处转移时,应考虑到SCLC的可能。密度均匀、边缘光滑、轻中度强化是周围型SCLC最主要影像学表现。最终确诊依赖临床病理检查。
| [1] | Fank G, Krelbaum T, Yellin A, et al. Pulmonary carcinoid:presentation, diagnosis, and outcome in 142 cases in Israel and review of 640 cases from the literature[J]. Chest, 2001, 119(6): 1647-1651. DOI: 10.1378/chest.119.6.1647. |
| [2] | Rekhtman N. Neuroendocrine tumors of the lung:an update[J]. Arch Pathol Lab Med, 2010, 134(11): 1628-1638. |
| [3] | Travis WD. Lung tumors with neuroendocrine differentiation[J]. Eur J Cancer, 2009, 45(Suppl 1): 251-266. |
| [4] |
张文玉, 黄勇, 申洪明, 等. 肺神经内分泌肿瘤的临床病理特征及影像学诊断[J].
实用肿瘤杂志, 2012, 27(1): 101-104.
Zhang WY, Huang Y, Shen HM. Clinical pathological features and imaging diagnosis of pulmonary neuroendocrine tumors[J]. Journal of Practical Oncology, 2012, 27(1): 101-104. |
| [5] | Chong S, Lee KS, Chung MJ, et al. Neuroendocrine tumors of the lung:clinical, pathologic, and imaging findings[J]. Radiographics, 2006, 26(1): 41-57. DOI: 10.1148/rg.261055057. |
| [6] |
杨文, 杨鸿, 彭湘辉, 等. 多层螺旋CT在小细胞肺癌诊断中的价值[J].
放射学实践, 2014, 29(10): 1163-1166.
Yang W, Yang H, Peng XH, et al. Value of MSCT in the diagnosis of small cell lung cancer[J]. Radiologic Practice, 2014, 29(10): 1163-1166. |
| [7] |
康国庆. 肺癌病理类型与肿瘤CT征象关系分析[J].
实用放射学杂志, 2010, 26(9): 1280-1282.
Kang GQ. Analysis of the pathological type of lung cancer and CT Features[J]. Journal of Practical Radiology, 2010, 26(9): 1280-1282. |
| [8] | Heelan RT, Melamed MR, Zaman MB, et al. Radiologic diagnosis of oat cell cancer in a high-risk screened population[J]. Radiology, 1980, 136(3): 593-601. DOI: 10.1148/radiology.136.3.6250198. |
| [9] | Yabuuchi H, Murayama S, Sakai S, et al. Resected peripheral small cell carcinoma of the lung:computed tomographic-histologic correlation[J]. J Thorac Imaging, 1999, 14(2): 105-108. DOI: 10.1097/00005382-199904000-00007. |
| [10] | Sone S, Nakayama T, Honda T, et al. CT findings of early-stage small cell lung cancer in a low-dose CT screening programme[J]. Lung Cancer, 2007, 56(2): 207-215. DOI: 10.1016/j.lungcan.2006.12.014. |
| [11] | Wang JC, Sone S, Feng L, et al. Rapidly growing small peripheral lung cancers detected by screening CT:correlation between radiological appearance and pathological features[J]. Br J Radiol, 2000, 73(873): 930-977. DOI: 10.1259/bjr.73.873.11064644. |
 2017, Vol. 38
2017, Vol. 38
