2. 荆州市第二人民医院超声影像科 湖北 荆州 434000
2. Dept. of Ultrasound, The Second Hospital of Jingzhou, Jingzhou 434000, China
目前超声是筛查肝血管瘤的首选检查方法[1],但是低回声肝血管瘤常规超声图像并不典型,难以进行定性诊断[2],故临床多再行增强CT、MRI或穿刺活检等鉴别。本研究通过95例低回声肝血管瘤(hepatic hemangioma,HCH)及原发肝癌的超声造影参数及动态血管模式(dynamic vascular pattern,DVP)表现,对比分析,旨在探讨DVP对低回声肝血管瘤及原发性肝癌的鉴别诊断价值。
1 资料与方法 1.1 一般资料我院2013年3月-2014年8月经手术或穿刺病理学证实低回声肝血管瘤48例患者51个病灶,原发性肝癌39例,44个病灶,所有患者均经常规彩色多普勒超声及超声造影检查,男61例,女23例,年龄23-90(49.25±12.87)岁,其中9例合并肝硬化,7例合并脂肪肝,79例为单发病灶,8例为多发病灶。
1.2 方法 1.2.1 仪器设备与造影剂 1.2.1.1 超声诊断仪百胜MyLab twice型彩色超声诊断仪,凸阵探头,频率1.0-4.0 MHz,机械指数0.06-0.08。造影成像技术采用造影剂谐波成像技术,声输出指数为0.03。
1.2.1.2 造影剂造影剂采用SonoVue (Bracco)
1.2.2 超声检查方法研究方法参考欧洲医学和生物学超声协会发表的超声造影使用规范和临床应用指南,动态分析低回声肝血管瘤和原发性肝癌超声造影图像。首先常规超声检查肝脏形态、包膜、门脉、肝动脉与肝实质,记录病灶部位、回声强度、大小、毗邻关系、血流速度及阻力指数等;然后,进入低机械指数造影模式。选择肘正中静脉在2-3 s内快速团注Sonovue混悬液2.4 ml, 同时启动计时器,随后加注5 ml生理盐水;尽量保持观察切面不变,连续实时观察病灶的动态灌注过程,实时不间断观察病灶在动脉期(10-30 s)、门脉期(31-120 s)及延迟期(121-360 s)增强特点(包括增强的时间、形态和消退时间),并将图像资料输入内置硬盘内供分析用。
1.3 图像分析在SonoLiver分析软件工作站动态回放造影全过程,勾画定界区、分析区及参考区,绘制DVP曲线,获取相关指标录入Excel表格中,记录并计算出各时间-强度曲线(TIC)的相关指标。所有患者超声诊断均由经验丰富的超声科诊断医师作出,出现意见不一致或诊断困难时,有全科会诊得出诊断结果。
1.4 统计学方法研究所得数据应用统计软件SPSS 19.0进行分析,计量资料用均数±标准差(x±s)表示,采用t检验,如P<0.05则表示差异有统计学意义。
2 结果 2.1 超声造影基本表现 2.1.1 低回声肝血管瘤的超声造影表现低回声肝血管瘤超声造影增强模式分类:其超声造影表现为4种增强模式,其中以动脉期病灶边缘呈环状、结节样强化,门脉期向心性充填,延迟期造影剂无退出或轻度退出的①型增强模式多见,构成比为72.5%(37/51),详见表 1。
| 表 1 低回声肝血管瘤超声造影增强模式分布 |
41例(93.18%)呈快进快退型,3例(6.82%)呈快进慢退型,33例呈较均匀增强(75%),7例不均匀增强(15.91%),4例有不规则无增强区(9.09%)。
2.2 TIC参数在低回声肝血管瘤与原发性肝癌病变内上升时间(RT)、达峰时间(TTP)、平均渡越时间(mTT)均明显大于原发肝癌,低回声肝血管瘤峰值强度(IMAX)低于原发肝癌IMAX,差异均具有统计学意义(P<0.05),详见表 2。
| 表 2 低回声肝血管瘤与原发肝癌TIC参数比较 |
DVP曲线波形分为四种类型[3]:Ⅰ型,正负双向波,即曲线强度先为正值,后减小为负值,正值代表病灶内强度大于参考区,负值为强度小于参考区, Ⅱ型,正向波,即曲线一直位于基线以上,强度由小增大再减小,为一单峰波,没有位于基线之下的部分病灶区,Ⅲ型负向波,曲线完全位于基线下方病灶内造影剂为低灌注。Ⅳ型,负正双向波,即病灶区先低增强后高增,曲线强度先为负值,后为正值,负值部分为强度小于参考区,正值代表病灶内强度大于参考区。
本研究中低回声肝血管瘤增强模式与其DVP曲线关系见表 3。低回声肝血管瘤与原发性肝癌DVP曲线分布图见表 4。
| 表 3 低回声肝血管瘤增强模式与其DVP曲线关系 |
| 表 4 低回声肝血管瘤与原发肝癌DVP曲线分型分布(例) |
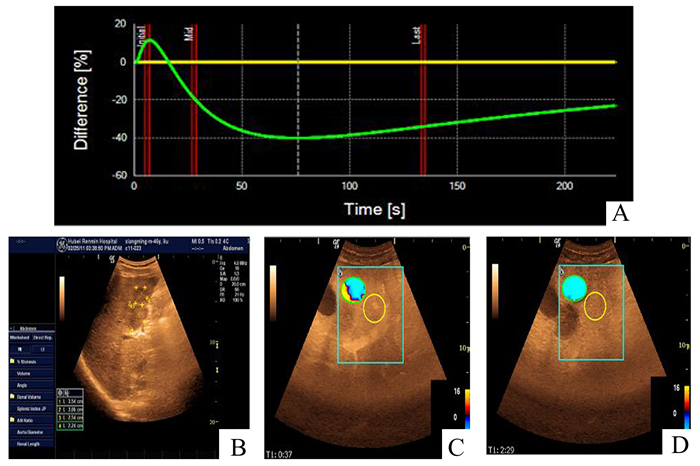
DVP参数图显示:暖色系(红或黄色)显示病灶增强高于肝实质,冷色系(蓝绿色)表示增强水平低于肝实质,黑色表示增强回声等于周围肝实质。DVP参数图分为4型,见图 1-4。Ⅰ型暖冷双色系,Ⅱ型暖色系,Ⅲ型冷色系,Ⅳ型冷暖双色系[4]。低回声肝血管瘤DVP曲线参数图特点:Ⅱ型为60.8%,整体填充或环状填充,红-黄-桔黄逐渐加深,之后缓慢变浅,造影结束时为红系。
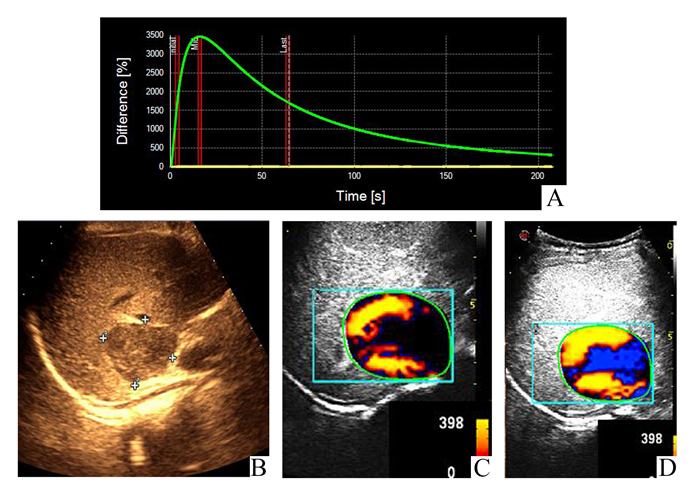
|
图 1 低回声肝血管瘤参数图表现(Ⅰ型) A:DVP曲线Ⅰ型正向波;B:肝右叶一低回声结节;C:第20秒DVP参数图呈环状黄色;D:第78秒呈黄蓝色不均色彩 |
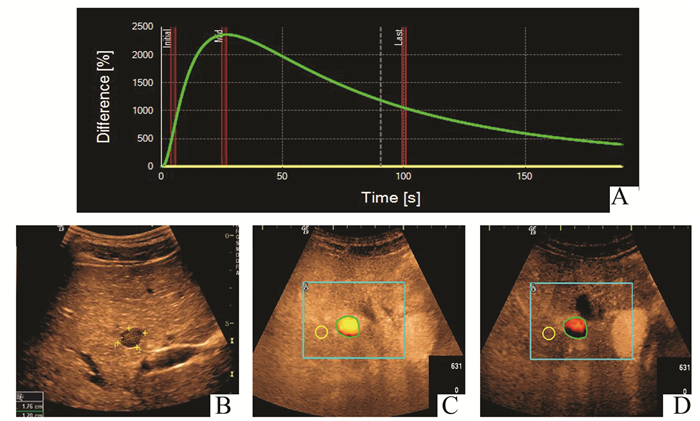
|
图 2 低回声肝血管瘤参数图表现(Ⅱ型) A:DVP曲线Ⅱ型正向波;B:肝右叶一低回声结节;C:第24秒DVP参数图呈黄色;D:第64秒DVP参数图呈红色和黑色 |
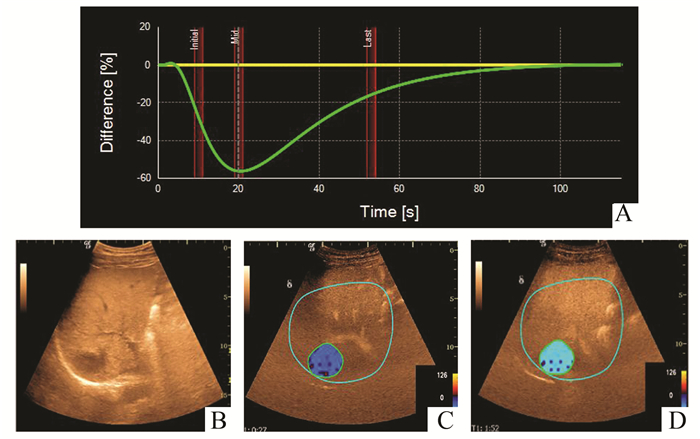
|
图 3 低回声肝血管瘤参数图表现(Ⅲ型) A:DVP曲线Ⅲ型负向波;B:肝右叶见一低回声结节;C:第16秒DVP参数图呈蓝色;D:第94秒DVP参数图呈蓝色 |
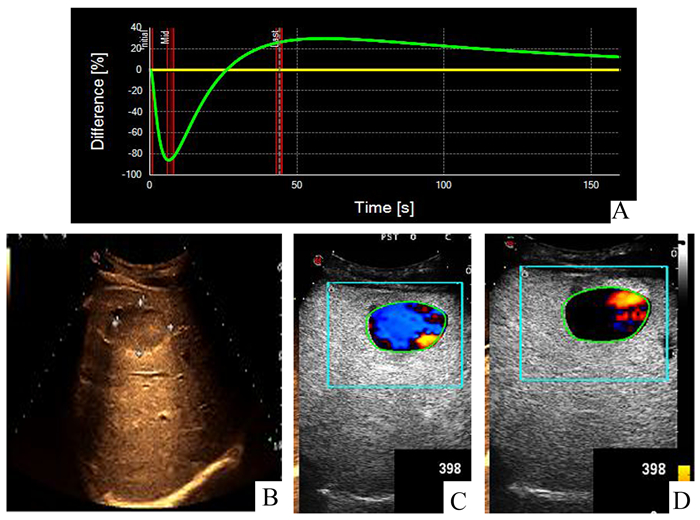
|
图 4 低回声肝血管瘤参数图表现(Ⅳ型) A:DVP曲线Ⅳ型负正向波;B:肝右叶低回声结节;C:第60秒DVP参数图呈蓝色-红色;D:第120秒DVP参数图呈黑-红色 |
原发性肝癌DVP曲线参数图特点:63.6%呈暖冷双色系(图 5),即Ⅰ型,动脉相红-黄快速颜色加深,后黄-桔快速变浅,门脉相不均匀蓝色。15.9%原发性肝癌表现为Ⅱ型,动脉相红-黄快速颜色加深,后黄-红缓慢变浅,造影结束时呈红或黑色。Ⅲ型18.2%,Ⅳ型为2.3%。
|
图 5 原发性肝癌DVP参数图 A:DVP曲线Ⅰ型正负向波;B:肝右叶多发低回声结节;C :第28秒DVP参数图呈红蓝不均色;D:第134秒DVP参数图蓝色 |
血管瘤近70%的血管瘤呈高回声,表现为强回声中混合不规则弱回声区,瘤体内部回声多均匀或轻度不均,边界清晰,多有棱角或毛刺样结构,边缘呈强回声[5]。较大的肝血管瘤、脂肪肝发生脂肪浸润、肝硬化发生等情况发生时,可呈低回声,与肝癌鉴别困难[6]。超声造影技术利用超声造影剂与机体组织间较大的声特性阻抗的差异,增大含造影剂的血液与相邻组织之间的声阻抗差,使获得的相关超声图像清楚地显示含造影剂的细小血流信号及微血管灌注,增加了图像的对比分辨率,提高了诊断的敏感性和特异性。故超声造影对低回声肝血管瘤和原发肝癌的鉴别诊断具有重要的价值。
本研究中低回声肝血管瘤超声造影增强模式分为4型,以动脉期病灶边缘呈环状、结节样强化,门脉期向心性充填,延迟期对比剂无退出或轻度退出的①型增强模式多见,构成比为72.5%(37/51)。这种增强形态或环状增强向心性扩大是肝血管瘤超声造影图像的一个重要特征[7]。这种造影特点与肝血管瘤是由结缔组织、毛细血管、静脉血窦交织构成,其大多数以门静脉供血为主,内部多为血流缓慢的血窦。②型6例,原因为小血管瘤内部组织结构相对均匀, 血管腔隙空间较小,血供较为丰富,而血流压力增大,很容易导致对比剂动脉期迅速充填,呈快速整体明显强化[8]。其延迟期对比剂退出,可能与血管瘤周围血管血供相对匮乏而内部静脉血管回流相对通畅有关[9]。③型3例,动脉期未见增强或极缓慢少量,可能与此病灶合并肝硬化(失代偿期),肝内血管发生形变,门静脉及肝动脉比例发生变化,导致血管瘤内压力变化有关。④型5例可能因肝血管瘤瘤内血管腔隙大小不一,血流灌注不均,表现为动脉期周边结节样增强[10];另外,血流压力较低,易形成血栓、坏死、钙化等,而导致延迟期无造影剂充填[11]。①型、②型血管瘤延迟相表现为低增强灶,可能与血池型造影剂,随血中微泡浓度降低,越来越少微泡进入血管瘤,瘤内相对静止的微泡在声场中有部分爆破有关[12]。
原发肝癌的造影表现:41例(93.18%)呈快进快退型,原发肝癌血供90%以上均来自肝动脉,血供绝大多数来自于肝动脉系统,大多数肝癌的血供较丰富,且以动脉供血为主,供血动脉扩张、迂曲,肿瘤周围及中心有异常增生的血管及动静脉吻合支,故在显像中呈“快进快出”的特点[13]。3例(6.82%)呈快进慢退型,病灶内造影剂廓清速度缓慢,延迟相表现为低回声,少数仍呈等或高增强,这种情况多见于分化相对较好的肿瘤。原发肝癌在延迟相消退慢的情况与是否存在肝硬化、肝硬化分化程度及透明性变性等关联。33例呈较均匀增强(75%),7例不均匀增强(15.91 %),4例有不规则无增强区(9.09%),其中小病灶多为均匀增强,不均匀者主要见于较大肿瘤,系部分瘤体缺血坏死或液化等所致。
本研究采用动态血管模式曲线图反映的是病灶与参考区的强度差随时间变化的过程。本研究中低回声肝血管瘤有3型:Ⅱ型31例,Ⅲ型13例,Ⅳ型7例。(即正型、负型、负正型)。正向波为单峰,开口向下,说明造影过程中造影剂强度始终高于参考区。负向波为单峰,开口向上,说明造影过程中造影剂强度始终低于参考区。负正双向波,即病灶区先低增强后高增强,曲线呈开口向上的类抛物线,以原点为起始点,先下后上,下降速率大于上升速率,上升支向上延伸至基线以上。肝血管瘤主要以门脉供血为主,始增时间较晚,其血管分布在病灶周边或整个流体中,内含丰富的血窦,血流量多但流速缓慢,造影剂持续充盈,因此DVP曲线为Ⅱ型或Ⅳ型,最终保持在基线上方。Ⅲ型13例可能与血管栓塞有关,可能与瘤内组织结构及血管腔隙大小有关[14]。原发肝癌Ⅰ型28例,Ⅱ型7例,Ⅲ型8例,Ⅳ型1例,其中Ⅰ型28例(28/44)构成比63.6%,即正负双向波,即病灶区先高增强后低增,曲线强度先为正值,后为负值,负值部分为强度小于参考区,正值代表病灶内强度大于参考区,呈快进快退型表现。这与恶性肿瘤有大量新生血管,血管分支增粗、紊乱,血流灌注量快速明显增加,且病灶缺乏正常肝组织及存在动静脉瘘等原因有关[15],其中Ⅱ型的肝癌分化程度高,以门脉供血为主或由肝动脉、门静脉双重供血为病理基础,Ⅲ型均为肝癌伴液化,造影过程中病灶区平均增强水平低于周围肝实质。Ⅳ型1例少见,原因尚待分析。
应用超声造影后造影剂中的微泡散射值比红细胞大的多,可增强小血管的多普勒信号,从而提高多普勒超声鉴别肝低回声血管瘤和原发肝癌的准确性和敏感性。本研究通过DVP曲线分析低回声肝血管瘤与原发肝癌的造影差别,直观地反映了病变区与周围肝实质血流灌注差异,比较二者不同,为其鉴别提供新的指标。总之,超声造影技术加上动态血管模式的分析对低回声肝血管瘤和原发肝癌的鉴别诊断有重要意义。
| [1] | Unal E, Francis F, Aquino A, et al. Liver transplant for mixed capillary-cavernous hemangioma masquerading as hepatocellular carcinoma in a patient with hepatocellular carcinoma[J]. Exp Clin Transplant, 2011, 9(5): 344-348. |
| [2] | Lupinacdi RM, Szeinfeld D, Farah JF. Spontaneous rupture of a giant hepatichemagioma. Sequential treatment with preoperative transcatheter arterial embolization and conservative hepatectomy[J]. G Chir, 2011, 32(11): 469-472. |
| [3] | Rognin N, Arditi M, Mercier L, et al. Parametric imaging of characterizing focal liver lesions in contrast enhanced ultrasound[J]. IEEE Trans Uhrason Ferroelectr Freq Control, 2010, 57: 2 503-2 511. DOI: 10.1109/TUFFC.2010.1716. |
| [4] | 张春莉, 陈文卫, 柏刚, 等. 动态血管模式在肝局灶性病变超声造影鉴别诊断中的应用价值[J]. 中华超声影像学杂志, 2013, 22(3): 226-229. |
| [5] | 张艳平, 郭争捷, 常建东, 等. 超声造影对肝血管瘤的诊断价值[J]. 中国实用医药, 2013, 8(7): 90-91. |
| [6] | 聂春晖, 孙军辉, 张岳林, 等. 巨大肝血管瘤的影像学表现及栓塞治疗[J]. 中华消化外科杂志, 2013, 12(9): 663-667. |
| [7] | Kim JH, Kim TK, Kim BS, et al. Enhancement of hepatic hemangiomas with Levovist on coded harmonic angiograph ultrasongraphy[J]. Ultrasound Med, 2002, 21: 141-148. |
| [8] | 张金甲, 张正顺, 王华录, 等. 超声造影对细菌性肝脓肿的诊断与鉴别诊断价值[J]. 中国超声医学杂志, 2012, 28(11): 1 009-1 011. |
| [9] | 张学兰, 杨杰. 超声造影在肝恶性肿瘤鉴别诊断中的应用价值[J]. 中国超声医学杂志, 2010, 26(10): 928-931. |
| [10] | 刘心, 周俊林, 刘婷, 等. 超声造影和增强CT对肝血管瘤的诊断价值比较[J]. 实用放射学杂志, 2012, 28(1): 61-64. |
| [11] | 薛恒, 苗立英, 王金锐, 等. 肝内血管异常引流的超声及超声造影表现[J]. 中国医学科学院学报, 2014, 36(5): 534-537. |
| [12] | 林玲, 袁朝新, 曾晓峰, 等. 肝血管瘤超声造影非典型病例分析[J]. 四川医学, 2007, 28(1): 31-32. |
| [13] | 陈敏华, 戴莹, 严昆, 等. 新型超声造影技术对微小肝癌的诊断价值[J]. 北京大学学报:医学版, 2005, 10: 354-356. |
| [14] | Yamashita Y, Ogata I, Urata J, et al. Carveneous hamangioma of the liver:pathologic correlation with dynamic CT findings[J]. Radiology, 1997, 203: 121-125. DOI: 10.1148/radiology.203.1.9122378. |
| [15] | 黄耿文, 杨连粤, 鲁伟群. 肝癌新生血管的形态学异常及其临床意义[J]. 肿瘤防治研究, 2007, 34: 449-450. |
 2016, Vol. 37
2016, Vol. 37

 ,
,