DNA异常甲基化与肿瘤的发生密切相关。新近研究发现10-11转位酶1(ten-eleven translocation 1, TET1)是一种具有极其重要作用的DNA去甲基化酶,其通过转化5-甲基胞嘧啶(5-mC)为5-羟甲基胞嘧啶(5-hmC)进而启动DNA去甲基化[1]。目前已发现TET1在胃癌、结肠癌及乳腺癌等多种恶性肿瘤中异常表达,并与肿瘤的发生密切相关[2-4]。然而,TET1在肝细胞癌(hepatocellular carcinoma,HCC)组织中的研究报道尚少。本研究通过检测126例肝癌及癌旁组织中TET1 mRNA及蛋白的表达情况,探讨其表达水平与临床病理特征间的关系及其临床意义。
1 材料与方法 1.1 临床资料收集2015年1月至2017年6月期间我院肝胆胰外科行肝癌手术治疗的126例患者肝癌及其相应癌旁组织标本,其中癌旁组织取材于距肿瘤边缘3 cm以上,标本离体后立即置于液氮冻存。所有病例具有完整临床病理资料,术前均无肝外转移及未行放化疗等其他抗肿瘤治疗,所有病例术后均经病理检查核实确认为肝细胞癌。126例患者中男105例,女21例,年龄29-78岁,中位年龄52.3岁。临床病理分期按UICC/AJCC法:Ⅰ期39例,Ⅱ期23例,Ⅲ期60例, Ⅳ期4例。
1.2 试剂逆转录及实时荧光定量PCR试剂盒购于日本TaKaRa公司;PCR引物由上海生工生物工程公司合成。TET1兔抗人多克隆抗体购于美国Abcam公司,免疫组化SP法试剂盒等购于北京中杉金桥生物技术有限公司。
1.3 方法 1.3.1 实时定量RT-PCR检测肝癌及癌旁组织中TET1 mRNA表达按照TRIzol试剂说明书进行组织标本总RNA提取。TET1引物序列:5′-TCCGACGCTACTCAGATGAAAGT-3′(正义链),5′-GATTTGTCCAGTGCCATCTTTGT-3′(反义链);内参β-actin引物序列:5′-GGAGAATGGCCCAGTCCTC-3′(正义链),5′- GGGCACGAAGGC TCATCAT -3′(反义链)。按照逆转录试剂盒说明书操作方法将RNA逆转录成cDNA,按照实时荧光定量PCR试剂盒说明书方法进行PCR反应,循环反应条件:95 ℃10 s,60 ℃20 s,72 ℃20 s,共45个循环。以2-ΔΔCt的方法表示HCC组织中目的基因TET1 mRNA表达量相对于配对的癌旁组织的变化倍数,ΔΔCt = [实验组Ct (目的基因)-实验组Ct (内参基因)] - [对照组Ct (目的基因)-对照组Ct (内参基因)]。
1.3.2 组织芯片制备先将收集的标本常规进行石蜡包埋组织切片并H & E染色病理诊断,显微镜下仔细观察染色切片,选择代表性的区域并标记于组织蜡块;应用组织打孔针(直径1.0 mm)在组织蜡块上已标记的区域打孔,获得小圆柱状组织芯,逐一对常规蜡块取样,然后使用组织芯片仪将获得的组织芯按阵列排列插入到空白受体蜡块中制成芯片蜡块,每例标本重复3个点;组织芯片蜡块常规切片行免疫组织化学检测。
1.3.3 免疫组织化学法检测TET1蛋白在HCC及癌旁组织中的表达应用免疫组化SP法检测,按常规方法对组织芯片切片进行脱蜡、水化、抗原修复等。将TET1一抗抗体(1:1 000)均匀覆盖所有芯片样点,4 ℃孵育过夜,PBS代替一抗作为阴性对照;二抗常规室温孵育1 h, 二氨基联苯胺(DAB)显色,控制每张芯片显色时间一致。TET1阳性染色为细胞胞质、胞核或胞膜出现黄色或棕黄色显色。染色结果判断,根据阳性染色强度评分(A分):无染色0分,轻度1分,中度2分,强染色3分;根据阳性细胞数比例计分(B分):200倍显微镜下5个随机视野中200个细胞中若阳性细胞数比例≤5%计0分,>5%-25%计1分,>25%-50%计2分,>50%-75%计3分,≥75%计4分。然后根据Allred score积分方法判定TET1蛋白表达程度(A分×B分):0分为无表达(-);1-4分为(±);5-8分为(+);9-12分为(++)。统计分析时将(-)和(±)归为低表达,(+)和(++)归为高表达。
1.4 统计学方法应用SPSS 20.0统计软件分析。计数资料组间比较采用χ2或Fisher精确检验;进一步采用多因素二分类Logistic回归分析TET1表达的危险因素,使用Forward(LR)筛选方法。以P<0.05为差异有统计学意义。
2 结果 2.1 TET1 mRNA在HCC及相应癌旁组织中的表达TET1 mRNA在HCC中表达相对强度为[0.07(0.01, 0.14)],较癌旁组织[1(1, 1)]明显下降,差异具有统计学意义(P<0.01)。
2.2 TET1蛋白在HCC及癌旁组织中的表达情况(图 1,表 1)
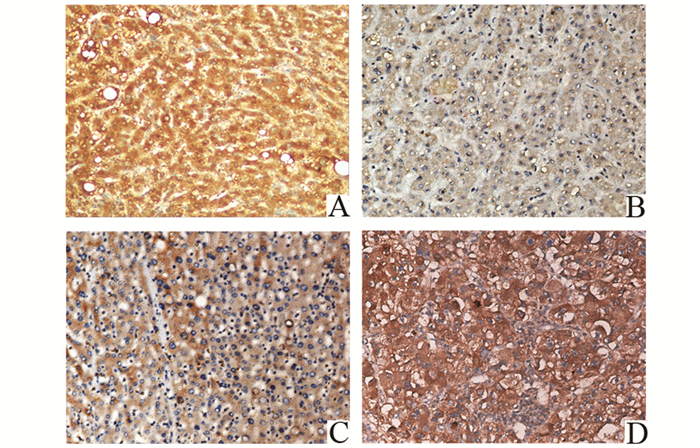
|
图 1 TET1在HCC及癌旁组织中的表达
(免疫组化×200) A:癌旁组织;B、C、D分别为HCC(±)、(+)及(++)表达强度 |
| 表 1 TET1蛋白在HCC及癌旁组织中的表达 |
通过组织芯片免疫组化技术对126例HCC及相应癌旁组织进行TET1蛋白进行检测显示,HCC组织中TET1表达强度由低至高依次为:28.6%、48.4%、15.9%、7.1%;而癌旁组织为9.5%、18.3%、34.9%、37.3%。与癌旁组织比较,HCC中TET1蛋白表达水平明显低于癌旁组织(P<0.01)。
2.3 TET1蛋白表达水平与HCC临床病理特征的关系(表 2)| 表 2 TET1蛋白表达水平与HCC临床病理特征间的关系 |
HCC中TET1蛋白表达水平与性别(P= 1.000)、年龄(P= 0.424)、乙肝(P= 0.699)、肝硬化(P= 0.583)、肿瘤包膜(P= 0.480)等临床病理特征间无明显相关(P>0.05);而与肿瘤大小(P=0.010)、血管侵犯情况(P= 0.041)及临床分期(P<0.001)等因素显著相关,临床病理特征恶性程度越高,其蛋白表达水平越低,差异具有统计学意义。
2.4 TET1低表达多因素Logistic回归分析(表 3)| 表 3 TET1蛋白低表达的多因素Logistic分析 |
多因素回归分析显示HCC中肿瘤大小(OR=1.866,P= 0.241)及血管侵犯情况(OR=1.992,P= 0.209)不是TET1低表达的危险因素(P>0.05);而肝癌TNM分期是TET1低表达的独立危险因素(P=0.000,回归系数= 2.526;OR=12.508,95% CI:3.484-44.914)。
3 讨论在肿瘤的发生发展过程中,非基因突变的表观遗传学调控也发挥着重要作用,并贯穿始终[5]。DNA甲基化是表观遗传学调控的重要代表方式。若基因启动子过度甲基化则会使该基因表达受抑或完全沉默;反之,低甲基化则会使其表达水平上调。若抑癌基因启动子去甲基化过程受阻则会导致其表达下调或缺失,抑癌功能失活从而促进了肿瘤的发生发展。TET1是近年来发现的参与DNA甲基化水平调控、具有极其重要作用的DNA去甲基化酶。其通过催化5-甲基胞嘧啶(5-mC)为5-羟甲基胞嘧啶(5-hmC),并最终使胞嘧啶完全脱去甲基从而达到DNA去甲基化目的[1]。目前研究发现,TET1参与了多种病理生理调控,在胃癌、肾癌、乳腺癌及结直肠癌等恶性肿瘤中显著低表达,并提示其可能具有抑癌基因作用[2-4, 6],但具体作用机制仍不清楚,肝癌组织中的TET1的表达情况也鲜见文献报道,因而有必要对此进行相关研究,并且有助于阐明其临床意义和在HCC发生发展过程中的作用。
为探讨TET1在肝癌及其癌旁组织中的表达水平以及与HCC临床病理特征间的关系,通过对126例HCC及癌旁组织的TET1 mRNA和蛋白检测发现,HCC中TET1 mRNA及其蛋白表达水平明显低于癌旁组织,即TET1在HCC组织中显著低表达。这一结果与已报道的TET1在大多数其他恶性肿瘤的表达情况一致。HCC中TET1蛋白表达水平与性别、年龄、乙肝、肝硬化、肿瘤包膜等临床病理特征无明显相关;而与肿瘤大小、血管侵犯情况及临床分期等因素显著相关,且多因素回归分析提示临床病理分期是TET1低表达的独立危险因素,结果提示TET1可能与HCC的生长、侵袭及临床病理恶性程度等有关,并且进一步提示了HCC中TET1低表达可能对HCC具有促进作用,并有可能与预后有关,但仍需进一步研究证实。Rasmussen等[7]的研究显示TET1表达水平还与预后有关,表达水平越低则临床预后越差。结合研究结果进一步提示TET1可能在HCC的发生发展过程中发挥着重要作用,有可能作为HCC的治疗靶点和预后判断指标。
目前,肝癌中TET1低表达的原因及机制并不十分清楚。有研究发现上调microRNA-29a后TET1表达明显下调,并使得TET1下游基因过度甲基化而失活从而促进肿瘤转移[8]。然而是否有其他microRNA或长链非编码RNA也参与了对TET1的调控,目前仍未知,因此关于TET1表达调控及机制亟待深入研究。目前的研究已表明TET1参与了许多生物学调控,并起到关键作用,包括受精卵及胚胎发育、干细胞的分化以及肿瘤调控等[9]。在肿瘤方面,Neri等[10]研究发现通过上调结肠癌细胞TET1的表达可以显著抑制肿瘤细胞的生长及动物种植瘤的形成,提示TET1具有显著抑癌基因作用。这些均表明TET1具有重要生物学功能,有必要对TET1在肿瘤中的作用及机制进行深入研究。
综上所述,本研究发现TET1在HCC组织中低表达,并且其低表达可能与肝癌的发生发展有关,具体作用机制尚待深入研究。
| [1] | Chapman CG, Mariani CJ, Wu F, et al. TET-catalyzed 5-hydroxymethylcytosine regulates gene expression in differentiating colonocytes and colon cancer[J]. Sci Rep, 2015, 5: 17568. DOI: 10.1038/srep17568. |
| [2] | Cheng YW, Chou CJ, Yang PM. Ten-eleven translocation 1 (TET1) gene is a potential target of miR-21-5p in human colorectal cancer[J]. Surg Oncol, 2018, 27(1): 76-81. DOI: 10.1016/j.suronc.2017.12.004. |
| [3] | Wang KC, Kang CH, Tsai CY, et al. Ten-eleven translocation 1 dysfunction reduces 5-hydroxymethylcytosine expression levels in gastric cancer cells[J]. Oncol Lett, 2018, 15(1): 278-284. |
| [4] | Wang H, An X, Yu H, et al. MiR-29b/TET1/ZEB2 signaling axis regulates metastatic properties and epithelial-mesenchymal transition in breast cancer cells[J]. Oncotarget, 2017, 8(60): 102119-102133. |
| [5] |
孙雅楠, 佘文婷, 薛敬玲, 等. 口腔黏膜异常增生不同阶段上皮细胞E-cadherin、Twist1启动子甲基化研究[J].
武汉大学学报:医学版, 2016, 37(5): 689-693, 707.
Sun YN, She WT, Xue JL, et al. Methylation status of twist1 and E-cadherin promoter in different grades of oral epithelium[J]. Medical Journal of Wuhan University, 2016, 37(5): 689-693, 707. |
| [6] | Fan M, He X, Xu X. Restored expression levels of TET1 decrease the proliferation and migration of renal carcinoma cells[J]. Mol Med Rep, 2015, 12(4): 4837-4842. DOI: 10.3892/mmr.2015.4058. |
| [7] | Rasmussen KD, Helin K. Role of TET enzymes in DNA methylation, development, and cancer[J]. Genes Dev, 2016, 30(7): 733-750. DOI: 10.1101/gad.276568.115. |
| [8] | Chen Q, Yin D, Zhang Y, et al. MicroRNA-29a induces loss of 5-hydroxymethylcytosine and promotes metastasis of hepatocellular carcinoma through a TET-SOCS1-MMP9 signaling axis[J]. Cell Death Dis, 2017, 8(6): e2906. DOI: 10.1038/cddis.2017.142. |
| [9] | Yin X, Xu Y. Structure and function of TET enzymes[J]. Adv Exp Med Biol, 2016, 945: 275-302. DOI: 10.1007/978-3-319-43624-1. |
| [10] | Neri F, Dettori D, Incarnato D, et al. TET1 is a tumour suppressor that inhibits colon cancer growth by derepressing inhibitors of the WNT pathway[J]. Oncogene, 2015, 34(32): 4168-4176. DOI: 10.1038/onc.2014.356. |
 2018, Vol. 39
2018, Vol. 39


