研究发现,12%-15%育龄夫妇存在不孕问题,不孕因素中男性精液质量异常,少弱精症导致的不育占40%-50%[1, 2]。除了可能存在遗传因素、感染因素、吸烟、不良生活环境等原因外,仍有30%少弱精症病因不明,被称为原发性不育[3]。此类患者只能依靠供精或单精子卵胞浆内注射来获得子女,由此引起的心理问题、伦理问题、遗传学问题及社会问题不容忽视。
PiRNA在精子发生过程中的减数分裂阶段起到重要的调控作用,其与Ago家族的PIWI蛋白结合,来调控生殖细胞系的外转位子沉默,从而调控生殖细胞的发育[4]。任何一个PIWI蛋白突变都有可能影响到生殖细胞,导致DNA受损和生殖细胞的凋亡。HIWI2基因是PIWI家族中一种,本研究选取HIWI2的rs508485位点测定其多态性分布,以期了解HIWI2基因的多态性是否与重度少精症相关,拟为男性不育的诊断和预后分析寻找新的生物学标记,并希望为治疗男性不育提供新的思路。
1 材料与方法 1.1 研究对象2013年9月-2014年9月在武汉大学中南医院生殖医学中心选取以不育为主诉就诊的精子活力低下且不伴形态异常男性,所有患者参考世界卫生组织(WHO)修订标准(第四版)选取,其中轻度少精症72例,重度少精症70例。所有患者常规体格检查未发现明显异常,均排除生殖道感染、系统性疾病病史、精索静脉曲张、精液液化异常、染色体异常、不良生活习惯及激素水平异常等可能导致精子活力下降的因素。选取精液密度活力正常男性,并经详细询问病史确认夫妻结婚后女方先前怀过孕或者经体外受精-胚胎移植成功怀孕的男性70例作为对照。精液分析检查以2-3次为准,每次检查结果均提示精液密度低于正常值才可诊断少精症,所有结果均提示正常才可诊断精液正常。抽取三组研究对象外周抗凝血2 ml。样本收集经过武汉大学中南医院伦理委员会批准。
1.2 DNA提取和PCR反应和序列分析根据外周血DNA提取试剂盒操作手册,提取基因组DNA,PCR扩增HIWI2 rs508485基因片段,扩增引物依据文献合成[5]。反应体系在94 ℃预变性5 min, 94 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸30 s程序循环30次,72 ℃终末延伸5 min。PCR反应产物鉴定并纯化后由上海生工完成测序,测序结果用Chromas 2.30软件显示,人工校读并分析重复序列。引物见表 1。
| 表 1 HIWI2 rs508485的PCR扩增引物序列 |
组间突变率的比较采用卡方分析。组间突变率与精子活力的比较采用t检验。轻度少精与重度少精与基因分型关系采用相关回归分析。应用SSPS 16.0分析软件分析。P < 0.05为差异有统计学意义。
2 结果 2.1 参加人群基本特征研究选取72名轻度少精患者及70名重度少精患者,70名精液分析各项结果正常男性作为对照。少精人群及对照组人群特征见表 2。结果显示对照组与轻度少精组及重度少精组在年龄上及吸烟史上无明显差异。
| 表 2 精液异常人群与对照组基本信息 |
从图 1中测序峰图可以判读rs508485的T>C突变。
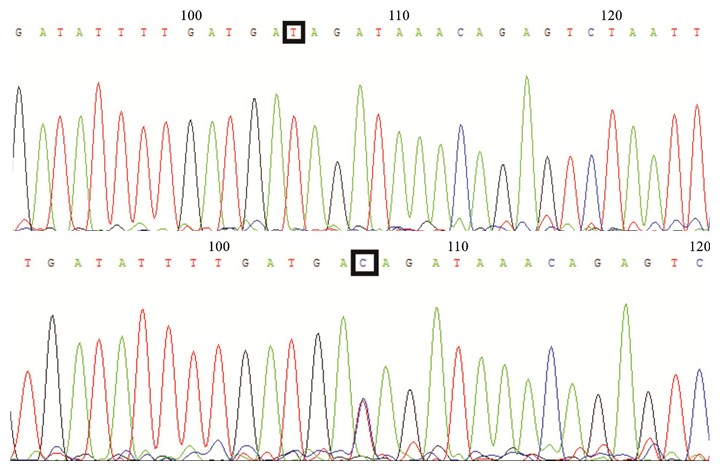
|
图 1 HIWI2的Rs508485两种单核苷酸代表性测序图 |
见表 3。从表 3中看出所有的实验对象在HIWI2 rs508485基因型中均表现有CC及突变型两种基因型,对照组70例男性中CC型39例,占55.7%,突变型占31例,44.3%。72名轻度少精症患者中CC型28例,占38.9%,CT/TT型有44例,占61.1%。与对照组相比,相对危险性(Odds Ratio, OR)为1.98,95%CI(1.01-3.88), P=0.046 2, 差异有显著性。70名重度少精症患者中CC型21例,占34.4%,突变型占65.6%,OR值为2.40,95%CI(1.18-4.87)。P=0.002,有显著性差异。
| 表 3 少精症及重度少精症基因多态性分布 |
精子发生是指由精原细胞经初级精母细胞、次级精母细胞、精细胞至成熟精子形成的过程。整个过程分为3个阶段:精原细胞的增殖、精母细胞的减数分裂和精子细胞的变形过程。这一复杂的过程受到多重因素的调控。
来源于动物的研究表明PIWI基因均高表达于成体睾丸的生殖细胞,在精子的发生中起到重要作用。研究发现在实验动物中如PIWI基因受损,物种外观上没有明显缺陷的表现,但生殖系受损,将会导致不育。如小鼠有三种Piwi蛋白:miwi、miwi2和mili, 全部在睾丸中高表达,在精原干细胞的自我更新和精子细胞发育中是必不可少的。mili和miwi蛋白出现在小鼠精子发生的不同阶段:mili存在于从精原细胞到粗线期精母细胞发生阶段的生殖细胞中,miwi则存在于从粗线期精母细胞到圆形精子细胞发生阶段的生殖细胞中。任何一个Piwi蛋白突变都会影响到生殖细胞,导致DNA受损和生殖细胞的凋亡[6-8]。在雄性小鼠中分别敲除miwi、miwi2和mili的纯合子,会出现有丝分裂停滞,最后导致生精停滞、生殖细胞凋亡导致雄鼠的不育。
人类Piwi亚家族包括4种蛋白:hiwi, hiwi2, hiwi3以及hili。虽然hiwi3在精子生成过程中的作用尚不明确,但已被证实其同其他3种Piwi蛋白一样在精子生成过程中起到了维系mRNA稳定性,并在调控精子生长发生中起到重要作用。
本研究中以142名特发性少精子症的不育男性为研究对象,其中包括72名轻度少精子症及70名重度少精子症患者,70名精液参数正常男性为对照,研究结果显示,所有研究对象在HIWI2基因rs508485均有野生型CC和突变型T>C存在。排除其他可能相关因素,如吸烟、年龄等,相关回归分析结果显示突变频率在少精子症患者中有明显改变,与正常对照组相比突变与特发性少精子症显著相关。此结果与Gu[5]的结果基本相似,但在Gu的研究中认为HIWI2的rs508485的突变仅与重度少精子症相关,他认为PIWI基因的突变可能仅仅只是一个精子生成障碍的相对影响因素,而不是绝对影响因素。但在本研究中HIWI2的rs508485的突变不仅与重度少精有关,与轻度少精症也明显相关,是否进一步提示HIWI2基因单核苷酸的突变可能是导致精子生成障碍的一个重要因素。但是本研究的样本数量相对较少,并且目前国内外针对PIWI家族对精子发生的相关性研究很少,其对精子发生的影响是否绝对、不同国家、种族、地区的人群中是否存在有异质性,目前均不可轻易下结论,有待于更大样本及多地区的人群的深入研究。
| [1] | World Health Organization. Towards more objectivity in diagnosis and management of male infertility. Results of WHO multicenter study[J]. Int J Androl, 1987, 7(Suppl): 1-53. |
| [2] | Xiong DK, Chen HH, Ding XP, et al. Association of polymorphisms in glutathione S-transferase genes (GSTM1, GSTT1, GSTP1) with idiopathic azoospermia or oligospermia in Sichuan, China[J]. Asian J Androl, 2015, 17(3): 481-486. |
| [3] | Pasqualotto FF, Pasqualotto EB, Sobreiro BP, et al. Clinical diagnoosis in men undergoing infertility investigation in a university hospital[J]. Urol Int, 2006, 76: 122-125. DOI: 10.1159/000090873. |
| [4] | Zhao S, Gou LT, Zhang M, et al. Pi-RNA triggered MIWI Ubiquitination and removal by APC/C in late spermatogenesis[J]. Develpmental cell, 2013, 24(1): 13-25. DOI: 10.1016/j.devcel.2012.12.006. |
| [5] | Gu A, Ji G, Shi X, et al. Genetic variants in Piwi-interacting RNA pathway genes confer susceptibility to spermatogenic failure in a Chinese population[J]. Hum Reprod, 2010, 25(12): 2955-2961. DOI: 10.1093/humrep/deq274. |
| [6] | Kuramochi-Miyagawa S, Kimura T, Ijlri TW, et al. Mili, a mammalian member of piwi family gene, is essential for spermatogenesis[J]. Development, 2004, 131(4): 839-849. DOI: 10.1242/dev.00973. |
| [7] | Carmell MA. MIWI2 is essential for spermtogenesis and repression of transposons in the mouse male germline[J]. Dev Cell, 2007, 12(4): 503-514. DOI: 10.1016/j.devcel.2007.03.001. |
| [8] | Keam SP, Young PE, McCorkindale AL, et al. The human Piwi protein Hiwi2 associates with tRNA-derived piRNAs in somatic cells[J]. Nuckeic Acids Research, 2014, 42(14): 8984-8995. DOI: 10.1093/nar/gku620. |
 2017, Vol. 38
2017, Vol. 38
