2. 华中科技大学同济医学院 湖北 武汉 430030
2. Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
异烟肼、利福平为抗结核化疗一线方案的核心药物,但异烟肼和利福平在发挥抗结核疗效的同时,也导致肝脏发生不同程度的损伤,尤其是两种药物联合应用时可增加肝损害的发生率和严重程度, 严重者可能导致肝坏死甚至肝功能衰竭而死亡[1], 成为阻碍结核病防治工作的一大难题。因此,寻找不影响抗结核药物疗效的保肝治疗具有重要的临床意义。
目前的研究表明,氧化应激是异烟肼和利福平联用致肝损伤的机制之一[2]。增强细胞的抗氧化防御系统,能抵抗许多药物或化学物质的氧化性损伤。还原性谷胱甘肽(reduced glutathione,GSH)能将过氧化脂质和过氧化氢转变为无毒的水和醇,是对抗氧化应激的重要物质。N-乙酰半胱氨酸(N-acetylCysteine,NAC)能增加细胞内GSH的含量和活性,对铅[3]、全氟异丁烯[4]、局部缺血再灌注[5]等所致的氧化性损伤均有一定的保护作用。本研究探讨了NAC对异烟肼、利福平联用所致肝损伤的保护作用及其可能的机制。
1 材料与方法 1.1 实验材料 1.1.1 实验动物雌性健康昆明小鼠32只,3-4周龄,平均体重为(20±2) g,由华中科技大学同济医学院实验动物学部提供。
1.1.2 实验药物和试剂异烟肼注射液(天津金耀氨基酸有限公司,药品批号:1305211),注射用利福平(重庆华邦制药股份有限公司,药品批号:20130442)及乙酰半胱氨酸(NAC)注射液(杭州民生药业有限公司,药品批号:1304293)使用时均用0.9 %生理盐水配制成相应浓度。谷氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙二醛(malonaldehyde,MDA)及超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒购自南京建成生物工程研究所。
1.2 实验方法 1.2.1 实验动物分组与模型小鼠随机分为4组(8只/组),腹腔注射不同的药物,每天1次,每只注射量均为每克体重每天(g·5d)0.002 ml,具体分组如下:对照组:腹腔注射0.9%生理盐水;NAC对照组:腹腔注射NAC,0.4 mg/(g·5d);肝损伤组:腹腔注射异烟肼0.1 mg/(g·5d)和利福平0.1 mg/(g·5d);NAC保护组:腹腔注射NAC 0.4 mg/(g·5d),30 min后再行腹腔注射异烟肼0.1 mg/(g·5d)和利福平0.1 mg/(g·5d)。每组连续给药2周。所用药物浓度是根据预实验结果测算得出,确保不会因为用药浓度太高引起肝脏严重损伤、实验鼠死亡,从而导致实验无法继续,同时也不会因为药物浓度太低而无法获得肝细胞受损的动物模型。
1.2.2 血清ALT及AST活性测定全部小鼠末次给药禁食不禁水,16 h后称体重,摘眼球取血,收集血清,按试剂盒介绍的方法,检测血清ALT及AST活性。
1.2.3 肝指数测量及形态学观察处死小鼠,低温下迅速完整取肝,称重,计算肝指数(肝指数=肝重/体重)。取部分肝组织,4%多聚甲醛固定,常规石蜡包埋切片,HE染色,光学显微镜下观察肝组织形态结构。
1.2.4 肝组织SOD活性及MDA含量测定取新鲜肝组织,准确称重,按重量(g):体积(ml)=1 : 9的比例,加入生理盐水,冰水浴条件下充分匀浆,4 ℃离心(2 500 r/min)20 min,取上清液,用硫代巴比妥酸(Thiobarbituric Acid, TBA)法检测其中MDA含量,用WST-1法测量SOD活性,详细检测方法按试剂盒说明操作。
1.3 数据的统计学分析所有的数据均采用SPSS 18.0统计软件进行分析。计量资料均用x±s表示。计量资料采用单因素方差分析和LSD-t检验,以P<0.05为差异有统计学意义。
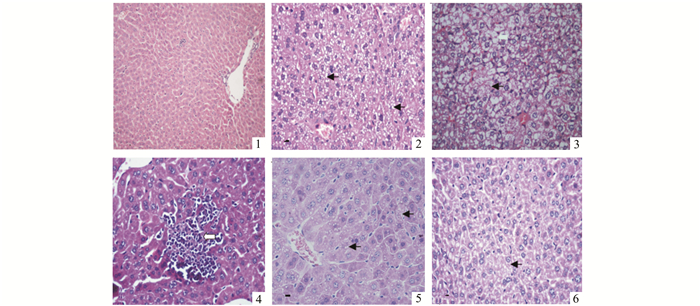
2 结果 2.1 肝组织形态学变化对照组和NAC对照组,鼠肝小叶结构完整,肝细胞形态结构正常,细胞排列规则(图 1);肝损伤组:肝细胞肿胀,细胞排列紊乱,肝细胞呈脂肪变性(图 2)或/和不同程度的水变性(图 3),以及局灶性肝细胞坏死、炎性细胞浸润(图 4);NAC保护组:肝细胞肿胀不明显,大部分肝细胞排列规则,部分细胞呈轻度脂肪变性(图 5)或呈轻度水变性(图 6),未见肝细胞坏死。
|
图 1-6 各组肝组织形态照片 图 1 对照组(HE×100);图 2 肝细胞脂肪变性(HE×400);图 3 肝细胞水变性(HE×400);图 4 肝细胞坏死及炎性细胞浸润(HE×400);图 5 轻度脂肪变性(HE×400);图 6 轻度水变性(HE×400) |
对照组与NAC组在肝指数[NAC组:(57.47±0.68) mg/g]、血清酶ALT[NAC组:(36.70±3.00) nmol/mgpro]及AST[NAC组:(82.34±2.96) nmol/mgpro]活性无显著差异。肝损伤组小鼠肝指数、血清ALT及AST活性显著高于对照组(P<0.01);NAC保护组与肝损伤组比较,小鼠肝指数、血清ALT及AST活性明显降低(P<0.01),结果见表 1。
| 表 1 对照组、肝损伤组及NAC保护组中肝指数和血清ALT及AST活性(x±s) |
NAC组与对照组比较, MDA含量(NAC组:0.54±0.14 nmol/mgpro)及SOD活性(NAC组:124.18±4.20 nmol/mgpro)无显著差异。肝损伤组与对照组比较,小鼠MDA含量显著升高(t=32.49,P<0.01),SOD活性显著降低(t=-13.65,P<0.01);NAC保护组与肝损伤组比较,MDA含量明显降低(t=-12.77,P<0.01),SOD活性明显升高(t=7.86,P<0.01),结果见表 2。
| 表 2 对照组与肝损伤组肝组织中MDA含量及SOD活性(x±s) |
肝指数反映肝组织肿胀的严重程度,而ALT和AST活力与肝细胞损伤的严重程度相关。本研究中,肝损伤组及NAC保护组小鼠肝指数、ALT及AST活力均显著高于对照组,提示异烟肼与利福平联用能够引起明显的肝细胞损伤,但NAC保护组小鼠肝指数、ALT及AST活力显著低于肝损伤组,表明NAC对异烟肼与利福平联用所致肝损害具有一定的保护作用,这与Attri[6]及Singh[7]等的研究结果一致,他们在体外细胞实验中发现,NAC能够对抗抗结核药物所致的肝损害。
丙二醛(MDA)为脂质过氧化产物;超氧化物歧化酶(SOD)是防御超氧负离子损害的重要酶;两者在机体氧化和抗氧化平衡中起着重要的作用。MDA含量的高低间接反映了细胞脂质过氧化的严重程度[8],而SOD活力的高低反映了细胞清除自由基能力的大小。本次结果显示损伤组肝匀浆MDA含量增高,SOD活性降低,说明异烟肼、利福平两者联用引起细胞脂质过氧化增强,细胞清除自由基的能力下降,细胞氧化与抗氧化系统失衡。预用N-乙酰半胱氨酸的保护组与相应损伤组比较肝匀浆MDA含量降低,SOD活性增高,说明N-乙酰半胱氨酸护肝机制与减轻细胞脂质过氧化程度、提高SOD活性、增强机体清除自由基的能力等有关。这一结果与Attri[6]及Rana[9]等的报告一致。
正常情况下,大多数体内产生的自由基由GSH消耗,如果GSH消耗过多或者产生不足就会导致组织的脂质过氧化损伤[10]。而NAC作为GSH的前体物质,可以使机体内GSH合成酶含量增加, 并可在细胞内脱乙酰化生成半胱氨酸,提供体内GSH生物合成的必需氨基酸,增加细胞内GSH的含量和活性;此外,NAC可以直接与氧自由基发生非酶促反应[11]。NAC还具有显著的抗炎功能,可以抑制炎性细胞因子的产生释放,减轻机体的炎性损伤[12],从而保护肝细胞。本实验中,与肝损伤组相比,NAC保护组小鼠SOD含量增加,很好的验证了这一理论。
综上所述,异烟肼与利福平联合应用能引起小鼠较严重的肝损伤,N-乙酰半胱氨酸能够减轻这种损伤作用,其保护机制可能与增加机体谷胱甘肽(GSH)含量,从而减轻脂质过氧化反应有关。本研究为NAC在临床上用于预防抗结核药引起的肝损伤提供了进一步的理论依据。
| [1] | 夏愔愔, 詹思延. 国内抗结核药物不良反应发生率的综合分析[J]. 中华结核和呼吸杂志, 2007, 30(6): 419-423. |
| [2] | Sodhi CP, Rana SV, Mehta SK, et al. Study of oxidative-stress in isoniazid-rifampicin induced hepatic injury in young rats[J]. Drug Chem Toxicol, 1997, 20(3): 255-269. DOI: 10.3109/01480549709003881. |
| [3] | Flora SJ, Pande M, Kannan GM, et al. Lead induced oxidative stress and its recovery following co-administration of melatonin or N-acetylcysteine during chelation with succimer in male rats[J]. Cell Mol Biol (Noisy-le-grand), 2004, 50 Online Pub: OL543-551. |
| [4] | Lailey AF. Oral N-acetylcysteine protects against perfluoroisobutene toxicity in rats[J]. Hum Exp Toxicol, 1997, 16(4): 212-216. DOI: 10.1177/096032719701600410. |
| [5] | Lee EJ, Silva SM, Simões Mde J, et al. Effect of N-acetylcysteine in liver ischemia-reperfusion injury after 30% hepatectomy in mice[J]. Acta Cir Bras, 2012, 27(4): 346-348. DOI: 10.1590/S0102-86502012000400011. |
| [6] | Attri S, Rana SV, Vaiphie K, et al. Protective effect of N-acetylcysteine in isoniazid induced hepatic injury in growing rats[J]. Indian J Exp Biol, 2001, 39(5): 436-440. |
| [7] | Singh M, Sasi P, Gupta VH, et al. Protective effect of curcumin, silymarin and N-acetylcysteine on antitubercular drug-induced hepatotoxicity assessed in an in vitro model[J]. Hum Exp Toxicol, 2012, 31(8): 788-797. DOI: 10.1177/0960327111433901. |
| [8] | Romero FJ, Bosch-Morell F, Romero MJ, et al. Lipid peroxidation products and antioxidants in human disease[J]. Environ Health Perspect, 1998, 106(Suppl 5): 1229-1234. DOI: 10.1289/ehp.98106s51229. |
| [9] | Rana SV, Attri S, Vaiphei K, et al. Role of N-acetylcysteine in rifampicin-induced hepatic injury of young rats[J]. World J Gastroenterol, 2006, 12(2): 287-291. DOI: 10.3748/wjg.v12.i2.287. |
| [10] | Bonanomi L, Gazzaniga A. Toxicological, pharmacokinetic and metabolic studies on acetylcysteine[J]. Eur J Respir Dis, 1980, 111: 45-51. |
| [11] | 毕筱刚, 李建国, 周凤丽, 等. N-乙酰半胱氨酸对缓解期肺心病的抗氧化和免疫调节作用[J]. 中国临床药学杂志, 2001, 10(5): 275-276. |
| [12] | Njalsson R, Norgren S. Physiological and pathological aspects of GSH metabolism[J]. Acta Paediatr, 2005, 94(2): 132-137. DOI: 10.1080/08035250410025285. |
 2016, Vol. 37
2016, Vol. 37
