冠心病是目前最主要的威胁人类健康的慢性疾病之一。虽然冠脉介入治疗和搭桥手术的普遍应用使很大部分冠心病病人受益,但仍有部分病患由于各种原因不适宜相关手术的开展或术后形成冠脉再狭窄,从而使冠心病病死率仍然居高不下[1]。对于这些病患,促进冠心病心肌缺血部位的血管生成将成为其主要的治疗措施。目前针对心肌缺血诱导的血管生成的机制并未阐述明了,同时慢性心肌缺血的模型多集中于大型动物如小型猪和犬类[2, 3]。随着转基因技术的发展,越来越多的研究开始倾向于小鼠作为转基因动物模型。而国内基于小鼠模型的心肌缺血血管生成研究却很少,在本次研究中,我们建立了一种改良的基于小鼠的慢性心肌缺血诱导血管生成模型,并探讨其血管生成的作用机制。
1 材料与方法 1.1 主要材料和试剂 1.1.1 实验动物6-8周C57BL/6雄性小鼠,18-22 g,清洁级,购自武汉大学实验动物中心。
1.1.2 主要试剂戊巴比妥钠(商品名:Sodium pentobarbital,分子式:C11H17N2NaO5,德国,批号:K2208);血小板-内皮细胞黏附分子(CD31)、α-平滑肌肌动蛋白(α-SMA)、血管性假血友病因子(vWF)抗体购自Abcam公司;GAPDH抗体购自Cell signaling technology公司;血管内皮生长因子(VEGF)抗体、IgG-HRP二抗购自Santa Cruz Biotechnology公司;ECL化学发光超敏显色试剂盒购自武汉博士德生物公司,FITC标记羊抗兔IgG二抗,Cy3标记羊抗兔IgG二抗,4,6-二脒基-2-苯基吲哚(DAPI)购自谷歌生物公司。
1.1.3 主要仪器尼康正置显微镜(Eclipse Ci-s);VEVO2100型超高分辨率小动物超声实时分子影像系统;小动物呼吸机(Harvard Apparatus);VELOCITY 14R冷冻离心机购自澳大利亚Dynamica公司;Powerlab数据采集分析系统购自澳大利亚ADInstruments公司。
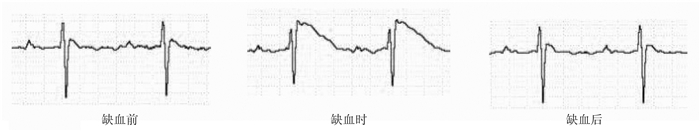
1.2 慢性心肌缺血手术模型的建立将50只C57BL/6小鼠随机分为假手术组和模型组,每组25只。小鼠行腹腔注射戊巴比妥钠(80 mg/kg)麻醉后,给予气管插管,胸前常规备皮消毒,于胸骨左缘2、3肋之间做横行切口暴露心脏,寻找冠状动脉前降支。在左心耳下缘用7-0丝线缝针,出针后缝线的两端穿入一个直径约为1 mm的橡皮圈,再将缝线的两头从肋间肌穿出,打结后留置并固定于皮下。5-0丝线缝合皮肤,待小鼠恢复自主呼吸后拔除气管插管。进行缺血处理时,打开皮肤缝线线结,用镊子牵拉出留置于皮下的缝线,拉紧缝线时小鼠心电图出现缺血性改变(Ⅰ导联ST段抬高),形成暂时性缺血(图 1)。从埋植缝线后第3天开始进行缺血处理,模型组小鼠给予5 min/次,3次/d,共7 d的慢性缺血处理,假手术组小鼠则只暴露缝线但不拉紧,作为对照。此外,我们也重复了Kory文献[4]中的缺血模型,Kory组的手术方法与模型组相同,缺血方案为:隔天一次,每次缺血15 min,共3次,借此比较模型组与Kory组引起血管生成机制的不同。
|
图 1 心肌缺血造模成功的心电图评判标准 |
将假手术组和模型组小鼠分别于术前和术后清醒状态下取胸骨旁短轴观切面,M型超声模式下记录左室收缩期内径和舒张期内径(LV dimensions at diastole/systole,LVDd/LVDs),计算射血分数(ejection fraction,EF),缩短分数(fractional shortening,FS)。
1.4 HE染色术后取心脏用4%多聚甲醛固定,经常规脱水,透明,石蜡包埋,切片(厚度4 μm),苏木素-伊红染色后,在显微镜下观察心肌组织的缺血情况。
1.5 免疫组化、免疫荧光取心肌组织进行vWF免疫组化染色,CD31、α-SMA免疫荧光染色,并用Image Pro Plus 6.0软件进行分析,分别测量左室缺血组织中CD31、α-SMA、vWF阳性染色的血管数目。在低倍镜下(×100) 寻找血管染色丰富的热点区,再在高倍镜下(×200) 随机观察5个视野,取平均值,得到每高倍镜视野下的血管数或微血管密度。
1.6 Western Blot取液氮冻存的左心室心肌组织,加入RIPA裂解液后均匀研磨裂解。再用BCA蛋白浓度测定试剂盒测定各组总蛋白浓度,加入5×上样缓冲液后100 ℃变性10 min。取50 μg蛋白行聚丙烯酰胺凝胶电泳SDS-PAGE(分离胶浓度为10%,浓缩胶浓度为5%)、转膜(200 mA,90 min)、封闭(5%脱脂奶粉室温下1-2 h)、洗膜(TBST 3×10 min)、孵育一抗(4 ℃过夜)、洗膜(TBST 3×10 min)、孵育二抗(室温下1 h)、洗膜(TBST 3×10 min)。使用化学发光试剂盒显色,Image J软件定量分析蛋白表达。
1.7 统计学处理所有计量资料均以均数±标准差的形式表示,数据结果用GraphPad 5.0软件进行分析。两组间比较采用独立t检验,多组间比较采用多因素方差分析,P < 0.05表示组间有统计学差异。
2 结果 2.1 小鼠心功能检查无论是假手术组还是模型组,小鼠术后的射血分数(EF)和缩短分数(FS)较术前并无明显下降(P>0.05,无统计学差异),提示该手术并未影响小鼠心脏的收缩功能,没有引起大面积的心肌坏死和结构改变(表 1)。
| 表 1 各组小鼠心超评价的心功能变化 |
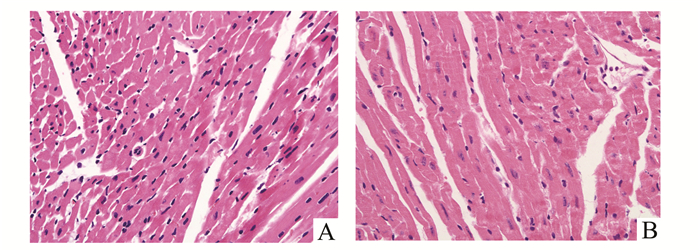
常规HE染色显示:显微镜下假手术组小鼠心肌组织排列整齐,胞质染色均匀,横纹清晰,细胞核呈圆形或椭圆形(图 2A)。而模型组小鼠心肌组织排列紊乱,横纹显示不清,心肌细胞出现水肿,可见细胞核固缩和核溶解现象,但未见大片组织坏死区域(图 2B),说明模型组小鼠心肌处于缺血状态。
|
图 2 小鼠心肌组织病理学检测(HE ×200) A:假手术组;B:模型组 |
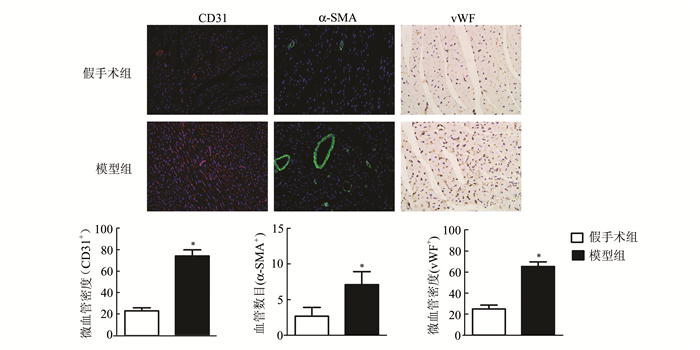
免疫荧光检测显示(图 3),与假手术组相比,模型组小鼠的CD31+新生微血管和α-SMA+中小血管数量均有明显增加(P < 0.05)。免疫组化进一步验证显示,与假手术组相比,模型组小鼠vWF+微血管密度也有明显增加(P < 0.05)。说明该手术模型能显著增加心肌组织的微血管和小血管的血管新生。
|
图 3 血管新生指标的免疫荧光和免疫组化检测(×200) |
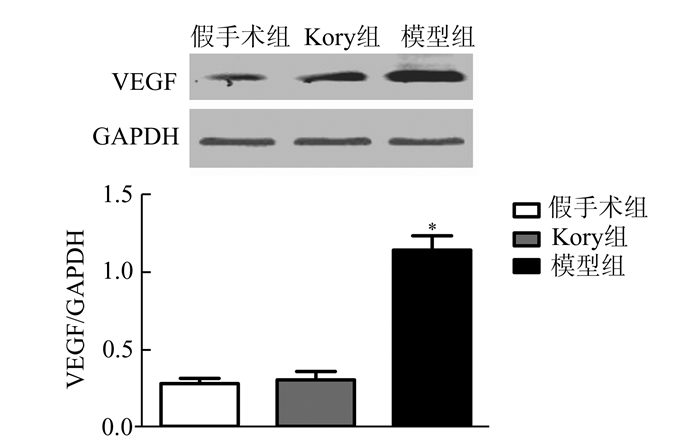
我们采用了有文献报道的Kory[4]等的冠脉血管生成模型和改良后的模型分别进行造模。经蛋白质免疫印迹试验发现(图 4),采用Kory等的缺血方案进行造模(隔天一次,每次缺血15 min,共3次),心肌组织中VEGF的表达并未有明显增高(P > 0.05),但是经改良后的模型组小鼠心肌组织中的VEGF蛋白表达显著高于假手术组小鼠(P < 0.05)。通过改良缺血时间和缺血频率,不仅成功诱导了血管生成,同时VEGF表达含量也增高,这表明该慢性缺血模型可能是通过提高VEGF含量来促进血管生成的。与Kory的模型相比,这更符合其他大型动物慢性缺血模型状况以及临床慢性心肌缺血的病理状态。
|
图 4 Western Blot检测VEGF蛋白表达水平 |
冠心病患者由于冠状动脉阻塞或狭窄导致心肌缺血,冠脉储备下降,从而引起患者出现心绞痛。而这其中一部分病人由于长期的慢性缺血,出现了新生血管,代偿性地形成了冠脉侧枝循环,从而部分程度的改善了患者的自觉症状和心脏功能[5]。治疗性的冠脉血管新生将成为未来治疗冠心病的重要靶点[6],但心肌缺血后血管新生的机制尚未明确。小鼠,由于其繁殖能力强,也便于进行转基因方面的研究,是国内外进行基础实验研究最常用的动物模型。因此我们建立了一种慢性心肌缺血诱导血管生成的小鼠模型,以期为未来研究者对冠脉血管新生机制的探讨提供基础。
目前,在慢性心肌缺血引起血管新生的动物实验研究中比较成熟的是以犬类和小型猪为模式动物,通过体内埋植冠状动脉缩窄环模拟冠状动脉渐进性狭窄,引起慢性心肌缺血[2, 3]。此种动物模型能够较好地模拟临床冠心病病人慢性缺血的状态,但是该手术方法仅适用于犬、小型猪等大型动物,尚未有小型动物采用此方法。现有的小型动物的慢性缺血模型大多是通过股动脉缩窄术对肢体缺血进行研究。而基于心肌缺血模型的研究大多数只停留在对急性心梗后心梗周边缺血区的探讨。在本文中,我们借鉴的是缺血-再灌注模型中常用的手术方法[7]在冠状动脉下留置缝线,但不结扎血管。之后每天间隔一段时间拉紧缝线,造成重复、短暂的心肌缺血来模拟慢性心肌缺血的过程。此种手术方法操作简便,小鼠的存活率高,不引起心肌梗塞和心脏功能的下降,既能较好地反映慢性缺血过程,也便于进行转基因研究和大样本实验。
血管内皮生长因子(VEGF)是缺血缺氧诱导血管再生中最重要的调控因子。在心肌缺血诱导的冠脉侧枝循环形成中,VEGF通过增强内皮黏附功能、促进单核细胞的迁移、骨髓动员、促进一氧化氮合酶的生成等[8-10]发挥着重要的促血管生成作用。抑制内源性的VEGF的合成则会严重影响冠脉侧枝循环的形成[11]。介于VEGF在血管再生中的重要地位,我们检测了造模后VEGF的蛋白表达水平以验证此模型是否能用于缺血诱导的血管新生研究。实验结果表明,该模型诱导的血管新生发生的同时,VEGF蛋白表达的含量也明显增加。然而与我们得到的结论不同的是,目前仅有的关于小鼠慢性缺血诱导冠脉血管生成模型的研究中,Kory等[4]认为VEGF并不参与心肌缺血诱导的血管生成的过程。二者的不一致可能与模型的建立方法有关。Kory等的研究中采用的缺血方案是隔天1次,每次15 min,共计3次。而本实验则是每天3次,每次5 min,持续7天。通过改良缺血时间和缺血频率使心肌更不容易发生坏死,同时也更贴近临床慢性心肌缺血的病理过程。
血管生成包括微血管的新生和肌性小动脉的形成。对于小型动物的血管生成的评价,多采用免疫组化的方法进行血管标志物的检测。在本实验中我们选用了最常用的血管内皮标志物指标CD31和vWF评价微血管密度,α-SMA指标来评价肌性血管的数量。3项指标综合评判,使得到的结果能更可靠地反映心肌血管生成的情况。
| [1] | Mozaffarian D, Benjamin EJ, Go AS, et al. Executive summary heart disease and stroke statistics 2016 update: A report from the American heart association[J]. Circulation, 2016, 133(4): 447-454. DOI: 10.1161/CIR.0000000000000366. |
| [2] | Kellar RS, Williams SK, Naughton GK, et al. Three-dimensional fibroblast cultures stimulate improved ventricular performance in chronically ischemic canine hearts[J]. Tissue Eng Part A, 2011, 17(17-18): 2177-2186. DOI: 10.1089/ten.tea.2010.0680. |
| [3] | Liu CB, Huang H, Sun P, et al. Human umbilical cord-derived mesenchymal stromal cells improve left ventricular function, perfusion, and remodeling in a porcine model of chronic myocardial ischemia[J]. Stem Cells Transl Med, 2016, 5(8): 1004-1013. DOI: 10.5966/sctm.2015-0298. |
| [4] | Kory JL, Kovacs A, Weinheimer C, et al. Repetitive myocardial ischemia promotes coronary growth in the adult mammalian heart[J]. Heart Assoc, 2013, 2(5): 343-360. DOI: 10.1161/JAHA.113.000343. |
| [5] | Kory JL, Kovacs A, Weinheimer C, et al. Repetitive myocardial ischemia promotes coronary growth in the adult mammalian heart[J]. J Am Heart Assoc, 2013, 2(5): 343-360. DOI: 10.1161/JAHA.113.000343. |
| [6] |
张少言, 林赟霄, 陈浩, 等. 血管新生与冠心病治疗性血管生成[J].
心血管病学进展, 2014, 35(1): 55-59.
Zhang SY, Lin YX, Chen H. Angiogenesis and therapeutic angiogenesis of coronary heart disease[J]. Advances in Cardiovascular Diseases, 2014, 35(1): 55-59. |
| [7] | Kim SC, Boehm O, Meyer R, et al. A murine closed-chest model of myocardial ischemia and reperfusion[J]. J Vis Exp, 2012, 65: 3896-3992. |
| [8] | Heil M, Clauss M, Suzuki K, et al. Vascular endothelial growth factor (VEGF) stimulates monocyte migration through endothelial monolayers via increased integrin expression[J]. Eur J Cell Biol, 2000, 79(11): 850-857. DOI: 10.1078/0171-9335-00113. |
| [9] | Tian XY, Pu WT, Zhou B. Cellular origin and developmental program of coronary angiogenesis[J]. Circ Res, 2015, 116(3): 515-530. DOI: 10.1161/CIRCRESAHA.116.305097. |
| [10] | Gaffney MM, Hynes SO, Barry F, et al. Cardiovascular gene therapy: current status and therapeutic potential[J]. British Journal of Pharmacology, 2007, 152(2): 175-188. DOI: 10.1038/sj.bjp.0707315. |
| [11] | Toyota E, Warltier DC, Brock T, et al. Vascular endothelial growth factor is required for coronary collateral growth in the rat[J]. Circulation, 2005, 112(14): 2108-2113. DOI: 10.1161/CIRCULATIONAHA.104.526954. |
 2017, Vol. 38
2017, Vol. 38

