第5颈椎神经根麻痹(C5 nerve root palsy, C5 NRP)是指临床上在颈椎病前后路减压手术后出现的C5神经根支配区感觉运动功能障碍的一组临床症状和体征,主要以C5神经根支配区皮节感觉麻木,一侧或双侧的三角肌和或肱二头肌无力为特征。约半数此类患者出现颈肩部麻木疼痛不适而术后无法缓解, 而另外半数患者仅出现C5神经根支配区肌力下降; 绝大多数患者出现单侧麻痹, 而仅5%-7%的患者出现两侧肌力下降。C5 NRP多在术后1周以内发生, 较少于术后半月到1个月内发生。随着我国国民经济高速发展及人口老龄化,多节段颈椎疾患者日益增多,据国内外文献统计,根据颈椎病减压入路及内固定类型的不同,术后C5 NRP出现概率介于0-25%[1]。但当前学术界对C5神经根麻痹的发病机制还知之甚少,部分研究结果出现争议,这无疑将极大增加临床工作对其诊断、预防及康复治疗措施实施的难度[2]。
我科于2011年3月至2014年6月, 对107例颈椎病多节段脊髓受压患者采取了颈前后路减压及内固定融合术,在广泛参考国内外有关临床研究成果的基础上,借鉴预防性C5椎间孔切开等手术技巧,有效降低了术后C5 NRP的发生率。为临床上降低颈椎病术后C5 NRP发生率,有效提高颈椎病颈后路单开门椎管扩大成形术后近远期疗效做了新的探索,期望为临床上深入阐明C5 NRP的发病机制及预防提供有益线索。现对该外科治疗效果进行了回顾分析。
1 资料与方法 1.1 一般资料回顾我科2011年3月至2014年6月收治的多节段颈椎病患者共107例,男65例,女42例; 年龄45-67岁,平均60岁(见表 1)。所有患者术前均行MRI及CT检查,脊髓受累节段均≥3,疾病种类:退变性脊髓型颈椎病64例,颈椎后纵韧带骨化(OPLL)32例,发育性颈椎管狭窄症11例。手术方式:颈前路多节段椎体次全切除术并前路内固定融合32例,颈椎多节段椎板切除并后路融合术28例,颈椎后路椎板成形术47例。
| 表 1 不同术式发生C5 NRP的相关临床资料 |
手术患者均采用全身麻醉,前后路手术分别取仰卧或俯卧位。手术操作简述如下:颈前路多节段椎体次全切除术, 在确定手术节段后,取对应节段右颈前横切口,逐层切开皮肤及各层软组织及颈阔肌,由颈血管鞘-颈内脏鞘之筋膜间隙抵达椎前筋膜,显露手术节段,直视下切除病变间盘,磨钻做责任椎体次全切后,置钛网人工椎体及前路钢板螺钉内固定。颈椎后路多节段椎管成型术,颈部稍前屈,颈后正中入路,沿椎旁肌肌间隙分离,椎板骨膜下剥离显露出C3-C7椎板后部,处理C2/3、C7/T1椎板间韧带连接。门轴侧椎板根部外侧皮质骨切断,保留内侧皮质; 开门侧在椎板根部全程切断,适当去除C3-C7棘突保留棘突根部,椎板旋转于适当角度,置centerpiece支撑钢板固定开门侧结构,术中尽可能修复头颊肌及半棘肌在C2棘突上的止点。全部术后患者佩戴硬质颈围6周后开始颈部功能锻炼。
1.3 术后处理所有患者术后卧床予心电监护48-36 h,术后48 h引流量 < 10 ml时拔除引流管。给予抗生素、皮质类固醇类药物及脱水剂3-5 d。术后3 d在硬质颈托保护下坐起或离床活动,颈托保护6-8周。发生C5 NRP的患者术后予脱水、神经营养、非甾体类抗炎药及适当应用糖皮质激素,辅助物理治疗及适当功能锻炼。
1.4 术后评定指标① 日本骨科协会(Japanese Orthopaedic Association Scores,JOA)综合评分:采用JOA颈椎评分17分法[3],用于评价受累颈段脊髓及神经根临床表现,包括对四肢感觉运动的神经症状、体征和膀胱功能的全面评估。②术后C5 NRP诊断标准[4]:术前颈椎MRI T2相C4-C5节段脊髓高信号患者除外,术后6周内新发三角肌或肱二头肌肌力≤3级或肌力与术前相比降低1级以上,伴或不伴C5皮节支配区感觉障碍、疼痛。
1.5 统计学处理所有采集的计量数据均为平均数±标准差(x±s)表示,2组间均数比较采用t检验; 计数资料用率(%)表示,组间比较采用χ2检验。结果分析采用SPSS 10.0统计学软件进行处理,P < 0.05认为差异有统计学意义。
2 结果颈椎退变和后纵韧带骨化患者占所有患者的绝大多数,而且男性患者明显多余女性,代表性颈椎手术影像学表现见图 1, 所有颈前后路手术术后发生C5 NRP情况见表 1,总发生率为11.2%,平均减压节段为4.0±0.5。12例患者发生C5 NRP时点分别为手术后3 d 3例、5 d 2例、7 d 2例、10 d 1例、术后2周后4例。按发生侧别分别为单侧9例,双侧3例。在C5 NRP患者群体中,间盘变性突出及受压脊髓信号改变为主要影像学特征,这点与非C5 NRP患者术前影像学表现相似。发生C5 NRP的12例患者在不同术式中的分布情况(见表 1):颈前路多节段椎体次全切除加融合术2/32例(6.2%),颈后路多节段椎板成形术6/47例(12.7%),颈后路多节段椎板切除加融合术4/28(14.3%),C5神经根麻痹后路手术的发生率明显高于前路手术,且以单侧为主,差异均有统计学意义(P<0.05)。而术后C5 NRP发生与否与术前的颈椎影像学异常的关联性没有统计学差异(见表 2)。
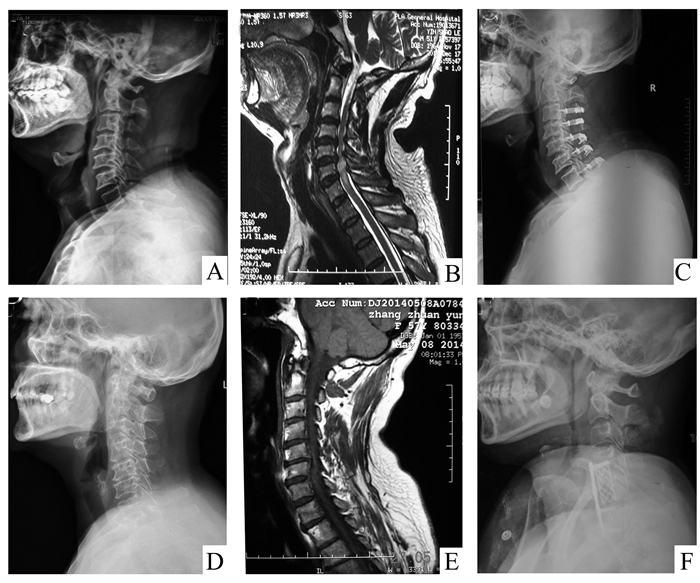
|
图 1 患者手术前后代表性颈椎影像学表现 患者1:多节段颈间盘突出伴相应节段黄韧带增厚致脊髓前后受压(颈3/4,4/5, 5/6),C4-C6部分脊髓信号改变,予后路椎管扩大成形术及centerpiece内固定(图A/B:术前颈椎X线/MRI; 图C:术后1周颈椎侧位X线); 患者2:多节段颈间盘突出(颈4/5, 5/6, 6/7)致颈段脊髓前方受压,并予前路责任椎体次全切并钛网人工骨椎体重建加前路钢板内固定术(图D/E:术前颈椎X线/MRI; 图F:术后1周颈椎侧位X线)。所有患者术前MRI(图B/E)均可见致压水平脊髓组织变性信号 |
| 表 2 C5 NRP发生与术前颈椎影像学表现[n(%)] |
所有12例C5 NRP患者获得随访时长为9-36个月,平均23.6月。术后C5 NRP患者症状获得改善的时间为2-32周,平均9.7周。患者术前JOA评分平均7.6±1.9,术后出现不同程度减退(6.1±1.5);患者术前肌力平均3.7级(2-5级),术后C5 NRP者肌力平均2.9级(1-4级),末次随访平均为4.0级(2-5级),见表 3。末次随访的JOA评分改善率,受累三角肌肌力改善,所有12例患者中9例获得完全缓解。1例三角肌肌力减退(术前4级,复查时为3级),2例残留上臂部皮肤感觉减退,2例均为后路椎板切除术组。差异有统计学意义(P<0.05)。
| 表 3 C5 NRP患者术前术后神经功能改善评分 |
颈椎病术后C5 NRP是节段性颈椎前后路或联合入路减压术后较常见的并发症之一,近年来国内外临床研究围绕其病因学,发生风险及预防做了大量探讨。本回顾性研究患者平均年龄为60岁,男性患者C5 NRP发生风险明显高于女性,后路椎板减压或同时合并融合手术的术后C5 NRP发生风险也高于前路手术,这些发现与部分国外学者的报道基本一致[5]。但目前的各类各级临床队列研究对C5 NRP发病机制还缺乏详细准确的病因学证据和解释,因此学术界对C5 NRP发生发展变化的机制和规律还存在很大争议。
3.1 C5神经根麻痹的致病机制传统观点认为:由于颈椎骨性结构减压后,椎管前后径增加,使得脊髓组织发生前后方向的位移,而C5段脊髓恰位于颈段脊髓生理曲度的顶点位置,使得此段脊髓组织在减压后发生前后位移的绝对距离最为显著,如果合并术前C5神经根栓系因素,例如C5椎间孔狭窄,神经根移动度受累,则会导致C5段脊髓和神经根在减压后张力骤增,引发一系列C5 NRP的临床表现[6]。
新近的回顾性研究表明,颈椎前后路减压术后C5 NRP的发病率不同,后路减压C5 NRP的发生率在各类临床研究报道中介于1.7%-25%之间,而前路减压的C5 NRP发生率为0-12%。有学者整理统计后发现两者的C5 NRP平均发生率分别为(6.35±5.39)%和(4.98±3.80)%,两种入路的C5 NRP发生率相对病种构成并无统计学差异。但目前绝大多数研究都支持颈后入路的C5 NRP显著高于前路的观点,一项回顾性观察的比较结果显示后路与前路术后C5 NRP发生率分别为8.6% vs 1.6%,两者差异有统计学极显著意义(P < 0.001)[7];而前路手术随着椎体减压节段的增加,C5 NRP的发生率也随之增加。目前较为统一的意见认为颈椎单纯后路减压与减压后辅助内植物节段固定术相比,后者C5 NRP发生率显著高于前者; 而在所有前后路手术方式中,后路减压加融合技术的C5 NRP发生率较高,前路手术发生率较低; 在一组大病例的回顾性研究中,前路手术的C5 NRP发生率为2.2%[8]。
当前有关临床研究比较统一的意见是:C5 NRP发生的基本机制源于颈段脊椎前后路减压导致的“弓弦效应”引发C5神经根及该段脊髓组织有害张力增加,造成脊髓和或神经根受累。近年的大样本病例回顾性Meta分析进一步分析认为颈椎前后路手术继发的C5神经根麻痹源于C5神经根损伤或节段性脊髓损伤,将有关病理机制进一步归纳为以下3个方面:①术中C5神经根意外损伤; ②减压手术后继发脊髓位移引发的C5神经根牵拉损伤; ③术中出现的节段性脊髓损伤,如减压后原发受压脊髓组织出现缺血再灌注损伤,以及节段性脊髓根动脉受压或过度牵拉后导致的节段性脊髓缺血缺氧。
而我们本次的回顾性研究发现:C5 NRP发生与否与术前的颈椎影像学异常的关联性没有统计学差异,而与减压及融合方式有关,术后C5 NRP以单侧为主,颈后路多节段椎板成形及椎板切除加减压术后的C5 NRP发生率分别为13.6%及14.2%, 相对于颈前路椎体次全切及融合手术的C5 NRP发生率(6.7%),差异有统计学显著性意义(P < 0.05)。这充分说明颈椎后路手术通过直接椎管成型或减压,予受累节段脊髓组织的位移与神经根牵拉提供了更为充分的物理空间,构成其相对于前路手术导致C5 NRP发生风险增高的重要解剖学基础。
3.2 C5神经根麻痹的风险因素与预防由于C5神经根麻痹所引发的受累神经组织根性痛,单侧或双侧三角肌麻痹无力等并发症严重影响手术效果和患者生活质量,大量临床研究基于各种术前术中及术后颈椎影像学的观察比较,初步认为以下影像学指征对术后C5 NRP发生的几率有提示意义[9]:①颈椎椎管前后径及椎间孔径每增加1 mm,术后C5 NRP的发生率将分别随之降低69%和98%;而脊髓椎板夹角每增加1度,C5 NRP的风险将增加43%。②如果合并术前C4-C5椎间孔狭窄,术中减压范围过宽或不对称将会显著增加C5 NRP风险。③后路减压时对术前狭窄的C5椎间孔预防性扩大,这点对术前就存在C5神经根受压的病例尤为关键。在我们的研究中,对比C5 NRP发生组与对照组术前影像学资料,未见两组患者各影像学异常因素的构成比有统计学显著性差异,这一结果的原因可能与术中手术操作影响术后C5 NRP的发生有关。例如:在我们的临床实践中,颈后路减压范围保持基本对称,减压宽度控制在两侧椎间小关节内侧壁,宽度绝对值不超过15 mm,这也在一定程度上有效地降低了术后C5神经根麻痹的风险。值得一提的是,有其他研究认为在颈椎疾患的病因差异性方面,后纵韧带骨化后路单开门减压术后的C5 CRP发生率显著高于其他颈椎病类型。可见,术后C5 NRP发生风险不仅与术前椎管受累的各种类型有关,而且手术操作中的某些预防性操作会直接改善术后相关并发症的发生风险。国内也有学者观察到,相对于术前的影像学表现的差异,后路单开门手术的开门角度、脊髓后移距离及术后颈椎曲度指数(CCI)与C5 NRP的发生关系更密切。
尽管如此,在C5 NRP预防措施实施方面,临床相关研究结果仍然存在不少争议。有学者认为:如果存在术前C4-C5段椎间孔狭窄,则推荐在术中行C4-C5节段椎间孔预防性切开,从而能有效降低术后C5神经根麻痹的发生风险。此外,更进一步的研究发现颈椎减压后内固定融合的病例C5 NRP发生率显著高于减压非融合病例,而且提出术中对原有的颈椎后凸畸形不应过度矫正,适当的恢复颈椎生理前屈能有效减少减压后C5段脊髓组织的位移距离,此种手术技巧也能有效减少C5神经根麻痹发生风险[10]。另外,有报道认为颈段后路椎板减压过程中神经根医源性损伤的发生率为1.3%,因此有学者推荐术中实施三头肌或肱二头肌自发及运动诱发电位监测,则能有效减少术中C5段脊髓或神经根的医源性损伤风险。术后C5 NRP的治疗在目前主要通过特异性抗炎等神经营养措施可取得相当疗效,远期疗效尚可。在我们的这组病例中,末次随访发现C5 NRP患者的JOA评分及三角肌肌力均有明显改善,两者的改善率分别为(81.2±12.9)%和(62.1±16.5)%,显然,目前对术后受累三角肌肌力的改善措施还有待进一步提高,这也进一步强调了C5 NRP病因学研究及其预防对临床工作的紧迫性和重要性。
综上所述,我们的研究表明,颈椎多节段受累外科干预手段与手术技巧对术后C5 NRP发生风险关系紧密,在详细周密的术前准备及术中对应预防手段的实施基础上,术后C5 NRP发生风险可获得有效管控。术后并发C5 NRP症状后及时相关处理也能有效提高患者的术后生存质量。由于受限于当前脊柱外科影像学及神经电生理检测技术的局限,而且尚缺乏多中心、大样本的临床循证资料,学术界对C5 NRP发生发展规律及预防干预的相关基础与临床研究还有待进一步深入。
| [1] | Nassr A, Eck JC, Ponnappan RK, et al. The incidence of C5 palsy after multilevel cervical decompression procedures: a review of 750 consecutive cases[J]. Spine (Phila Pa 1976), 2012, 37: 174-178. DOI: 10.1097/BRS.0b013e318219cfe9. |
| [2] | Katsumi K, Yamazaki A, Watanabe K, et al. Can prophylactic bilateral C4/C5 foraminotomy prevent postoperative C5 palsy after open-door laminoplasty: a prospective study[J]. Spine (Phila Pa 1976), 2012, 37: 748-754. DOI: 10.1097/BRS.0b013e3182326957. |
| [3] | Saruhashi Y, Hukuda S, Katsuura A, et al. Clinical outcomes of cervical spinal cord injuries without radiographic evidence of trauma[J]. Spinal Cord, 1998, 36(8): 567-573. DOI: 10.1038/sj.sc.3100595. |
| [4] | Sakaura H, Hosono N, Mukai Y, et al. C5 palsy after decompression surgery for cervical myelopathy: review of the literature[J]. Spine (Phila Pa 1976), 2003, 28(21): 2 447-2 451. DOI: 10.1097/01.BRS.0000090833.96168.3F. |
| [5] | Shou F, Li Z, Wang H, et al. Prevalence of C5 nerve root palsy after cervical decompressive surgery: a meta-analysis[J]. Eur Spine J, 2015, 24(12): 2 724-2 734. DOI: 10.1007/s00586-015-4186-5. |
| [6] | Sasai K, Saito T, Akagi S, et al. Preventing C5 palsy after laminoplasty[J]. Spine (Phila Pa 1976), 2003, 28(17): 1 972-1 977. DOI: 10.1097/01.BRS.0000083237.94535.46. |
| [7] | Basaran R, Kaner T. C5 nerve root palsy following decompression of cervical spine with anterior versus posterior types of procedures in patients with cervical myelopathy[J]. Eur Spine J, 2016, 25(7): 2 050-2 059. DOI: 10.1007/s00586-016-4567-4. |
| [8] | Lim CH, Roh SW, Rhim SC, et al. Clinical analysis of C5 palsy after cervical decompression surgery: relationship between recovery duration and clinical and radiological factors[J]. Eur Spine J, 2017, 26(4): 1 101-1 110. DOI: 10.1007/s00586-016-4664-4. |
| [9] | Lubelski D, Derakhshan A, Nowacki AS, et al. Predicting C5 palsy via the use of preoperative anatomic measurements[J]. Spine J, 2014, 14(9): 1 895-1 901. DOI: 10.1016/j.spinee.2013.10.038. |
| [10] | Liu T, Zou W, Han Y, et al. Correlative study of nerve root palsy and cervical posterior decompression laminectomy and internal fixation[J]. Orthopedics, 2010, 33(8): 558. |
 2018, Vol. 39
2018, Vol. 39

