2. 武汉大学中南医院重症医学科 湖北 武汉 430071
2. Dept. of Intensive Care Unit, Zhongnan Hospital of Wuhan University, Wuhan 430071, China
脓毒症 (sepsis) 的临床致死率超过20%,严重脓毒症5年累积致死率达74%,目前尚无特异的临床诊断和治疗方法[1]。脓毒症的发生原因与感染后炎症因子失控有关。研究发现,早期升高的肿瘤坏死因子α(tumor necrosis factor α,TNFα) 炎症介质启动脓毒症后迅速降低,继之以高迁移率族蛋白B1(high mobility group box-1, HMGB1) 升高并引起TNFα继发性升高,HMGB1被认为是在脓毒症的发病机制中一个更加关键的晚期炎症因子[2],且其高低与脓毒症的死亡率呈正相关。
激活巨噬细胞上的α7胆碱能神经受体 (acetylcholine receptor subunit alpha7,α7nAchR) 在控制全身炎症反应和局部炎症中均有重要作用,这一作用被称为胆碱能抗炎通路 (cholinergic anti-inflammatory pathway,CAP)。miRNAs是一类18-25核苷酸大小的非编码RNA,并不改变基因的转录,而是通过作用于mRNA使蛋白表达改变1.2-4.0倍[3]。我们在前期研究中发现,GTS-21作为特异性α7nAchR激动剂,具有降低血清HMGB1表达的作用,其作用原理与miR-205有关[4]。本研究拟在阐明在激活胆碱能抗炎通路后,miR-205是否在心脑肾组织中也有表达增高,是否也有降低HMGB1的作用。
1 材料与方法 1.1 材料脂多糖 (Lipopolysaccharides, LPS,Sigma),GTS-21(Abcam),TRIzol (Invitrogen)。7300 RT-PCR系统 (Applied Biosystems ABI),cDNA合成试剂盒 (Thermo),引物序列 (Invitrogen),酶联免疫吸附试验试剂盒 (eBioscience, USA)。SPF级5-6周龄BALB/C雄性小鼠 (20-22 g) 购买自武汉大学动物实验中心。
1.2 方法15只BALB/C小鼠 (20-22 g) 被随机分成3组:Sepsis组6只、CAP组6只和对照 (control) 组3只。Sepsis组腹腔注射LPS 15 mg/kg,CAP组腹腔注射LPS 15 mg/kg和GTS-21 4 mg/kg,观察GTS-21激活胆碱能抗炎通路后脓毒症小鼠体内miR205和HMGB1的变化。Control组小鼠采用同样的方法腹腔注射生理盐水。24 h后杀死小鼠取材心、肾、脑组织,放入-80 ℃冰箱的标本用于蛋白质提取,放入TRIzol液中标本用于miR205检测。
从TRIzol中取心肌、肾组织和脑组织,分别提取各组织总RNA,用第一链cDNA合成试剂盒反转录成cDNA。采用7300 RT-PCR系统进行miR205的qRT-PCR。qRT-PCR样品每组各做3例,数据采用2-ΔΔCT方法计算,ΔΔCt=ΔCt-ΔCt NC group,ΔCt=Ct miR-205-CtU6。qRT-PCR引物如表 1。
| 表 1 用于qRT-PCR的引物 |
从冰箱取心肌、肾组织和脑组织,室温解冻后于冰上匀浆器匀浆,应用单去污剂裂解液裂解组织得到总蛋白,采用Bradford法测定提取液的蛋白浓度。取总蛋白50 μg,HMGB1 ELISA试剂盒检测分析。
1.3 统计分析计量资料采用x±s,两组间qRT-PCR检测结果和HMGB1浓度结果比较均采用t检验,进行统计学处理,数据采用Graphpad Prism 6.01 (Graphpad Software; San Diego, CA; USA) 处理。显著性检验的水准为α=0.05。
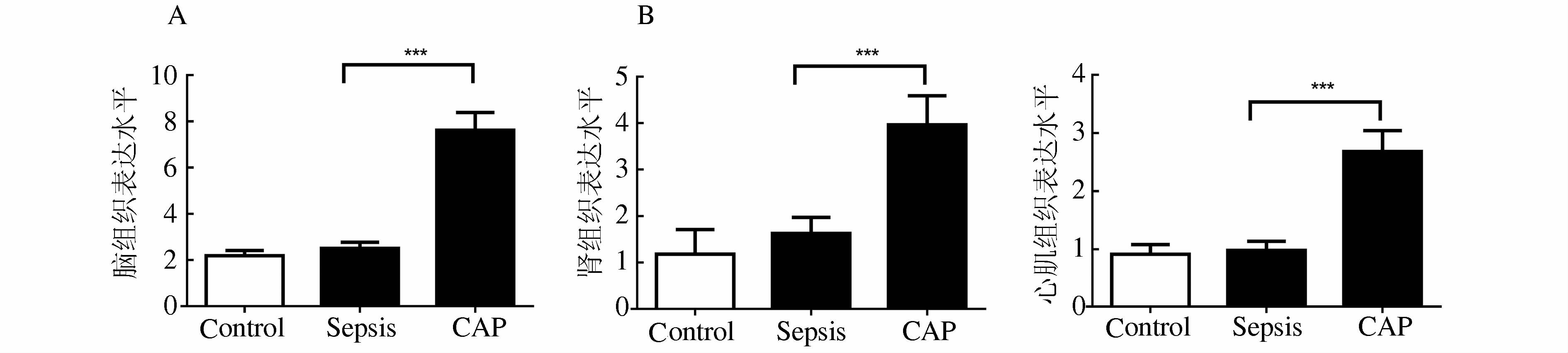
2 结果 2.1 脑、肾、心肌组织中miR-205表达的比较qRT-PCR检测miR-205在BALB/C小鼠Sepsis组、CAP组和Control组脑、心和肾中的表达发现,同种组织中三组表达明显差异,不同组织中miR-205的表达水平也不相同。脑、心、肾组织miR-205表达的qRT-PCR检测结果如表 2。脑组织中miR-205的表达水平,Sepsis组vs CAP组P1<0.001(图 1A)。肾组织中miR-205的表达水平,Sepsis组vs CAP组P3<0.001(图 1B)。心肌组织中miR-205的表达水平,Sepsis组vs CAP组P5<0.001(图 1C)。
| 表 2 组织miR-205表达 |
|
图 1 miR-205在脑、肾、心肌组织中的表达 ***P<0.001 |
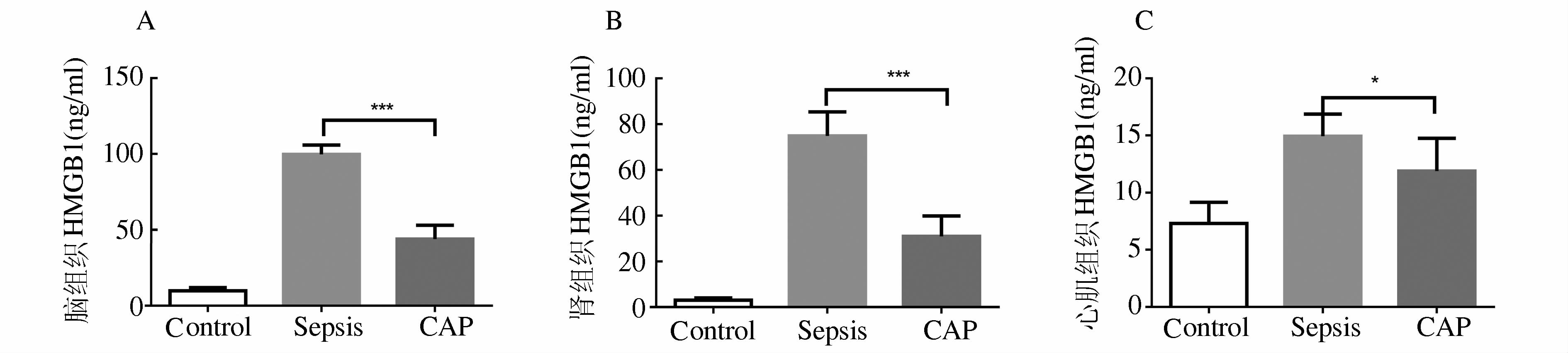
脑、心、肾组织HMGB1表达的检测结果如表 2。脑组织中HMGB1浓度,Sepsis组vs CAP组,P1<0.001(图 2A)。肾组织中HMGB1浓度,Sepsis组vs CAP组,P3<0.001(图 2B)。心肌组织中HMGB1浓度,Sepsis组vs CAP组,P5>0.05(图 2C)。
| 表 2 组织HMGB1表达 |
|
图 2 HMGB1在脑、肾、心肌组织中的表达 *P>0.05,***P<0.001 |
脓毒症是一种临床综合征,发生与感染、创伤等因素有关,当炎症达到一定程度后,诱发全身促炎和抗炎反应紊乱,出现全身炎症因子失控,最终导致免疫功能耗竭、多器官功能衰竭甚至死亡[6]。尽管近些年来重症疾病的治疗水平显著提高,脓毒症依然是ICU最重要的死亡原因。用于诊断的生物标志物有很多,如CRP (C-reactive protein)、PCT (procalcitonin)、sTREM-1 (soluble triggering receptor expressed on myeloid cells 1)、interleukin 6, 以及interleukin 10,但这些检测指标缺乏脓毒症诊断的特异性并不理想[7]。
miRNA是一类非编码的单链RNA片段,长约18-25个核苷酸,通过不完全配对与mRNA结合后调控转录后抑制或mRNA降解,miRNA的变化与疾病的发生和发展密切相关[5]。miRNA的发现为脓毒症的诊断和治疗提供了新的途径。已发现在感染性和非感染性全身炎症反应以及不同严重程度脓毒症的患者中表达有差异的miRNA[8]。
在前期的研究中我们发现激活胆碱能抗炎通路后,miR-205表达升高可以抑制HMGB1-mRNA的翻译,降低HMGB1表达[4]。本研究对脑、心、肾组织中miR-205与HMGB1表达变化的检测发现,miR-205在脓毒症小鼠脑、肾、心组织的表达与对照组相比无明显变化 (表 1,P2、P4、P6>0.05),在激活胆碱能抗炎通路时则明显增高。值得注意的是,在不同组织中miR-205表达变化的幅度并不相同,在脑组织中升高的幅度最大 (图 1A)。已有研究证实激活胆碱能抗炎通路可以降低脑内早期炎症因子TNFα,减轻脑损伤,缓解脓毒症脑病病情发展的脑保护作用[9]。本研究发现,激活胆碱能抗炎通路时,脑组织中miR-205表达升高降低晚期炎症因子HMGB1表达 (图 2A)。这说明胆碱能抗炎通路在脑组织中对早期和晚期炎症因子均有抑制作用,而抑制HMGB1表达是通过miR-205实现调节作用。肾组织中miR-205和HMGB1的表达变化与脑组织一致。
在心肌组织中,CAP组miR-205明显高于Sepsis组 (P5<0.001),但是对HMGB1的调节作用与脑、肾组织相比较弱,Sepsis组与CAP组差异无显著性 (P5>0.05)。与前期研究结果对比发现[4],心肌组织中的HMGB1浓度在Sepsis组和CAP组均与血清中的HMGB1浓度比较接近,这可能与心脏组织血流量大,血流速度快,HMGB1浓度受血流影响较大有关。
与Sepsis组相比,虽然脑、肾、心肌组织中CAP组HMGB1表达有明显下降,但与Control组相比,CAP组HMGB1依然有明显升高。说明miR-205虽然可以显著降低脓毒症时HMGB1表达,但并不能使之降至正常水平 (表 2,P2、P4、P6<0.001),机制有待于进一步研究。
| [1] | Valdes-Ferrer SI, Papoin J, Dancho ME, et al. HMGB1 mediates anemia of inflammation in murine sepsis survivors[J]. Mol Med, 2015, 21(1): 951-958. |
| [2] | Yang L, Xie M, Yang M, et al. PKM2 regulates the Warburg effect and promotes HMGB1 release in sepsis[J]. Nature Communications, 2014, 5: 436. |
| [3] | Wang Z, Liang Y, Tang H, et al. Dexamethasone Down-Regulates the Expression of microRNA-155 in the Livers of Septic Mice[J]. PLoS One, 2013, 8(11): e80547. DOI: 10.1371/journal.pone.0080547. |
| [4] | Zhou W, Wang J, Li Z, et al. MicroRNA-205-5b inhibits HMGB1 expression in LPS-induced sepsis[J]. International Journal of Molecular Medicine, 2016, 38(1): 312-318. |
| [5] | How CK, Hou SK, Shih HC, et al. Expression profile of MicroRNAs in gram-negative bacterial sepsis[J]. Shock, 2015, 43(2): 121-127. DOI: 10.1097/SHK.0000000000000282. |
| [6] | Shankar-Hari M, Lord GM. How might a diagnostic microRNA signature be used to speed up the diagnosis of sepsis[J]. Expert Rev Mol Diagn, 2014, 14(3): 249-251. DOI: 10.1586/14737159.2014.899151. |
| [7] | Wang H, Zhang P, Chen W, et al. Characterization and Identification of Novel Serum MicroRNAs in Sepsis Patients With Different Outcomes[J]. Shock, 2013, 39(6): 480-487. DOI: 10.1097/SHK.0b013e3182940cb8. |
| [8] | Wang J, Yu M, Yu G, et al. Serum miR-146a and miR-223 as potential new biomarkers for sepsis[J]. Biochemical and Biophysical Research Communications, 2010, 394(1): 184-188. DOI: 10.1016/j.bbrc.2010.02.145. |
| [9] |
李娜, 李志峰, 项辉, 等. 迷走神经刺激对脓毒症相关性脑病大鼠的保护作用[J].
中华危重病急救医学, 2015, 27(6): 509-513.
Li N, Li ZF, Xiang H, et al. Protective effects of vagus nerve stimulation on rats with sepsis-associated encephalopathy[J]. Chin Crit Care Med, 2015, 27(6): 509-513. |
 2017, Vol. 38
2017, Vol. 38

