2. 华中科技大学同济医学院附属协和医院干细胞中心 湖北 武汉 430022;
3. 湖北中医药大学检验学院 湖北 武汉 430065
2. Stem Cell Center, Wuhan Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430022, China;
3. School of Laboratory Medicine, Hubei University of Chinese Medicine, Wuhan 430065, China
间充质干细胞(mesenchymal stem cell,MSC)是成体干细胞中的常见类型。它具有多向诱导分化的潜能,可以被诱导分化成骨、软骨、脂肪及神经细胞,并具有自我更新和分化的能力,因此被认为是细胞、组织工程中修复组织损伤以及治疗多种疾病的种子细胞[1]。临床常见的MSC主要来源于人骨髓,其取材相对困难,有创伤性,并且随着供体年龄的增加,骨髓MSC的增殖能力以及数量有明显下降的趋势,一定程度上限制了临床应用[2]。在对多种组织来源的MSC的研究中,发现在脂肪组织中也存在丰富的MSC。脂肪组织来源的间充质干细胞(adipose derived mesenchymal stem cells,ASC)具有明显的优点:脂肪组织取材方便,来源丰富,而且易于分离获取,供者损伤较小, 其干细胞的应用不涉及道德伦理问题,对宿主无免疫原性。研究发现MSC能抑制人胶质瘤细胞的生长[3, 4],但其研究结果尚有一定差异。我们计划利用脂肪间充质干细胞的培养上清(ASC-conditioned medium,ASC-CM)来诱导培养胶质瘤细胞U251和U87,观察其对胶质瘤细胞的影响。
1 材料与方法 1.1 材料 1.1.1 实验细胞人胶质瘤细胞系U251、U87购自于中国科学院上海细胞库,使用含10%FBS和1%青霉素和链霉素的DMEM/F12培养基。人脂肪间充质干细胞来源于武汉协和医院干细胞中心。
1.1.2 试剂DMEM/F12培养基、胎牛血清购自美国Hyclone公司;CCK-8试剂盒购自日本Dojindo公司;Annexin-Ⅴ凋亡检测试剂盒购自南京凯基生物科技发展有限公司;Matrigel胶购自美国BD公司;Transwell培养板购自美国Corning公司。
1.1.3 仪器美国Becton Dickinson公司流式细胞仪;日本Olympus公司的倒置显微镜。
1.2 方法 1.2.1 培养基上清收集ASC培养上清(ASC-CM)收集:在T25培养瓶中用含10%胎牛血清的DMEM/F12培养ASC生长至密度在80%-90%左右时,换用新鲜无血清DMEM/F12培养基,继续培养2 d后,收集此培养上清至15 ml无菌离心管中,1 000 r/min离心5 min后,吸取离心管中上清层至新的无菌离心管中,在4 ℃保存。在细胞诱导实验前37 ℃预温,备用。
1.2.2 细胞增殖抑制实验待U251、U87细胞生长状态良好时,0.25%胰酶消化后,用含10%FBS的DMEM/F12培养基重悬细胞,按5×103/孔接种于96孔板中培养。6 h后待细胞在96孔板中完全贴壁,加入37 ℃预温ASC培养上清及DMEM/F12培养基各100 μl进行培养。每个实验组设置6个复孔。培养24 h后,每孔中加入CCK-8试剂10 μl。37 ℃继续培养2 h,在酶标仪上检测吸光度。设置检测时测定波长为450 nm,参比波长为620 nm。细胞增殖抑制率(%)=[(As-Ab)/(Ac-Ab)]×100%, As:实验孔(含有细胞的ASC培养上清、CCK-8)吸光度, Ac:对照孔(含有细胞的DMEM/F12培养基、CCK-8)吸光度, Ab:空白孔(不含细胞的培养基、CCK-8)吸光度。
1.2.3 流式检测细胞凋亡将U251、U87细胞按5×105接种于T25培养瓶中,待其生长至90%时,换用ASC培养上清,以DMEM/F12培养基为对照组。诱导48 h后,用0.25%胰酶消化收集细胞悬液,加入Annexin V-FITC染液、PI染液,室温下避光孵育1 h,1 h内流式细胞仪上检测。
1.2.4 体外细胞划痕试验将U251、U87细胞经胰酶消化重悬后,以2.5×105/孔接种于6孔板,培养24 h。待6孔板中细胞生长到90%融合时,吸去培养液,用一个200 μl的无菌塑料吸头在每孔底部划三条直线,换用ASC培养上清和DMEM/F12培养基。在0 h、24 h、48 h等时间点显微镜下观察划痕的愈合情况并拍照保存记录。
1.2.5 肿瘤细胞侵袭试验实验组用ASC培养上清培养U251、U87细胞,对照组用DMEM培养基培养,37 ℃培养48 h。将直径6.5 mm、孔径8.0 μm的聚碳酸酯膜Transwell小室置于24孔培养板中,用Matrigel稀释液加入Transwell小室底部膜的上室面,待其凝固。将经48 h培养处理的U251、U87细胞,消化后离心后,用含1%FBS的DMEM培养基重悬细胞,加100 μl悬液至Transwell的上室中,每组设3个复孔。24孔板下室加入600 μl含10%FBS的DMEM培养基。37 ℃培养24 h后,取出Transwell小室,PBS冲洗后,用棉签擦拭微孔膜上层未迁移的U251、U87细胞,下层从滤膜迁移出的U251、U87细胞则用70%甲醇固定30 min,1%结晶紫染色5 min。显微镜下200×视野下每个小室选取4个视野拍照,并计数染色细胞数。
1.2.6 统计学分析所有测定结果均用x±s表示。两组间数据分析采用t检验,以P<0.05为有统计学差异。所有数据均用SPSS 19.0统计软件分析。
2 结果 2.1 ASC培养上清抑制U251、U87细胞增殖活性CCK-8试剂检测ASC培养上清培养24 h后U251及U87细胞增殖情况,以原培养基为对照,评估细胞相对增殖活性。
结果显示,U251及U87细胞在ASC-CM培养后,与对照组比较,细胞增殖均明显受到抑制(P < 0.05);随着肿瘤细胞数的增加,其抑制效果也在逐渐减弱,提示ASC-CM抑制作用与肿瘤细胞的数量有关。见表 1。
| 表 1 ASC-CM对不同数量U251、U87细胞诱导24h的细胞增殖率的影响(%) |
用ASC培养上清培养U251、U87细胞48 h后,采用Annexin-Ⅴ/PI试剂盒检测U251、U87细胞的凋亡率,ASC-CM诱导的U251细胞凋亡率平均为(34.22±13.63)%,对照组为(2.50±0.52)%;ASC-CM诱导U87细胞凋亡率为(7.28±3.72)%,对照组为(1.90±0.45)%。ASC-CM对两种胶质瘤细胞诱导后的凋亡率均明显增加(P<0.01)。流式检测结果见图 1。
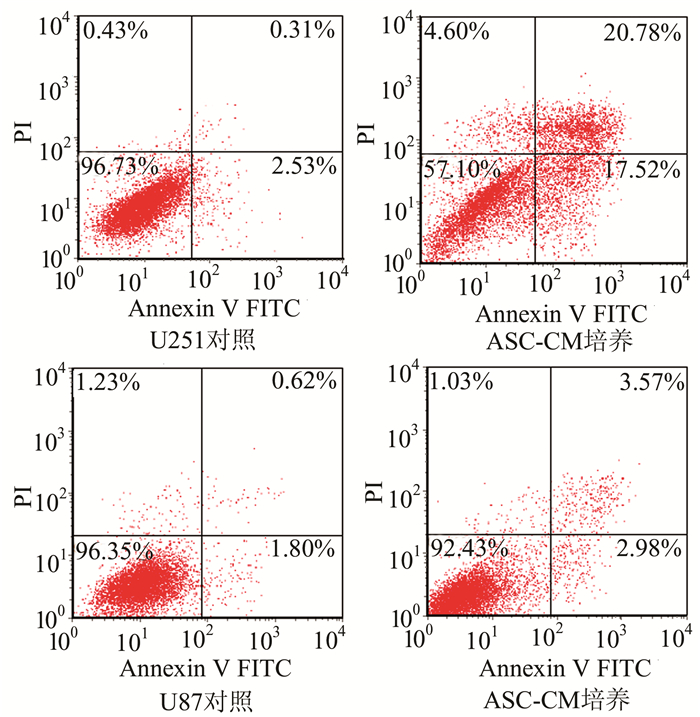
|
图 1 ASC-CM诱导U251、U87细胞凋亡的流式检测结果 |
划痕修复试验结果表明,在划痕后,对照组U251、U87细胞24 h后能很快迁移过划线区域,48 h后覆盖整个划线区域。ASC-CM培养24 h的U251、U87细胞只有少量细胞出现在划线区域,48 h后划痕区域的U251、U87细胞也并未明显增加。如图 2A、B所示。

|
图 2 ASC-CM抑制U251、U87细胞侵袭的划痕试验结果 A:U251细胞的划痕试验结果(×100):诱导U251细胞2d。对照组U251细胞在划痕的48h左右已经很快布满划痕区域。而实验组中,仅有少量U251细胞生长延伸至划痕区域,划痕依然能看到。B:U87细胞划痕试验(×100):诱导U87细胞2d。对照组U87细胞在划痕的48h左右已经很快布满划痕区域。而实验组中,部分U87细胞生长延伸至划痕区域。 |
Matrigel侵袭试验结果表明,对照组U251、U87细胞能侵袭迁移通过Transwell的Matrigel滤膜,而经过ASC上清诱导2 d后的U251、U87细胞只有少量能迁移通过transwell滤膜,与对照组细胞有显著差异,如图 3、4所示。
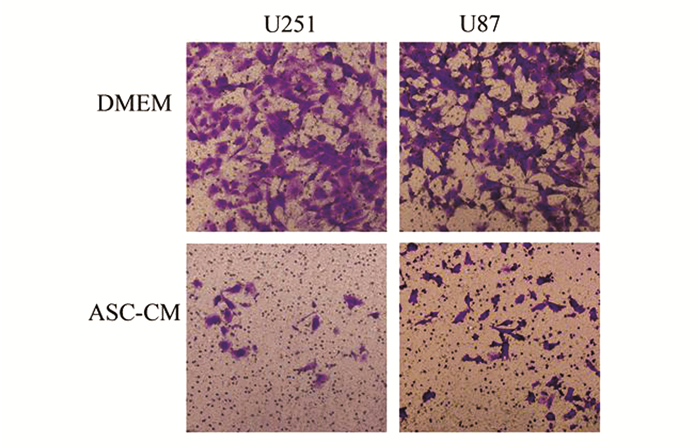
|
图 3 肿瘤细胞Matrigel侵袭试验(×200) 经过ASC培养上清诱导2 d后,U251、U87细胞的侵袭能力下降,仅有少量细胞迁移通过Transwell滤膜 |
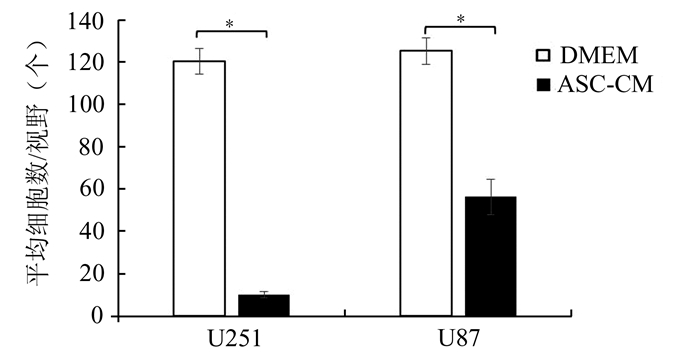
|
图 4 ASC-CM组与对照组Transwell滤膜通过的U251和U87平均细胞数比较 *P<0.01 |
人类恶性胶质瘤是成人恶性原发性脑肿瘤中最常见的肿瘤[5]。肿瘤细胞对放疗或者化疗的诱导凋亡的抵抗是其主要特点[6]。大多数胶质瘤患者的治疗后预期不佳。针对目前治疗的效果,寻找新的有效治疗方案是亟待解决的问题。
间充质干细胞(MSC)作为自我更新和多向分化潜能的干细胞,也是再生医学中重要的治疗细胞。目前研究MSC的细胞治疗的应用中除了将MSC作为杀伤肿瘤靶细胞的药物载体外,还有通过MSC培养上清作为条件培养基来进行免疫调控,抑制炎症反应,修复组织损伤,促进细胞增殖等。如Adamowicz等研究认为在MSC的培养上清中富含各种生长因子、细胞因子能有效促进膀胱组织损伤部位的增殖从而达到治疗间质性膀胱炎的效果[7]。Guo等研究脐带间充质干细胞的旁分泌机制,发现其分泌一些神经生长因子如脑源性神经营养因子、胶质细胞源性神经营养因子等,利用脐带间充质干细胞培养上清培养雪旺细胞,促进雪旺细胞存活和增殖[8]。而且我们在前期的研究中也检测了ASC分泌表达在培养上清中各种蛋白及细胞因子的水平,发现其能表达多种细胞因子,如白细胞介素(IL)-3、-6、基质金属蛋白酶-1等,这些细胞因子能参与机体的多种生理或病理过程,如炎症、细胞凋亡、分化等[9]。
目前MSC培养上清的研究中主要是针对免疫调节、炎症等,而对肿瘤的凋亡、侵袭力方面的研究相对较少。我们根据其上清中所含的丰富细胞因子类型,考虑可能用于对肿瘤细胞的治疗中,因此我们设计了针对胶质瘤细胞的脂肪干细胞培养上清的体外试验,利用脂肪干细胞培养上清(ASC-CM)培养胶质瘤细胞系U251及U87,观察其对胶质瘤细胞增殖及侵袭效应是否有调节。
我们的研究表明ASC-CM对胶质瘤细胞U251、U87细胞均能够抑制增殖。通过CCK-8检测两种胶质瘤细胞的增殖率均明显降低,同时利用Annexin-Ⅴ和PI的凋亡试剂盒,通过流式检测证实ASC-CM能够明显诱导U251、U87细胞凋亡。但也有研究ASC的实验报道认为当ASC与原代多形性胶质母细胞瘤共培养时,则促进胶质母细胞瘤的增殖[10]。分析其实验过程,考虑有两方面的因素影响,该实验采用的细胞类型为原代细胞,而我们则采用的是胶质瘤细胞系,同时该实验是将间充质干细胞与原代胶质母细胞瘤共培养的方式,其中也可能存在肿瘤细胞分泌肿瘤相关细胞因子对脂肪间充质干细胞的相互作用,而我们则是利用培养上清培养胶质瘤细胞,因此实验设计的差异可能造成实验结果的差异。
肿瘤的侵袭能力是造成肿瘤转移的重要因素。如果能有效抑制其迁移和侵袭能力,就可以控制肿瘤细胞的扩散和转移,这对肿瘤细胞的治疗极为有利。通过划痕试验提示,ASC-CM能降低胶质瘤细胞的迁移能力,其24 h和48 h的结果相差不明显,说明ASC-CM已经有效抑制了胶质瘤细胞的迁移。为进一步了解对胶质瘤细胞的侵袭能力的影响,我们进行了Transwell侵袭实验,结果同样显示,经ASC-CM诱导作用的U251和U87细胞的侵袭能力显著下降。在24 h内能通过滤膜的肿瘤细胞明显减少。我们的实验结果说明,ASC培养上清在体外对肿瘤细胞的活性有明显的抑制作用。
通过我们的研究,显示了人ASC培养上清能有效诱导人胶质瘤细胞的凋亡和降低肿瘤侵袭力。推测脂肪间充质干细胞对肿瘤细胞的抑制作用可能是通过其分泌某些细胞因子产生的,而这些因子能够调控肿瘤细胞的基因表达,进而抑制肿瘤细胞的增殖和侵袭,这还需进一步研究分析。
| [1] | Mareschi K, Ferrero I, Rustichelli D, et al. Expansion of mesenchymal stem cells isolated from pediatric and adult donor bone marrow[J]. J Cell Biochem, 2006, 97(4): 744-754. DOI: 10.1002/(ISSN)1097-4644. |
| [2] | Kern S, Eichler H, Stoeve J, et al. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue[J]. Stem Cells, 2006, 24(5): 1294-1301. DOI: 10.1634/stemcells.2005-0342. |
| [3] | Ho IA, Toh HC, Ng WH, et al. Human bone marrow-derived mesenchymal stem cells suppress human glioma growth through inhibition of angiogenesis[J]. Stem Cells, 2013, 31(1): 146-155. DOI: 10.1002/stem.v31.1. |
| [4] | Namba H. Glioma treatment strategies using mesenchymal stem cells[J]. Brain Nerve, 2010, 62(10): 1075-1082. |
| [5] | Tanase CP, Enciu AM, Mihai S, et al. Anti-cancer therapies in high grade gliomas[J]. Curr Proteomics, 2013, 10(3): 246-260. DOI: 10.2174/1570164611310030007. |
| [6] | Griguer CE, Oliva CR. Bioenergetics pathways and therapeutic resistance in gliomas: emerging role of mitochondria[J]. Curr Pharm Des, 2011, 17(23): 2421-2427. DOI: 10.2174/138161211797249251. |
| [7] | Adamowicz J, Pokrywczynska M, Drewa T. Conditioned medium derived from mesenchymal stem cells culture as a intravesical therapy for cystitis interstitials[J]. Med Hypotheses, 2014, 82(6): 670-673. DOI: 10.1016/j.mehy.2014.02.027. |
| [8] | Guo Z, Sun X, Xu X, et al. Human umbilical cord mesenchymal stem cells promote peripheral nerve repair via paracrine mechanisms[J]. Neural Regener Res, 2015, 10(4): 651-658. DOI: 10.4103/1673-5374.155442. |
| [9] | Hu L, Hu J, Zhao J, et al. Side-by-Side Comparison of the Biological Characteristics of Human Umbilical Cord and Adipose Tissue-Derived Mesenchymal Stem Cells[J]. Biomed Res Int, 2013, 2013: 438243. |
| [10] | Akimoto K, Kimura K, Nagano M, et al. Umbilical cord blood-derived mesenchymal stem cells inhibit, but adipose tissue-derived mesenchymal stem cells promote, glioblastoma multiforme proliferation[J]. Stem Cells Dev, 2013, 22(9): 1370-1386. DOI: 10.1089/scd.2012.0486. |
 2016, Vol. 37
2016, Vol. 37

