髁突负荷对下颌骨髁突软骨的形成、维持和重建有重要影响[1]。髁突软骨(mandibular condylar cartilage, MCC)细胞对负荷的敏感性是髁突保持终生改建能力的重要生物学基础。不同程度的负荷可以影响软骨细胞的分化和成熟,关节表面适应能力下降或负荷超过关节的生理适应能力将影响髁突的生长发育[2]。本研究将应用后牙双斜面导板矫治器(twin inclined plane device, TIPD)引导大鼠下颌“渐进式”后退, 动态观察3-60 d的时间内髁突软骨在不同区域、不同部位厚度的变化。
1 材料与方法 1.1 实验分组选择6周龄健康雄性Wistar大鼠48只,体重190-210 g,随机分为实验组(戴矫治器,n=32)和对照组(不戴矫治器,n=16),实验组和对照组再随机分为4个实验小组。所有大鼠均在23 ℃恒温下自由进食和饮水。实验组大鼠双侧后牙区戴TIPD以引导大鼠下颌“渐进式”后退[3]。
1.2 实验方法腹腔注射麻醉(10%氯胺酮加2%噻拉嗪, 2:1, 0.1 ml/100 g)下,将实验组和对应的对照组大鼠在3, 14, 30, 60 d分别处死,按矢状方向将头和下颌切成左右两部分,并放入4 ℃的4%的多聚甲醛溶液中过夜。
1.3 标本的制备及数据的获取实验于2013年1-10月在武汉大学口腔医学院口腔生物医学工程教育部重点实验室进行。以颞下颌关节(temporal mandibular joint, TMJ)为中心将大鼠的右侧头部剪切成1.5 cm厚的组织块,组织块放入12.5%的中性EDTA (ethlenediamine tetraacetic acid, pH 7.0)液中脱钙4-6周,在此期间,仔细去除部分软组织并暴露下颌升支。为了使EDTA更容易渗透到骨组织内脱钙,带有完整TMJ的组织块应尽可能修整小,用X线检查是否完全脱钙。当脱钙完成后,常规石蜡包埋,包埋时尽量将下颌支平面平行地面,以便于相同部位的切片比较。沿TMJ矢状方向用切片机(Leica)连续切片,厚度4 μm,按前后次序编号,HE染色。根据髁突软骨的形态和同一性,选择髁突中心处的1张切片用于数码相机(Olympus)拍照。相片用Photoshop software (V 7.01)处理。
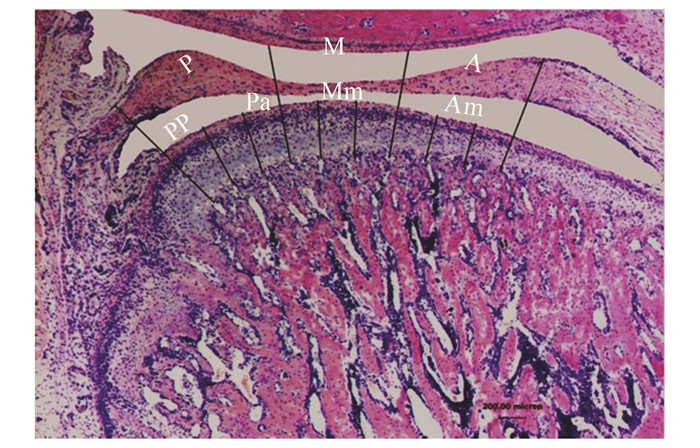
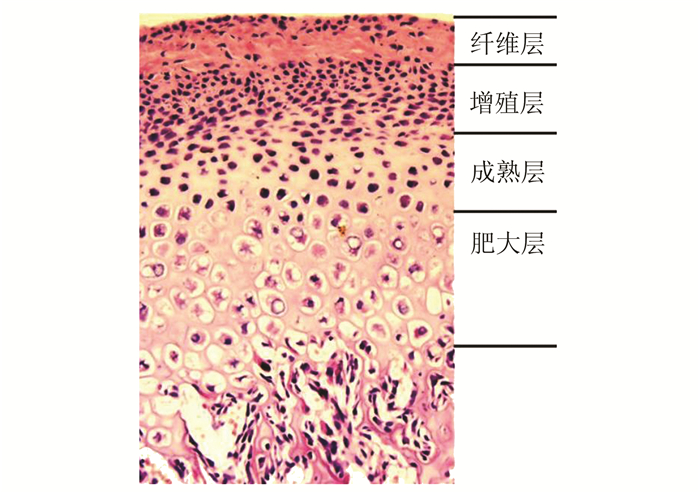
为了全面观察下颌髁突软骨厚度的变化,本研究根据髁突软骨表面的周长将它分为相等的3部分(图 1)。由于绝大多数生理和病理变化发生在TMJ关节的后区,因此选择后区中的前部(anterior part of the posterior region, Pa)和后部(posterior part of the posterior region, Pp)作为研究区域。MCC厚度是指从肥大层的最下边缘到纤维层的最外边缘(图 2)。用SPOT图像处理软件(V 3.5, a division of Diagnostic Instruments Ins., Sterling Heights, USA)完成对MCC不同部分的测量。
|
图 1 髁突软骨表面的分区和分部(HE染色×5) 分区为A:前区,M:中区,P:后区;分部为Am:前区的中部,Mm:中区的中部,Pa:后区的前部,Pp:后区的后部 |
|
图 2 髁突软骨的细胞结构(HE染色×20) 由浅至深分为纤维层、增殖层、成熟层和肥大层(HE染色×20) |
用两独立的测量记录评价测量的可靠性,测量间隔为2周,假设检验在两测量间无显著性差异。测量误差用Dahlberg’s公式(1940)计算(
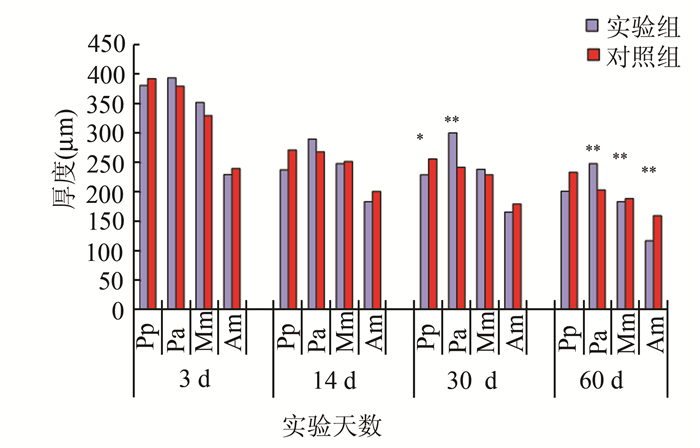
在3 d和14 d,TIPD实验组和对照组在所有区域差异没有统计学意义。在30天,后区的后部(Pp)的MCC厚度在TIPD组比对照组薄(P<0.05), 到60 d时,Pp部变得更薄(P<0.01), 肥大层几乎消失。相反,从30 d开始,后区的前部(Pa) MCC厚度在TIPD组较厚。60 d时,前区的中部(Am) MCC厚度在TIPD组较薄(P<0.01)(图 3)。
|
图 3 TIPD实验组与对照组髁突软骨厚度的变化 与对照组相比,*P<0.05,**P<0.01 |
TIPD是一种设计独特的功能矫治装置。当大鼠正常咀嚼时,它能在矢状向产生一种柔和的引导下颌后退的力使髁突软骨发生适应性改建。这不同于以往的研究。
研究结果显示髁突软骨在不同区域表现出不同的适应性改建。戴用TIPD后30天,髁突软骨的厚度在后区的后部(Pp)较薄,后区的前部(Pa)较厚。这种形式的改建可能与所在区域的位置和承受负荷的性质和大小有关。而负荷的性质和大小可以影响软骨细胞的分化及成熟,进而影响髁突的生长发育[2]。Pp位于髁突后区的最下部分,当大鼠行使咀嚼功能时,TIPD引导下颌向后滑动,使Pp承担较大的压缩负荷,而Pa位于髁突软骨的上面,由于TIPD的存在,Pa在垂直方向上的负荷减小,相当于Pa处承受牵张负荷,也就是说,由于存在压缩和牵张负荷,使得Pp处厚度较薄,而Pa处增殖层中的软骨细胞增殖迅速,厚度增加。
髁突软骨厚度与软骨的承载特性密切相关,厚度的变化反映了髁突软骨功能的适应性[4, 5]。以往的研究中,通常是将平板固定在动物的上切牙,迫使下颌“跳跃式”后退一定距离(如:3.5-4 mm),当下颌后退7 d后,髁突软骨的后区厚度就开始明显减小[6]。而本研究中,髁突软骨的后区厚度一直到第30天才开始发生明显变化,这可能与TIPD产生的温和、接近生理性力有关。这种矢向力能持续地将下颌后移,即当进行正常咀嚼时,大鼠发生无数次地下颌后退。
在没有升高颌间距离的情况下,当使用矫形力向后移动下颌时,髁突软骨中区的中部(Mm)厚度减小[6]。而升高颌间距离对髁突软骨有很大影响, 它可以引起大鼠髁突软骨的适应性改建,能刺激猴的髁突软骨发生进行性改建,也能引起兔髁突软骨体积增加。本研究中,髁突软骨中区的中部(Mm)在整个观察期60 d内无明显变化,可能是因为TIPD装置安放在上下后牙间,升高了颌间距离, 导致加在Mm处的负荷没有显著性改变所致。
研究表明髁突的持续后移能引起软骨细胞的减少和胞外基质量降低[7]。本研究中,前区的中部(Am)的髁突软骨厚度在60 d时变薄可能与此相关。另外我们的研究结果表明髁突软骨的后区和上区对髁突周围微环境的变化十分敏感。Tang的研究也得出了同样的结论[8, 9]。
总之,本研究表明TIPD戴用期间能引起髁突软骨不同区域产生不同的改建,且呈持续性。
| [1] | Sasaguri K, Jiang H, Chen J. The effect of altered functional forces on the expression of bone-matrix proteins in developing mouse mandibular condyle[J]. Arch Oral Biol, 1998, 43(1): 83-92. DOI: 10.1016/S0003-9969(97)00075-7. |
| [2] | Tanaka E, Detamore MS, Mercuri LG. Degenerative disorders of the temporomandibular joint:etiology, diagnosis, and treatment[J]. J Dent Res, 2008, 87(4): 296-307. DOI: 10.1177/154405910808700406. |
| [3] | 华先明, 夏大弘, 韩光丽, 等. 下颌渐进式后退动物模型的建立[J]. 口腔医学研究, 2012, 28(10): 983-986. |
| [4] | Carter DR, Beaupre GS, Wong M, et al. The mechanobiology of articular cartilage development and degeneration[J]. Clin Orthop Relat Res, 2004(427 Suppl): S69-S77. |
| [5] | Yao JQ, Seedhom BB. Mechanical conditioning of articular cartilage to prevalent stresses[J]. Br J Rheumatol, 1993, 32(11): 956-965. DOI: 10.1093/rheumatology/32.11.956. |
| [6] | Cholasueksa P, Warita H, Soma K. Alterations of the rat temporomandibular joint in functional posterior displacement of the mandible[J]. Angle Orthod, 2004, 74(5): 677-683. |
| [7] | Teramoto M, Kanelo S, Shibata S, et al. Effects of compressive forces on extracellular matrix in rat mandibular condylar cartilage[J]. J Bone Miner Metab, 2003, 21(5): 276-286. DOI: 10.1007/s00774-003-0421-y. |
| [8] | Tang GH, Rabie AB. Runx2 regulates endochondral ossification in condyle during mandibular advancement[J]. J Dent Res, 2005, 84(2): 166-171. DOI: 10.1177/154405910508400211. |
| [9] | Tang GH, Rabie AB, Hagg U. Indian hedgehog:a mechanotransduction mediator in condylar cartilage[J]. J Dent Res, 2004, 83(5): 434-438. DOI: 10.1177/154405910408300516. |
 2016, Vol. 37
2016, Vol. 37

