慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)预计至2020年将成为世界第三大疾病死因,其全球经济负担将跃居所有疾病的第5位[1]。肺动脉高压(pulmonary arterial hypertension,PAH)是COPD常见的并发症之一,合并PAH的COPD患者住院率及死亡率显著增加[2]。动物模型研究表明缺氧造成肺血管收缩和肺动脉壁重塑为PAH的主要发病机制[3]。然而,临床研究表明无低氧血症的COPD患者可存在肺血管内皮功能紊乱,且严重缺氧的COPD患者并非都有PAH[3, 4]。此外,长期氧疗肺动脉压很少恢复正常,且肺血管结构的异常不能改善[3],这些结果提示可能存在缺氧以外的发病机制。近来有学者提出炎症反应在COPD-PAH中起着重要作用。
白细胞介素33(interleukin-33,IL-33)是白细胞介素-1家族成员[5]。ST2是IL-33受体家族成员,以跨膜受体ST2L和可溶性受体sST2两种形式存在。sST2存在于细胞外间隙及血清中[5, 6]。体外研究发现,IL-33在吸烟诱导的COPD小鼠支气管上皮细胞及外周血单个核细胞中高度表达,并可通过ST2信号通路促进外周血单个核细胞产生并释放IL-6及IL-8[7]。PAH患者的肺血管周围存在着巨噬细胞、T细胞、B细胞等炎症细胞浸润,可通过分泌多种细胞因子参与炎症反应和肺血管的重塑过程[8]。体外细胞培养证实IL-33可上调原代人血管内皮细胞IL-6和sST2的表达,且高表达的sST2参与特发性肺动脉高压(IPAH)的肺血管内皮细胞活化或血管重建过程[9]。
IL-33/ST2信号通路是否与COPD-PAH形成的炎症机制相关仍不清楚。本研究通过检测COPD-PAH患者血清及痰液IL-33、sST2和IL-6表达水平,并与COPD-non PAH患者和健康人群比较,探讨IL-33/sST2在COPD-PAH形成中的作用。
1 材料与方法 1.1 研究对象与分组2014年10月至2015年2月于武汉大学中南医院呼吸内科住院并确诊为COPD急性加重期的31例患者,根据心脏彩超结果分为COPD-PAH组(n=13)和COPD-non PAH组(n=18)。同期在武汉大学中南医院体检中心体检的25例健康志愿者为健康对照组(HC)。
本研究获武汉大学中南医院医学伦理学委员会批准,所有研究对象均签署知情书。
1.2 入组标准及排除标准①COPD患者入组标准:符合2014年COPD全球策略(GOLD2014)中的COPD诊断标准;年龄在50-80岁之间;吸烟指数不少于10包年,既往或目前吸烟均可;目前处于COPD急性加重期,患者呼吸系统症状恶化,超出日常变异,且导致药物治疗的改变,入院前未全身使用激素、抗生素治疗;无特殊既往病史。②诊断肺动脉高压的标准为心脏彩超间接测定静息状态下平均肺动脉压(mean pulmonary artery pressure,mPAP)>30 mmHg。③HC入组标准:年龄55-80岁;无特殊疾病史。近3月无感染性疾病史;体检报告正常。肺功能检查FEV1/FVC>0.70。④排除标准:心脏瓣膜病、冠心病、糖尿病、肺部其他疾病(如肺栓塞、哮喘、支气管扩张、活动性肺结核等);自身免疫性疾病;恶性肿瘤;严重肝肾功能损害,神经系统、血液系统疾病;近3个月使用过任何形式的免疫调节剂或全身使用激素。
1.3 血标本提取清晨空腹抽取静脉血4 ml于无添加剂生化管中,轻轻翻转5次,室温静置30 min后,3 000 r/min离心15 min,分离血清-20 ℃冰箱保存。
1.4 痰标本留取及判定清晨空腹漱口后,留取第一口深部痰液于无菌培养皿中4 ℃保存,标本在1 h内处理;合格痰液判定标准为:痰直接涂片光镜检查每低倍镜视野鳞状上皮细胞<10个、白细胞>25个。加入4倍体积的0.1%二硫苏糖醇,震荡15 min后吹打至匀浆,300目尼龙膜过滤混合液,2 000 r/min离心10 min,取上清液-20 ℃冰箱保存。
1.5 实验试剂及检测方法酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)测定血清及痰液中IL-33、sST2和IL-6浓度。人IL-33和ST2 ELISA试剂盒购自Abcam公司(ab119547,ab100563),人IL-6 ELISA试剂盒购自eBioscience公司(88-7066),二硫苏糖醇购自SIGMA公司(D0632)。血常规采用美国贝克曼库尔特有限公司的LH750血液分析仪检测。血CRP采用美国雅培公司的免疫比浊法检测;血BNP采用美国雅培公司的微粒子酶免疫分析法检测;血PCT采用生物梅里埃公司的Vidas全自动免疫荧光酶标仪检测。
1.6 动脉血气分析COPD组患者入院后未吸氧时立即行动脉血气分析检查,用丹麦雷度血气分析仪ABL80FLEX检测。
1.7 肺功能均在武汉大学中南医院肺功能室进行。检查前休息30 min,在同一位资深技师指导下,采用Vmax Encore 229肺功能机检测。
1.8 心脏彩超均在武汉大学中南医院心脏彩超室进行。检查前休息30 min,由同一位资深技师用同一台Philips iE33心脏彩超机检查。
1.9 其他临床指标收集测体重指数、调查吸烟指数(年支)。COPD组患者出院前稳定期行慢性阻塞性肺病评估测试(COPD Assessment TestTM, CAT)及英国医学研究委员会呼吸困难量表(modified medical research council dyspnea scale, mMRC)自评。
1.10 统计学方法ELISA结果用MasterPlex 2010软件分析,用SPSS Statistic 17.0软件统计分析,计量资料用均数±标准差表示,计数资料用中位数(四分位间距)表示。先用单样本Kolmogorov-Smirnov检验各组数据是否符合正态分布和方差齐,两组正态分布数据采用t检验,两组以上正态分布数据采用单因素方差分析,两组非正态分布数据采用秩和检验。影响COPD-PAH的因素用Logistic分析,P<0.05表示差异具有统计学意义。
2 结果 2.1 COPD-PAH组、COPD-non PAH组及HC组临床基本资料COPD-PAH组和COPD-non PAH组临床资料对比仅静息mPAP有统计学差异,两组具可比性,见表 1。
| 表 1 COPD-PAH组、COPD-non PAH组及HC组临床基本资料 |
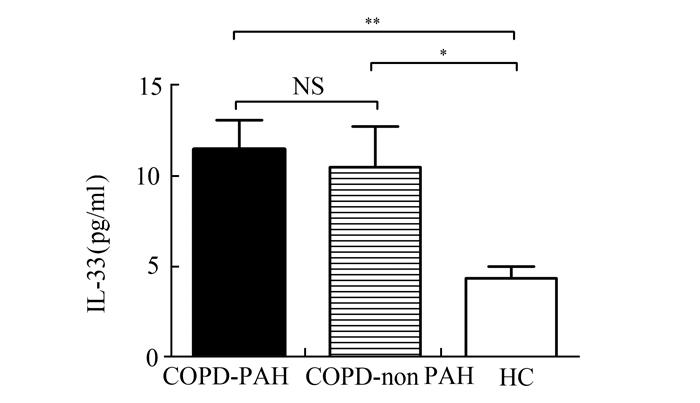
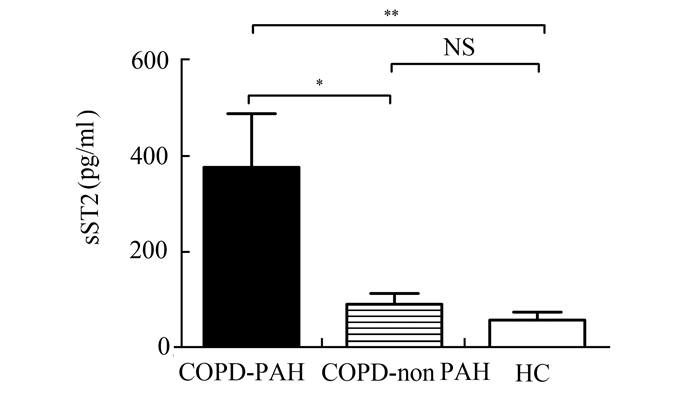
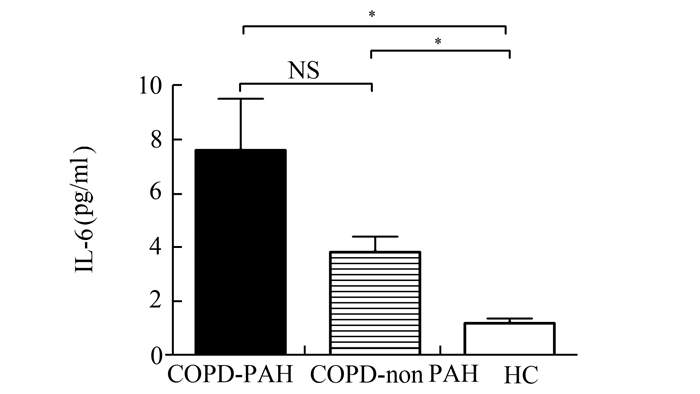
见图 1-3。COPD-PAH组和COPD-non PAH组血清IL-33水平分别为(11.47±4.86) pg/ml和(10.48±6.78) pg/ml,均显著高于HC组(4.34±1.95) pg/ml,P<0.05;COPD-PAH组和COPD-non PAH组的IL-33水平无统计学差异。COPD-PAH组有较高的sST2水平(376.92±187.11) pg/ml,显著高于COPD-non PAH组(90.91±70.07) pg/ml和HC组(57.94±31.83) pg/ml,P<0.05;但是COPD-non PAH组和HC组的sST2水平并无统计学差异。3组间血清IL-6水平呈IL-33类似的趋势,COPD-PAH组(7.58±4.88) pg/ml和COPD-non PAH组(3.81±2.40) pg/ml均显著高于HC组(1.18±0.84) pg/ml,P<0.05;COPD-PAH组和COPD-non PAH组间无统计学差异。
|
图 1 COPD-PAH组、COPD-non PAH组和HC组血清IL-33水平 *P<0.05,**P<0.01,NS:无统计学差异 |
|
图 2 COPD-PAH组、COPD-non PAH组和HC组血清sST2水平 *P<0.05,**P<0.01,NS:无统计学差异 |
|
图 3 COPD-PAH组、COPD-non PAH组和HC组血清IL-6水平 *P<0.05,**P<0.01,NS:无统计学差异 |
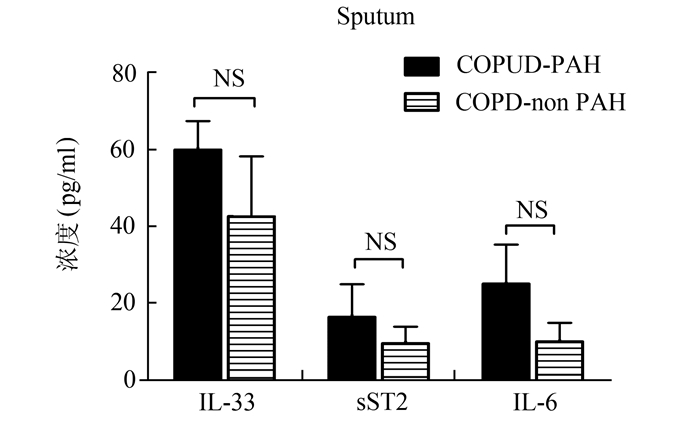
见图 4。痰液IL-33和IL-6水平高于血清水平,但痰液sST2水平却低于血清水平。COPD-PAH组有稍高的IL-33、sST2和IL-6水平[分别为(59.90±18.39) pg/ml,(16.31±11.10) pg/ml,(24.96±12.56) pg/ml],但和COPD-non PAH组[分别为(42.58±24.93) pg/ml,(9.44±6.83) pg/ml,(9.90±7.15) pg/ml]比较并无统计学差异。
|
图 4 COPD-PAH组和COPD-non PAH组痰液IL-33、sST2和IL-6水平 NS:无统计学差异 |
对COPD-PAH组与COPD-non PAH组多因素Logistic分析:性别、年龄、吸烟指数、BMI、CAT评分、mMRC评分、PaO2、PaCO2、WBC、NEUT%、NEUT绝对值、CRP、PCT、BNP、FEV1/FVC%pred、FEV1 pre、FVC pre、血清IL-33、痰液IL-33、血清sST2、痰液sST2、血清IL-6、痰液IL-6,仅有PaO2进入方程,见表 2。
| 表 2 COPD-PAH组与COPD-non PAH组多因素logistic分析 |
慢性阻塞性肺疾病(COPD)是一种常见的以持续气流受限为特征的可以预防和治疗的疾病,气流受限不完全可逆,呈进行性发展,与气道和肺脏对有毒颗粒或气体的慢性炎性反应增强有关[1]。COPD与Th1/Th2细胞免疫失衡相关,以炎症细胞活化和炎症介质释放为特征[10]。PAH是COPD常见并发症,除缺氧经典机制以外,炎症反应在COPD-PAH中起着重要作用。
Walter等在研究轻度到中度COPD患者肺组织标本时发现,炎症可导致肺血管损伤及重建,以平滑肌细胞增生以及细胞外基质的沉积为特点,肺血管重建的程度与渗入到小气道周围的炎症细胞数量呈正相关[11]。Peinado等发现COPD-PAH患者肺动脉周围有炎性细胞浸润,并可分泌多种细胞因子参与血管壁功能调节及结构重塑的病理生理过程[12]。
本研究结果显示,COPD-PAH和COPD-nonPAH患者血清IL-33及IL-6水平均显著高于HC组,证实COPD不仅仅是气道炎症,更是全身性炎症。Xia等也发现,COPD患者外周血淋巴细胞和支气管上皮细胞均高度表达IL-33;且体外烟雾提取物和LPS的刺激可促进IL-33表达[13]。因此IL-33和IL-6等炎症因子参与COPD气道和全身炎症。
本研究中COPD-PAH组血清sST2水平显著高于COPD-non PAH和HC组,而COPD-non PAH组及HC组血清sST2水平相近。表明COPD患者血清sST2升高与PAH形成相关,可能参与PAH形成的炎症反应机制。这与其它研究结果相符。如Shao等[9]发现IPAH患者血清sST2水平明显升高,且高表达的sST2参与IPAH的肺血管内皮细胞活化或血管重建过程。Carlomagno等[14]和Martinez-Rumayor等[15]研究也表明,血清sST2水平的升高预示着肺动脉高压死亡率的升高。
COPD-PAH组血清IL-33水平稍高于COPD-non PAH组,但差异无统计学意义。既往Tang[16]等研究报道COPD伴慢性肺源性心脏病(肺心病)患者血清IL-33水平高于不伴肺心病的COPD患者。但Carlomagno[14]等检测18例各种原因导致的PAH患者血清IL-33水平,发现PAH组IL-33水平与对照组无明显差异。因此,目前IL-33在PAH形成中的作用研究仍然较少,样本也较小,不同研究结果并不一致,IL-33是否在COPD-PAH的形成中发挥作用尚需进一步大样本对照研究明确。
此外,COPD-PAH组痰液IL-33、sST2和IL-6的水平比COPD-non PAH组略高,但差异无统计学意义。尚需更大样本的实验进一步证明。值得注意的是,痰液IL-33和IL-6的表达水平较血清升高,且IL-33升高得更明显,而痰液sST2水平却明显低于血清sST2水平。提示支气管细胞可分泌大量的IL-33,IL-33在COPD患者中高水平表达,同时参与COPD的气道及全身炎症反应,相反,sST2在血清中高度表达,而在痰液中水平极低,这也反映了ST2主要表达于造血细胞系及内皮细胞中,虽然支气管上皮细胞也可表达,但表达水平低。sST2更像是一种血清标志物。
对COPD-PAH组及COPD-non PAH组进行多因素Logistic分析发现,仅有PaO2进入方程,提示低氧血症与PAH的形成相关,这也符合缺氧是PAH形成的主要原因的经典理论。IL-33/ST2在COPD-PAH中的作用尚需大样本研究进一步证实。
综上所述,COPD及PHA的发生、发展是多因素共同参与的过程。IL-33和IL-6等细胞因子在COPD的气道和全身炎症反应中发挥重要作用;高水平血清sST2仅见于COPD-PAH组,提示sST2可能参与COPD-PAH形成的炎症反应机制。
| [1] | Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Diagnosis, Management and Prevention of Chronic Obstructive Pulmonary Disease (updated 2014)[EB/OL].[2015-01-02]. http://www.goldcopd.org/guidelines-global-strategy-for-dignosis-man-agement.html |
| [2] | Fang XC, Wang XD, Bai CX, et al. COPD in China:the burden and importance of proper management[J]. Chest, 2011, 139(4): 920-929. DOI: 10.1378/chest.10-1393. |
| [3] | Barbera JA, Peinado VI, Santos S. Pulmonary hypertension in chronic obstructive pulmonary disease[J]. European Respiratory Journal, 2003, 21(5): 892-905. DOI: 10.1183/09031936.03.00115402. |
| [4] | Fabbri LM, Luppi F, Beghe B, et al. Update in chronic obstructive pulmonary disease 2005[J]. American Journal of Respiratory and Critical Care Medicine, 2006, 173(10): 1. |
| [5] | Dinarello CA. An IL-1 family member requires caspase-1 processing and signals through the ST2 receptor[J]. Immunity, 2005, 23(5): 461-462. DOI: 10.1016/j.immuni.2005.10.004. |
| [6] | Miller AM, Liew FY. The IL-33/ST2 pathway--A new therapeutic target in cardiovascular disease[J]. Pharmacology & Therapeutics, 2011, 131(2): 179-186. |
| [7] | Wu HX, Yang SF, Wu XJ, et al. Interleukin-33/ST2 signaling promotes production of interleukin-6 and interleukin-8 in systemic inflammation in cigarette smoke-induced chronic obstructive pulmonary disease mice[J]. Biochemical and Biophysical Research Communications, 2014, 450(1): 110-116. DOI: 10.1016/j.bbrc.2014.05.073. |
| [8] | Joppa P, Petrasova D, Stancak B, et al. Systemic inflammation in patients with COPD and pulmonary hypertension[J]. Chest, 2006, 130(2): 326-333. DOI: 10.1378/chest.130.2.326. |
| [9] | Shao D, Perros F, Caramori G, et al. Nuclear IL-33 regulates soluble ST2 receptor and IL-6 expression in primary human arterial endothelial cells and is decreased in idiopathic pulmonary arterial hypertension[J]. Biochemical and Biophysical Research Communications, 2014, 451(1): 8-14. DOI: 10.1016/j.bbrc.2014.06.111. |
| [10] | Barnes PJ. Immunology of asthma and chronic obstructive pulmonary disease[J]. Nature Reviews Immunology, 2008, 8(3): 183-192. DOI: 10.1038/nri2254. |
| [11] | Walter RE, Wilk JB, Larson MG, et al. Systemic inflammation and COPD:the Framingham Heart Study[J]. Chest, 2008, 133(1): 19-25. DOI: 10.1378/chest.07-0058. |
| [12] | Peinado VI, Barbera JA, Abate P, et al. Inflammatory reaction in pulmonary muscular arteries of patients with mild chronic obstructive pulmonary disease[J]. American Journal of Respiratory and Critical Care Medicine, 1999, 159: 1 605-1 611. DOI: 10.1164/ajrccm.159.5.9807059. |
| [13] | Xia J, Zhao J, Shang J, et al. Increased IL-33 expression in chronic obstructive pulmonary disease[J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2015, 308(7): L619-L627. DOI: 10.1152/ajplung.00305.2014. |
| [14] | Carlomagno G, Messalli G, Melillo RM, et al. Serum soluble ST2 and interleukin-33 levels in patients with pulmonary arterial hypertension[J]. International Journal of Cardiology, 2013, 168(2): 1 545-1 547. DOI: 10.1016/j.ijcard.2012.12.031. |
| [15] | Martinez-Rumayor A, Camargo CA, Green SM, et al. Soluble ST2 plasma concentrations predict 1-year mortality in acutely dyspneic emergency department patients with pulmonary disease[J]. American Journal of Clinical Pathology, 2008, 130(4): 578-584. DOI: 10.1309/WMG2BFRC97MKKQKP. |
| [16] | Tang Y, Guan Y, Liu Y, et al. The role of the serum IL-33/sST2 axis and inflammatory cytokines in chronic obstructive pulmonary disease[J]. Journal of interferon & cytokine research:the official journal of the International Society for Interferon and Cytokine Research, 2014, 34(3): 162-168. |
 2016, Vol. 37
2016, Vol. 37

 ,
,