随着社会的发展和环境的恶化,不孕症人群不断上升。现如今,全球范围内约有8%-12%的育龄夫妇深受不孕症的影响[1]。在影响不孕症的诸多因素中,男性因素约占30%-50%。吸烟是引起男性不育的危险因素之一,有研究表明,吸烟男性精子数量、活力、存活率和密度较不吸烟者相比有所下降; 烟草中的尼古丁成分可对精子的发生过程造成影响; 吸烟所造成的氧化损伤也可破坏精子DNA的完整性[2-4]。
甲基化修饰是目前研究最为广泛的表观遗传修饰机制之一,DNA中的胞嘧啶在甲基转移酶的作用下形成5-甲基胞嘧啶(5-methylcytosine, 5-mdC),而TET酶则可将羟基转移至5-mdC上,催化5-mdC氧化生成5-羟甲基胞嘧啶(5-hydroxymethylytosine, 5-hmdC),继而重新生成未修饰的胞嘧啶,实现DNA的去甲基化,修复异常甲基化的位点。测定DNA中5-mdC和5-hmdC的水平对研究全基因组的甲基化和去甲基化状态具有重要作用。6-甲基腺嘌呤(N6-methyl-adenosine, m6A)和5-甲基胞嘧啶(5-methylcytosine, 5-mC)是哺乳动物细胞中常见的两种RNA甲基化修饰形式,可能与mRNA的功能有关,但具体作用尚不清楚。
越来越多的证据表明,精子的表观遗传学特性与胚胎和子代发育息息相关[5]。然而目前为止,尚无研究对吸烟男性精子中全基因组DNA和RNA的甲基化水平进行探索。本研究拟通过液相色谱-质谱联用(liquid chromatography-tandem mass spectrometry, LC-MS/MS)技术,测定吸烟男性精子中5-mdC,5-hmdC,m6A,5-mC的含量,以期探索吸烟对精子表观遗传学特征的影响。
1 材料与方法 1.1 研究对象此研究经武汉大学人民医院伦理委员会批准,并均已与患者签署知情同意书。收集2014年4-11月就诊于武汉大学人民医院生殖医学中心的男性患者精液样本共125例,排除性功能障碍、生殖系统感染病史,大量饮酒及长期毒害物质暴露史; 排除外伤及其他严重内科疾病史。个体暴露于烟草的程度以吸烟指数表示,采用广泛应用的pack-year计算法,即吸烟指数=吸烟频率(包/d)×吸烟年限,吸烟指数≤10者为轻度吸烟者,吸烟指数>10者为重度吸烟者[2],将研究对象分为3组:A组,对照组,43例; B组,轻度吸烟组,42例; C组为重度吸烟组,40例。
1.2 精液采集和测定根据《世界卫生组织人类精液检查及实验室处理手册》,手淫法采集禁欲2-7 d的精液标本,37 ℃下液化后,测定液化时间、精液体积、精子密度、活力和存活率。
1.3 DNA和RNA的提取精液标本采用Pureception密度梯度离心法处理[6]。沉淀下来的精子用TIANamp Genomic DNA Kit[TIANGEN BIOTECH (BEIJING) CO. LTD]提取DNA。在裂解细胞时向体系中加入10 μl 1 mmol/L DTT使精子DNA完全解聚,其余操作遵照试剂盒说明书进行。使用Trizol法提取精子RNA,室温晾干后加入25 μl无RNAse水溶解,-70 ℃冰箱保存备用。
1.4 LC-MS/MS测定DNA和RNA的碱基修饰水平将DNA和RNA样品混入同一EP管中,参照文献[7]进行酶解,用于LC-MS/MS检测。液相色谱使用Hisep C18-T色谱柱(150 mm×2.1 mm, 5 μm, Weltech Co. Ltd, Wuhan, China),流速为0.2 ml/min,柱温35 ℃,流动相A为含0.1%甲酸的超纯水,流动相B为含0.1%甲酸的甲醇,梯度洗脱:5 min,5% B; 10 min,5%-30% B; 5 min,30%-50% B; 3 min,50%-5% B; 17 min,5% B。串联质谱:电喷雾离子源,正离子扫描,多反应监测模式,离子对m/z为242.1/126.1(5-mdC),258.1/142.1(5-hmdC),282.2/150.1(m6A),258.2/126.4(5-mC)。制备标准溶液,按外标法计算样品中各核苷的浓度,并根据下列公式计算DNA中5-mdC,5-hmdC和RNA中m6A,5-mC的含量:
| $ \begin{align} & \text{5-mdC }\!\!\%\!\!\text{ =}\frac{{{\text{M}}_{\text{5-mdC}}}}{{{\text{M}}_{\text{dC}}}}\text{ }\!\!\times\!\!\text{ 100 }\!\!\%\!\!\text{ ;} \\ & \text{5-hmdC }\!\!\%\!\!\text{ =}\frac{{{\text{M}}_{\text{5-mdC}}}}{{{\text{M}}_{\text{dC}}}}\text{ }\!\!\times\!\!\text{ 100 }\!\!\%\!\!\text{ } \\ & {{\text{m}}^{\text{6}}}\text{A }\!\!\%\!\!\text{ =}\frac{{{\text{M}}_{\text{m6A}}}}{{{\text{M}}_{\text{rA}}}}\text{ }\!\!\times\!\!\text{ 100 }\!\!\%\!\!\text{ ;} \\ & \text{5-mC }\!\!\%\!\!\text{ =}\frac{{{\text{M}}_{\text{5-mC}}}}{\text{M}}\text{ }\!\!\times\!\!\text{ 100 }\!\!\%\!\!\text{ } \\ \end{align} $ |
M5-mdC,M5-hmdC,Mm6A,M5-mC分别指5-mdC,5-hmdC,m6A,5-mC的摩尔量,MdC指DNA中胞嘧啶的总摩尔量,MrA指RNA中腺嘌呤的总摩尔量,MrC指RNA中胞嘧啶的总摩尔量。
1.5 统计分析采用SPSS 19.0软件进行统计分析。使用ANOVA比较不同组5-mdC,5-hmdC,m6A和5-mC差异,使用多元线性回归模型分析可能对上述4项指标造成影响的因素,P < 0.05认为差异具有统计学意义。
2 结果 2.1 各组精液参数比较患者精液分析结果见表 1。C组(重度吸烟组)精液密度、存活率及前向运动精子比例(PR)较A组(对照组)相比有显著下降(P<0.05),而B组(轻度吸烟组)与A组相比有所降低,但尚无统计学差异。各组间精液体积和液化时间亦无显著差异。
| 表 1 各组间精液常规参数比较 |
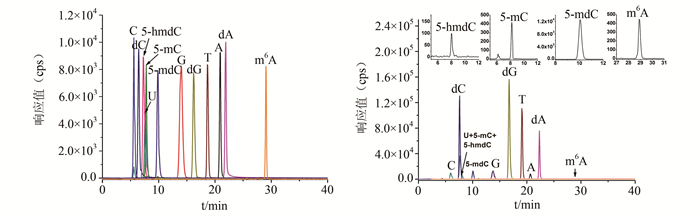
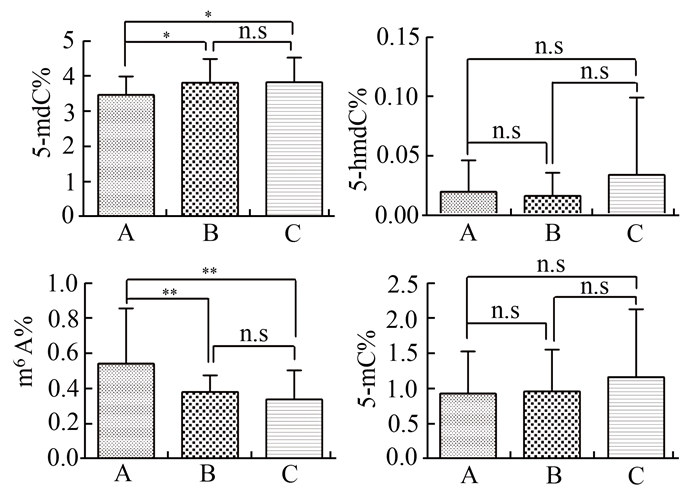
图 1为标准品和一份精液中5-mdC,5-hmdC,m6A,5-mC的典型色谱图。与A组相比,B、C组中5-mdC的含量均显著升高(P<0.05),m6A的含量则显著降低(P<0.01):A组5-mdC的平均含量为3.45%±0.52%,B组为3.79%±0.68%,C组为3.81%±0.70%; A组m6A的平均水平为0.67%±0.19 %,B组为0.38%±0.09%,C组为0.34%±0.17%。B、C组间5-mdC和m6A的含量无显著差异。5-hmdC和5-mC在3组间的平均含量则无显著差异:A组5-mC的平均含量为0.93%±0.60%,B组为0.96%±0.60%,C组为1.16%±0.97%; A组5-hmdC的平均含量为0.02%±0.03%,B组为0.02%±0.02%,C组为0.03%±0.07%(图 2)。
|
图 1 标准品和精液样品中5-mdC,5-hmdC,m6A和5-mC的色谱图 |
|
图 2 各组精子中5-mdC,5-hmdC,m6A,5-mC含量比较 *P<0.05; ** P<0.01; n.s:无统计学差异 |
使用多元线性回归模型分析影响以上4种碱基水平变化的因素(表 2)。纳入分析模型的变量有:人群类型(非吸烟者和吸烟者)、吸烟程度(轻度或重度),精液密度、存活率及活力,同时将年龄作为混杂因素也纳入该模型中。结果显示,是否为吸烟人群对5-mdC和m6A的水平影响较大(β分别为0.35和-0.07,P<0.05),而吸烟程度及精液质量参数(密度、存活率和PR)对这两个指标的影响并不大,患者的年龄对测定结果亦无显著影响。纳入模型的所有变量对5-hmdC和5-mC的变化均无显著影响。
| 表 2 多元线性回归分析结果 |
哺乳动物细胞的DNA和RNA中存在多种表观遗传学修饰。5-mdC是DNA中最常见的修饰碱基,在体细胞、生殖细胞和胚胎中广泛存在,具有调节基因表达和遗传印记、X染色体灭活等功能,可反映细胞全基因组甲基化水平。近来有研究发现,TET蛋白可催化5-mdC发生氧化生成5-hmdC,后者是DNA发生主动去甲基化的中间产物,可经过一系列氧化反应重新生成胞嘧啶,最终实现基因组的去甲基化; 5-hmdC也可稳定地存在于成体组织细胞中,因此通过测定细胞中5-hmdC的水平,可在一定程度上反映DNA的去甲基化程度。细胞中RNA的转录后修饰有100多种,其中m6A是RNA中存在的主要甲基化形式之一,可能参与mRNA剪接、运输等加工过程,通过siRNA诱导培养细胞中人m6A甲基转移酶(METTL3)的沉默可引起细胞凋亡,说明RNA中m6A修饰对细胞功能的维持具有十分重要的作用,但具体功能仍不十分清楚。5-mC在mRNA也广泛存在,其功能可能与m6A类似。
临床上对精子质量的评价多从动力学和形态学参数着眼,而这些指标并不能很好地预测辅助生殖技术的结果。了解精子表观遗传学信息的变化对于精子发生和胚胎发育的研究具有重要意义。在生殖过程中,精子的作用不仅在于传递父系来源的基因,同时还可将其所携带的表观遗传学信息一并传递给受精卵,直接影响胚胎发育。研究显示,精子全基因组甲基化水平过低可能影响辅助生殖技术的临床妊娠率,精子特定基因的启动子区域甲基化异常则与多种男性不孕性疾病和精子缺陷有关,而重复序列的甲基化异常可能与复发性流产的发生有关。精子中的RNA一方面可反映精子发生过程中的基因表达变化,另一方面也可被传递入受精卵,在胚胎着床和早期胚胎发育阶段发挥调控作用[9]。然而,目前为止尚没有研究对吸烟男性中DNA和RNA的甲基化改变进行探索。
吸烟对男性精子存在多方面的影响。多数研究表明,吸烟可对精液质量造成影响,导致精子总数、密度、活力和存活率下降。在分子水平,吸烟可产生大量的氧化物和活性氮,对精浆中的抗氧化物和精子DNA造成氧化损伤; 烟草中的主要成分之一尼古丁还可影响精子成熟过程中染色质结构内组蛋白的取代反应[10]。在本研究中,我们发现,重度吸烟者精液密度,存活率及活力较不吸烟者相比有显著下降,而轻度吸烟者精液各参数与正常者相比虽无统计学差异,但仍有降低的趋势。随后,借助LC-MS/MS技术,我们同时对同一样本中的5-mdC、5-hmdC、m6A和5-mC这4种成分进行了检测,结果显示,轻度和重度吸烟者精子全基因组DNA甲基化水平较不吸烟者相比均显著升高,RNA中m6A的水平则明显降低,且轻重度吸烟者之间并不存在统计学差异; 多元线性回归结果也表明,5-mdC和m6A的变化并不与烟草暴露程度有关,而仅与研究对象是否为烟民有关。而5-hmdC和5-mC在3组之间并无差异,说明烟草暴露对DNA去甲基化的过程以及RNA中胞嘧啶的甲基化修饰过程影响并不显著,但也不排除抽样误差的存在。总的来说,相较于精液密度,精子活率和活力这些常规指标而言,吸烟对精子表观遗传学特征的影响可能更加显著,即便是轻度的烟草暴露也可引起精子内DNA和RNA甲基化的异常,而这些异常很可能通过精卵结合过程传递给后代。
综上所述,吸烟不仅可影响精子的活力,也可造成全基因组甲基化水平升高以及RNA中腺嘌呤甲基化水平降低,但具体机制尚有待探索。
| [1] | Inhorn MC, Patrizio P. Infertility around the globe: new thinking on gender, reproductive technologies and global movements in the 21st century[J]. Human Reproduction Update, 2015, 21(4): 411-426. DOI: 10.1093/humupd/dmv016. |
| [2] | 余波澜, 周宇林, 陈康, 等. 吸烟对正常男性和弱精子症男性精子DNA完整性的影响[J]. 生殖医学杂志, 2013, 22(6): 404-408. |
| [3] | Yu B, Qi Y, Liu D, et al. Cigarette smoking is associated with abnormal histone-to-protamine transition in human sperm[J]. Fertil Steril, 2014, 101(1): 51-57. DOI: 10.1016/j.fertnstert.2013.09.001. |
| [4] | Yousefniapasha Y, Jorsaraei G, Gholinezhadchari M, et al. Nitric oxide levels and total antioxidant capacity in the seminal plasma of infertile smoking men[J]. Cell Journal, 2015, 17(1): 129-136. |
| [5] | Shen L, Song CX, He C, et al. Mechanism and function of oxidative reversal of DNA and RNA methylation[J]. Annual Review of Biochemistry, 2014, 83: 585-614. DOI: 10.1146/annurev-biochem-060713-035513. |
| [6] | Zou Y, Yin T, Chen S, et al. On-chip cryopreservation: a novel method for ultra-rapid cryoprotectant-free cryopreservation of small amounts of human spermatozoa[J]. PLoS One, 2013, 8(4): e61593. DOI: 10.1371/journal.pone.0061593. |
| [7] | Chen ML, Shen F, Huang W, et al. Quantification of 5-methylcytosine and 5-hydroxymethylcytosine in genomic DNA from hepatocellular carcinoma tissues by capillary hydrophilic-interaction liquid chromatography/quadrupole TOF mass spectrometry[J]. Clinical Chemistry, 2013, 59(5): 824-832. DOI: 10.1373/clinchem.2012.193938. |
| [8] | Hiura H, Okae H, Chiba H, et al. Imprinting methylation errors in ART[J]. Reproductive Medicine and Biology, 2014, 13(4): 193-202. DOI: 10.1007/s12522-014-0183-3. |
| [9] | Hosken DJ, Hodgson DJ. Why do sperm carry RNA? Relatedness, conflict, and control[J]. Trends in Ecology & Evolution, 2014, 29(8): 451-455. |
| [10] | Anderson D, Schmid TE, Baumgartner A. Male-mediated developmental toxicity[J]. Asian Journal of Andrology, 2014, 16(1): 81-88. DOI: 10.4103/1008-682X.122342. |
 2016, Vol. 37
2016, Vol. 37

