2. 武汉大学人民医院泌尿外科 湖北 武汉 430060
2. Dept. of Urology, Renmin Hospital of Wuhan University, Wuhan 430060, China
欧美国家前列腺癌是泌尿系统第一大肿瘤,近年来,随着前列腺癌的筛查普及,前列腺癌在中国的发病率逐渐增加,并且晚期前列腺癌患者的比例也逐渐提高[1]。由于去势抵抗性前列腺癌对内分泌治疗不再敏感,使得免疫治疗成为仅有的几种有效延长患者生存期的治疗方式。已有报道利用树突状细胞(dendritic cell, DC)研制的免疫疫苗可以治疗去势抵抗性前列腺癌[2, 3]。肿瘤细胞由于缺少抗原提呈路径组分,使得树突状细胞无法提呈肿瘤相关抗原给T细胞,因而表现为逃避免疫监视,导致肿瘤进行性生长,抗原加工相关转运蛋白(tansporter associated with antigen processing, TAP)是抗原提呈组件的一个重要组成部分,在前列腺癌细胞中表达显著下降,且同肿瘤的分期分级密切相关,因而上调肿瘤细胞中TAP1的表达是许多基因疫苗的关键部分[4]。我们尝试构建TAP1慢病毒载体,通过转染PC-3细胞,发现可以上调TAP1的表达。
1 材料与方法 1.1 材料质粒DNA提取试剂盒、胶回收试剂盒、质粒纯化试剂盒(Sigma公司);慢病毒包装质粒Mix (Invitrogen);293T细胞(中国科学院细胞库);实验所用抗体(Santa Cruz公司);转染试剂Lipofectamine 2000(美国Invitrogen公司)。
1.2 载体构建 1.2.1 质粒准备将测序正确的pLenti-TAP1-IRES-EGFP菌液划线培养,用AXYGEN质粒中抽试剂盒进行质粒抽提。测定质粒浓度,保证抽提质粒的浓度在1 μg/μl左右,DNA的A260/A280在1.8-2.0之间。
1.2.2 慢病毒包装,收获与浓缩按照标准方法取生长状态良好的293T细胞用于转染[5],转染后48 h,收集293T细胞上清液。以0.45 μm醋酸纤维素膜的滤器过滤得到慢病毒,离心收集后-80 ℃保存。
1.3 慢病毒滴度测定将293T细胞接种24孔板,根据病毒的预期滴度,10倍倍比稀释慢病毒浓缩液。将10-1-104四个梯度病毒液加入各感染孔内,同时加入促转染试剂polybrene后培养。培养72 h后观察荧光表达情况,流式细胞仪检测绿色荧光蛋白(GFP)阳性细胞数,并依此计算待测慢病毒的滴度。
选取GFP阳性细胞百分比在1%-30%之间的慢病毒稀释度,进行计算。计算公式:
Titer=[F×C/V]×D
F=GFP阳性细胞百分比,C=感染时每孔细胞总数,V=接种体积(ml),D=慢病毒稀释度。
1.4 RT-PCR检测TAP1表达培养PC-3细胞,设置TAP1组及对照病毒组,分别加入100 μl目的及对照病毒液,以加入PBS作为空白对照组,加入IFN-γ作为阳性对照组。
感染72 h后荧光显微镜观察慢病毒上报告基因EGFP的表达情况。收集细胞后按照RT-PCR试剂盒说明书检测TAP1慢病毒表达,具体如下:每孔加入1 ml Trizol裂解细胞,抽提RNA,经DNaseⅠ处理后将RNA反转录成cDNA,qPCR检测目的基因表达。引物信息如下TAP-1前向引物(5′-3′, 后同):GGCCTATGCAGTCAACTCCT,TAP-1逆向引物:CTTACAGCCCCACTGGTCAC,actin-前向引物:TCCTTCCTGGGCATGGAGT,actin-逆向引物:CAGGAGGAGCAATGATCTTGAT。用2×SYBR Green Mix配制PCR Mix,根据需要上机的样品数和重复数,计算并配制PCR Mix,分装至AXYGEN PCR 8连管,微型离心机瞬时离心混匀PCR体系。将上述样品放入Eppendorf Realplex荧光定量PCR仪,SYBR Green法荧光定量PCR以分析各基因的表达,PCR程序设置如下:PCR反应可设成3步法:95.0 ℃预变性2 min,1个循环。95.0 ℃变性15 s,59.0 ℃退火20 s,72.0 ℃延长20 s,PCR循环40次。熔解曲线60.0-95.0 ℃30 s,共39个循环。数据采用比较Ct值法进行各基因表达的相对定量。
1.5 统计学方法统计学方法,采用SPSS 18.0统计软件进行分析,两样本均数比较采用t检验,以P<0.05为差异有统计学意义。
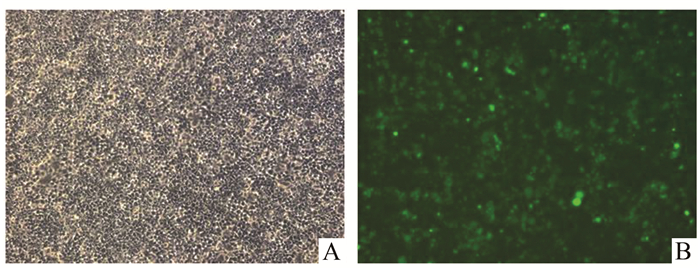
2 结果 2.1 成功构建pLenti6.3-TAP1-IRES-EGFP载体转染293T细胞后进行PCR可发现成功构建慢病毒表达载体,将构建好的载体转染经荧光显微镜下观察可以发现绿色荧光蛋白强表达,说明慢病毒载体构建成功,详见图 1。
|
图 1 293T细胞转染pLenti-TAP1-IRES-EGFP载体 A.转染前显微镜下显示细胞; B.转染pLenti-TAP1-IRES-EGFP后荧光显微镜下显示绿色荧光,说明载体构建成功(×200) |
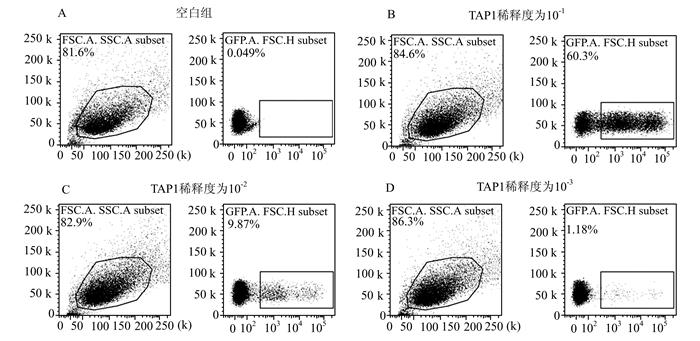
流式细胞仪检测显示对照组GFP阳性细胞比例为0.049%,TAP1稀释10倍转染组GFP阳性细胞比例为60.3%,TAP1稀释100倍转染组GFP阳性细胞比例为9.8%,TAP1稀释1 000倍转染组GFP阳性细胞比例为1.18%。通过公式Titer=[F×C/V]×D计算病毒液滴度为2.87×107 TU/ml[F=GFP阳性细胞百分比,C=感染时每孔细胞总数,V=接种体积(ml), D=慢病毒稀释度],详见图 2。
|
图 2 流式细胞仪测定TAP1慢病毒滴度 A.空白组; B. TAP1稀释10倍后测定绿色荧光细胞数目; C. TAP1稀释100倍后测定绿色荧光细胞数目; D. TAP1稀释1 000倍后测定绿色荧光细胞数目。选取稀释度为10-3组的进行滴度计算,Titer=[F×C/V]×D=[(1.18%-0.049%)×250 000/0.1]×1 000,最终浓度为2.83×107TU/ml |
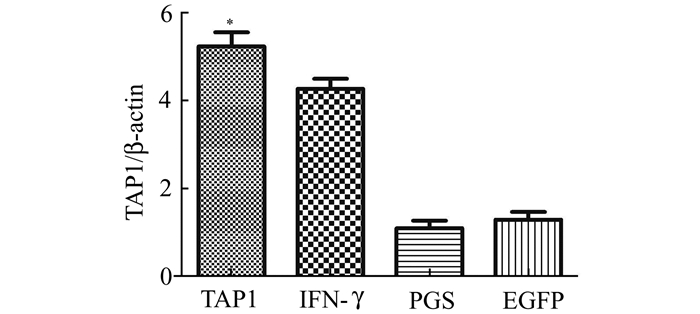
转染TAP1慢病毒后第72小时,收集的PC-3细胞经RT-PCR检测,结果显示相比空白载体对照组(EGFP组)和对照组(PBS组),能够显著扩增PC-3细胞中TAP1的mRNA, 差异有统计学意义(P<0.05)。这同传统的通过细胞因子IFN-γ处理所得到的结果相一致,详见图 3。
|
图 3 转染TAP1慢病毒的PC-3细胞中TAP1表达量测定 TAP1转染后,PC-3细胞中TAP1表达量较PBS组,EGFP组显著升高(*P<0.05),同IFN-γ处理相一致 |
对于去势抵抗型前列腺癌的治疗临床上常利用放疗、化疗或者冷冻治疗等物理疗法,但效果不理想,难于有效延长患者的生存期[6]。而针对前列腺癌患者的个体化疫苗可以有效地治疗前列腺癌,目前部分基于DC的免疫疫苗已经上市。而利用DC作为细胞免疫治疗面临的一个困境就是DC无法足够地表达前列腺癌细胞的抗原表位,主要原因是前列腺癌细胞特异性的下调其抗原转运组件的表达,其中以TAP为代表[7]。这在我们前期研究中也发现相同情况,TAP1的表达在前列腺癌组织呈低表达,而正常前列腺组织、前列腺增生症组织中正常表达,并且TAP1的表达量同前列腺癌的分期、分级以及Gleason评分等相关,因此可作为前列腺癌预后的一个特异性指标,同时也提示我们可以通过外源性地提高前列腺癌细胞中TAP1的表达,来增加树突状细胞对其表面抗原的获取、提呈,从而呈现出特异性的细胞毒效应。
TAP1是MHC-1限制的抗原提呈途径中的重要分子,由TAP1和TAP2两个亚基组成。TAP位于细胞内质网膜上,其主要作用是将胞质中加工产生的抗原肽由胞质转运到内质网腔, 在此与内质网中新合成的HLA-1分子组装形成抗原肽-HLA-1复合物, 转运至细胞表面被CD8+T淋巴细胞识别,从而启动机体的细胞免疫反应。TAP表达改变可引起MHC-1抗原降低以及抗原肽向CTL细胞的递呈能力的下降,从而使肿瘤细胞逃避免疫监视作用[8]。
病毒性载体包括腺病毒载体,慢病毒系统以及逆转录病毒载体。慢病毒载体较逆转录病毒载体有更广的宿主范围,慢病毒能够有效感染非周期性和有丝分裂后的细胞。慢病毒载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果。对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,使用慢病毒载体,能大大提高目的基因的转导效率,且目的基因整合到宿主细胞基因组的几率大大增加,能够比较方便快捷地实现目的基因的长期、稳定表达。可以作为基因治疗的有效载体[9]。我们通过制备慢病毒质粒载体pLenti-TAP1-IRES-EGFP,然后通过慢病毒包装系统,转染293T细胞后获得稳定的慢病毒颗粒,经过分离,纯化,检测获得下一步基因治疗用的慢病毒颗粒。根据浓度梯度稀释后转染细胞在荧光显微镜下观察细胞转染成功,同时采用流式细胞仪检测出各组阳性细胞比后按照公式计算出慢病毒浓度。
将此慢病毒同雄激素非依赖型前列腺癌细胞株PC3细胞共培养,在不同感染复数(MOI为10, 20, 50)情况下转染PC-3发现,MOI为50时细胞感染率可以到95%,而转染后3 d获得的PC-3细胞定量PCR检测到TAP1表达呈显著性上升。从而为DC获取PC-3细胞抗原提供了实验基础,增强了免疫治疗的成功率。
本研究成功构建TAP1的慢病毒过表达载体pLenti6.3-TAP1-IRES-EGFP,病毒液滴度为2.87×107TU/ml,转染后的PC-3细胞中TAP1表达增强,为增强免疫治疗的杀伤性提供基础。
| [1] | 毕新刚, 韩仁强, 周金意, 等. 2009年中国前列腺癌发病和死亡分析[J]. 中国肿瘤, 2013, 22(6): 417-422. |
| [2] | Lubaroff DM. Prostate cancer vaccines in clinical trials[J]. Expert Rev Vaccines, 2012, 11(7): 857-868. DOI: 10.1586/erv.12.54. |
| [3] | Mottet N, Bellmunt J, Bolla M, et al. EAU Guidelines on Prostate Cancer. Part Ⅱ: Treatment of Advanced, Relapsing, and Castration-Resistant Prostate Cancer[J]. Eur Urol, 2011, 59: 572-583. DOI: 10.1016/j.eururo.2011.01.025. |
| [4] | Seliger B, Stoehr R, Handke D, et al. Association of HLA class Ⅰ antigen abnormalities with disease progression and early recurrence in prostate cancer[J]. Cancer Immunol Immunother, 2010, 59(4): 529-540. DOI: 10.1007/s00262-009-0769-5. |
| [5] | Qiu T, Wang L, Liu XH, et al. Over-expressing transporters associated with antigen processing increases antitumor immunity response in prostate cancer[J]. Cellular Immunology, 2012, 279(2): 167-173. DOI: 10.1016/j.cellimm.2012.10.004. |
| [6] | Bilusic M, Heery C, Madan RA. Immunotherapy in prostate cancer: Emerging strategies against a formidable foe[J]. Vaccine, 2011, 29(38): 6 485-6 497. DOI: 10.1016/j.vaccine.2011.06.088. |
| [7] | Sims RB. Sipuleucel-T: autologous cellular immunotherapy for men with asymptomatic or minimally symptomatic metastatic castrate resistant prostate cancer[J]. J Cancer, 2011, 2: 357-359. |
| [8] | Seliger B, Ritz U, Ferrone S. Molecular mechanisms of HLA class I antigen abnormalities following viral infection and transformation[J]. Int J Cancer, 2006, 118(1): 129-138. DOI: 10.1002/(ISSN)1097-0215. |
| [9] | 孟凡荣, 陈琛, 万海粟, 等. 慢病毒载体及其研究进展[J]. 中国肺癌杂志, 2014, 12(7): 870-876. |
 2016, Vol. 37
2016, Vol. 37

 ,
,