胃肠道肿瘤是临床常见的恶性肿瘤,在世界范围内拥有较高的发病率与死亡率,最新的统计显示世界范围内每年约有231万新发病例[1, 2],国内约有75万/年的新增病例,发病率与死亡率长期居高[3],且近年来有逐渐升高趋势[4]。参照NCCN对于胃肠道肿瘤的治疗指南,针对不同病理类型与临床分期患者的治疗策略与预后结果存在较大差异,如何更早的对肿瘤的病理类型与临床分期作出预测是近期胃肠道肿瘤诊断与治疗研究的热点之一[5]。氧调节蛋白150(150-kU oxygen-regulated protein,ORP150)是一种分子质量150 kU的应激蛋白,主要参与细胞的内质网应急过程,研究显示其在乳腺癌、甲状腺肿瘤、前列腺癌以及膀胱癌中发挥作用,可以调控细胞的凋亡过程[6]。本实验通过分析胃肠道肿瘤患者血清ORP150水平与肿瘤病理类型以及临床分期之间关系,探讨ORP150在胃肠道肿瘤诊断与分期过程中参考的意义。
1 材料与方法 1.1 研究对象 1.1.1 肿瘤患者纳入标准:选取2014年1月至2015年4月期间在我院就诊胃癌、结肠癌与直肠癌患者,首诊患者未手术,就诊后于我院接受手术治疗并行病理检查者作为研究对象。
排除标准:复发肿瘤患者,已接受规范化放化疗患者,就诊后未行手术,诊断不明患者,无病理检查结果患者予以排除,排除除消化系统以外的长期慢性疾病或近期急性疾病患者及传染病患者。
1.1.2 正常对照纳入标准,选取于我院接受体检的正常体检者20人。排除标准,有长期慢性疾病或近期急性病史者,可疑肿瘤与传染病患者。
1.1.3 炎症对照组纳入标准,选取于我院接受治疗的急性阑尾炎患者20人。排除标准,伴随有长期慢性基础疾病,可疑肿瘤与传染病者。
1.2 资料搜集在知情同意的情况下,收集患者基础病史资料,治疗经过,相关检查结果,临床诊断与病理诊断。
1.3 血清收集患者于入院后第2天清晨空腹采血,4 000 r/min离心后,留取血清-80 ℃冻存备用。
1.4 指标检测使用ELISA法检测各组患者血清ORP150水平。试剂盒选用武汉伊莱瑞特生物科技有限公司检测试剂盒,相关操作参照试剂盒说明。
1.5 统计学分析计数资料采用卡方检验分析,计量资料以均数±标准差表示,如方差齐,使用单因素方差分析,如方差不齐选用Tamhane’s T2检验,选取P<0.05作为有效性标准,分析使用SPSS 21.0软件进行。
2 结果 2.1 按照肿瘤发病部位分组情况研究共纳入肿瘤患者518例,其中胃癌215例,结肠癌153例,直肠癌148例,其中男性患者298例,女性患者220例,年龄(58.8±11.2)岁,详细基础信息见表 1。通过分析,胃癌、结肠癌、直肠癌以及对照组和炎症组之间在年龄和性别方面差异不具有统计学意义(P>0.05)。
| 表 1 按照肿瘤位置分组基本信息表 |
|
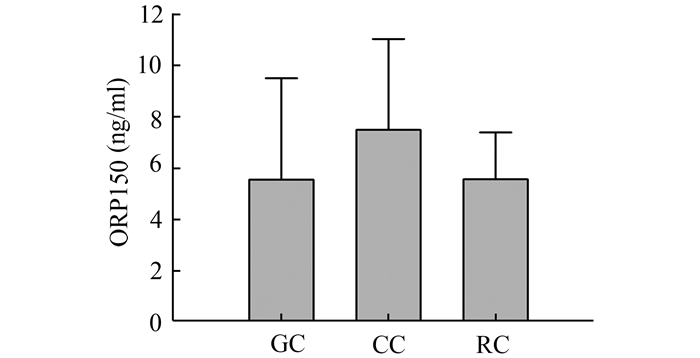
图 1 患者血清ORP150水平与肿瘤发病部位间关系 GC:胃癌组;CC:结肠癌组;RC:直肠癌组 |
将胃癌、结肠癌、直肠癌3组患者血清ORP150水平进行Levene方差齐性分析,结果3组间方差不齐,选用Tamhane’s T2检验,结果显示各组间患者血清ORP150水平差无明显差异(P>0.05)。
2.3 按照肿瘤病理诊断类型分组情况根据临床病理诊断(参照WHO胃肠道肿瘤病理分类与分期,2010版),将患者分为腺癌高分化、中分化、低分化以及黏液腺癌、印戒细胞癌与间质瘤组,合并对照组与炎症组共8组数据,各组详细基础数据见表 2,对比各组在性别与年龄中差异无统计学意义(P>0.05)。
| 表 2 按照病理诊断分型分组基本信息表 |
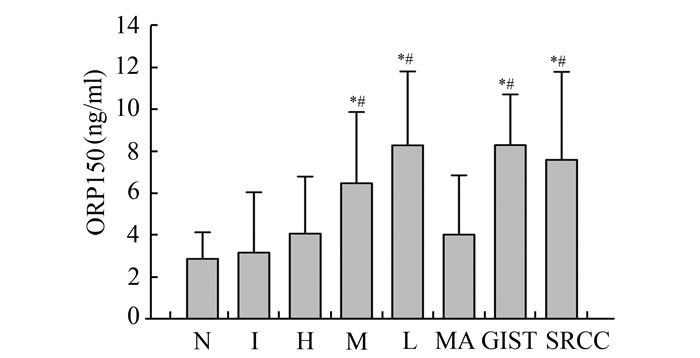
上述8组数据进行比较,Levene检验具备方差齐性,进行单因素方差分析。结果显示炎症组与对照组间差异不具有统计学意义(P>0.05),肿瘤组中除黏液腺癌与高分化腺癌组与对照组间无统计学差异外,各组患者血清ORP150相比于对照组均有明显升高(P<0.05)。各肿瘤组间比较,结果显示随着腺癌分化程度的降低,患者血清ORP150水平不断升高,中低分化组与高分化组间差异具有统计学意义(P<0.05),低分化组与中分化组相比虽然血清ORP150水平有所升高,但对比两组差异无统计学意义(P>0.05);间质瘤与黏液腺癌组患者血清ORP150水平较高,相比于高分化腺癌组患者差异具有统计学意义,但与中低分化组之间无明显差别(P>0.05),见图 2。
|
图 2 患者血清ORP150水平与肿瘤病理诊断间关系 N:正常对照组;I:炎症组;H:高分化腺癌组;M:中分化腺癌组;L:低分化腺癌组;MA:黏液腺癌组;GIST:间质瘤组;SRCC:印戒细胞癌组;*与正常对照和炎症组对比差异有统计学意义(P<0.05);#与高分化腺癌组对比差异有统计学意义(P<0.05) |
按照肿瘤浸润深度(参照AJCC胃肠道肿瘤TNM分期,第七版),按照将患者分为黏膜内患者(Tis与T1a),浸润黏膜肌(T1b),浸润肌肉层(T2),累及浆膜层(T3),全层(T4a与T4b)5组,对于无法判断浸润深度的排除在比较之外,详细数据见表 3,对比各组年龄与性别无明显差异存在(P>0.05)。
| 表 3 按照浸润深度分组基本信息表 |
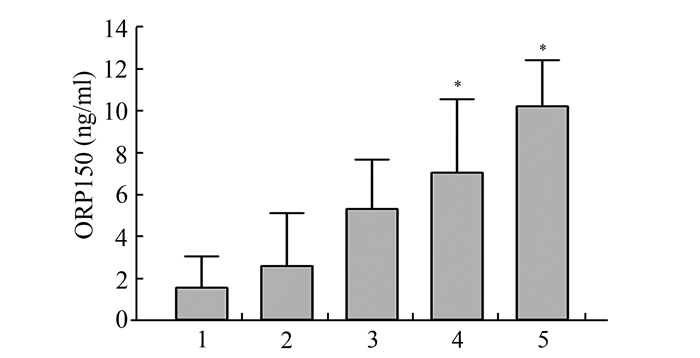
对比上述各组患者血清ORP150水平,Levene检验具备方差齐性,进行单因素方差分析。结果显示随着浸润深度的增加,患者血清ORP150水平逐渐升高,对比各组之间,当肿瘤浸润至浆膜层后,ORP150升高明显,相比于浸润至黏膜内和黏膜肌患者差异具有统计学意义(P<0.05),见图 3。
|
图 3 患者血清ORP150水平与肿瘤浸润深度间关系 1:黏膜内组;2:突破黏膜肌组;3:累及肌肉层组;4:累及浆膜层组;5:全层组;*与黏膜内与黏膜肌组相比差异具有统计学意义(P<0.05) |
按照肿瘤是否有淋巴结转移与远隔脏器转移进行分组,分为有淋巴结转移组与无淋巴结转移组,以及有远隔脏器转移组与无远隔脏器转移组,排除无法确证是否存在淋巴结或远处转移者,详细信息见表 4,对比各组年龄与性别不存在明显差异(P>0.05)。
| 表 4 按照转移情况分组基本信息表 |
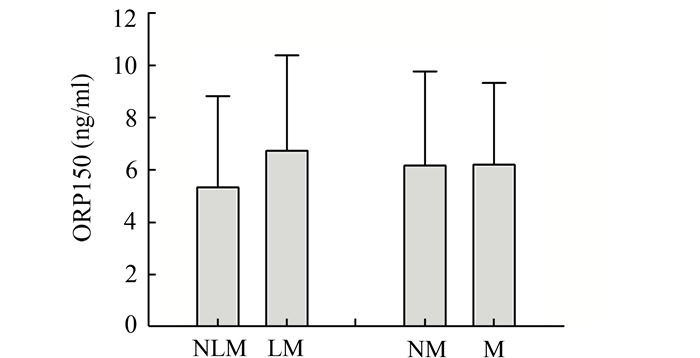
对比上述各组患者血清ORP150水平,Levene检验具备方差齐性,进行单因素方差分析。结果显示患者血清ORP150水平在不同转移组间无明显差异(P>0.05),见图 4。
|
图 4 患者血清ORP150水平与肿瘤转移情况间关系 NLM:无淋巴结转移组;LM:淋巴结转移组;NM:无远处转移组;M:远处转移组 |
肿瘤的早期诊断对于患者的治疗以及预后具有至关重要的作用,研究显示在胃肠道肿瘤中,TNM分期较低的患者预后明显优于中晚期患者[7, 8]。随着先进的影像学技术以及内镜技术的应用,使得临床胃肠道肿瘤的诊断更加准确可靠,但是相关的检查手段仍较为繁琐,难以进行大范围的普及应用,作为肿瘤的早期筛查方式仍面临各种困难。肿瘤标记物作为一种肿瘤特异性高表达物质,可以在一定程度上反映肿瘤的发生和进展程度,在胃肠道肿瘤中,联合应用CEA、CA125、CA19-9、CA72-4以及TSGF等可以有效地提高胃肠道肿瘤的检出率,但是相关指标仍具有局限性,其检测特异性与敏感性仍待提高[9, 10]。因此寻找和丰富胃肠道肿瘤的分子检测指标,优化相关检测方式是现今胃肠道肿瘤诊断领域的研究热点之一。
不少研究证实ORP150在肿瘤组织中具有较高表达,在乳腺癌中的研究显示,ORP150高表达预示着较低的病理学分级以及更差的预后,并与肿瘤的淋巴结转移情况具有一定相关性[6]。由于ORP150是细胞内质网应激过程中表达的一种应激性蛋白折叠分子伴侣,可以参与未折叠蛋白反应引起的内质网应激过程,在诸如糖尿病、胰腺炎、退行性神经系统病变等疾病中发挥重要作用[11]。而在肿瘤组织中,由于瘤体组织生长迅速,在相对缺血缺氧以及营养能量供应不足情况下可以引起细胞蛋白合成障碍,进而导致内质网应激的发生,引起ORP150的高表达[12, 13]。
目前研究认为ORP150在肿瘤的生长过程中主要发挥两种作用,即抗凋亡作用与促血管生成作用。在内质网应激的研究中,研究者发现ORP150可以参与其中PERK通路与ATF6通路,通过抑制PERK激活以及ATF6转位,进而减少CHOP的激活,控制由于内质网应激引起的细胞凋亡发生[13, 14]。在肿瘤细胞中,研究者也观察到ORP150的抗凋亡作用,通过此作用可以提高肿瘤细胞耐受更严峻的缺氧与低能量供应环境的能力,同时减弱机体的抗肿瘤天然免疫以及部分化疗药物的治疗效果,致使肿瘤组织的生长以及侵袭能力增强[15]。另有研究显示ORP150的表达与肿瘤组织VEGF产生以及血管生成过程相关,该作用可能与ORP150促进分泌性VEGF蛋白正常折叠以及从内质网向高尔基体的转运有关[16]。综合肿瘤组织中ORP150的两种作用,可以认为其与肿瘤组织的生长以及侵袭具有较高的相关性。
本研究中,我们分析了患者血清ORP150与肿瘤部位、病理分型、浸润深度以及转移的相关性。在排除了年龄与性别的可能干扰之后,我们的研究结果显示肿瘤的部位与患者血清ORP150水平具有一定的关系,但是由于数据的离散性较大,导致各组间不存在统计学差异,更进一步的比较可能需要更大样本量的研究支持。根据病理分型分组结果显示,患者血清ORP150水平与分化程度相关,分化程度较低的肿瘤患者血清ORP150水平较高,由于低分化程度意味着患者肿瘤组织具有更快生长速度、更高的恶性程度以及较差的预后,因此ORP150可以作为评价患者肿瘤生长与预后的可能参考指标。根据患者肿瘤组织浸润情况进行分组,结果显示随着浸润深度的增加,患者血清ORP150水平逐渐升高,此变化很可能与ORP150在肿瘤细胞中的抗凋亡以及促血管生成作用有关,该结果提示ORP150可以作为肿瘤患者分期的可能参考指标。但是研究中患者肿瘤转移情况与ORP150水平无明显相关性,具体机制仍需更进一步的研究探讨。
综上所述,本实验通过分析胃肠道肿瘤患者血清ORP150水平与肿瘤种类,分化程度以及分期之间关系,可以认为胃肠道肿瘤患者血清ORP150水平与肿瘤分化程度以及浸润情况相关,可以作为患者病情判断的参考指标,在胃肠道肿瘤诊断与分期过程中具有一定参考意义。
| [1] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): 359-386. DOI: 10.1002/ijc.29210. |
| [2] | Torre LA, Bray F, Siegel RL, et al. Global Cancer Statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI: 10.3322/caac.21262. |
| [3] | 陈万青, 郑荣寿, 曾红梅, 等. 2011年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2015, 24(1): 1-10. |
| [4] | Jemal A, Bray F, Center MM, et al. Global Cancer Statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90. DOI: 10.3322/caac.v61:2. |
| [5] | NCCN. NCCN Clinical Practice Guidelines in Oncology: Gastric Cancer, V. 2. 2015 [S]. NCCN, 2015. https://www.nccn.org/professionals/physician_gls/f_guidelines.asp |
| [6] | Stojadinovic A, Hooke JA, Shriver CD, et al. HYOU1/Orp150 expression in breast cancer[J]. Medical Science Monitor, 2007, 13(11): 231-239. |
| [7] | Graziosi L, Marino E, Cavazzoni E, et al. Prognostic value of the seventh AJCC/UICC TNM classification of non-cardia gastric cancer[J]. World Journal of Surgical Oncology, 2013, 11: 103. DOI: 10.1186/1477-7819-11-103. |
| [8] | Marrelli D, Morgagni P, de Manzoni G, et al. Prognostic Value of the 7th AJCC/UICC TNM Classification of Noncardia Gastric Cancer Analysis of a Large Series From Specialized Western Centers[J]. Annals of Surgery, 2012, 255(3): 486-491. DOI: 10.1097/SLA.0b013e3182389b1a. |
| [9] | Carpelan-Holmstrom M, Louhimo J, Stenman UH, et al. CEA, CA 19-9 and CA 72-4 improve the diagnostic accuracy in gastrointestinal cancers[J]. Anticancer Res, 2002, 22(4): 2311-2316. |
| [10] | Yin LK, Sun XQ, Mou DZ. Value of Combined Detection of Serum CEA, CA72-4, CA19-9 and TSGF in the Diagnosis of Gastric Cancer[J]. Asian Pac J Cancer Prev, 2015, 16(9): 3867-3870. DOI: 10.7314/APJCP.2015.16.9.3867. |
| [11] | Deng WH, Chen C, Wang WX, et al. Effects of ORP150 on appearance and function of pancreatic beta cells following acute necrotizing pancreatitis[J]. Pathol Res Pract, 2011, 207(6): 370-376. DOI: 10.1016/j.prp.2011.03.006. |
| [12] | Feldman DE, Chauhan V, Koong AC. The unfolded protein response: a novel component of the hypoxic stress response in tumors[J]. Mol Cancer Res, 2005, 3(11): 597-605. DOI: 10.1158/1541-7786.MCR-05-0221. |
| [13] | Hetz C. The UPR as a survival factor of cancer cells: More than folding proteins[J]. ? Leuk Res, 2009, 33(7): 880-882. DOI: 10.1016/j.leukres.2009.02.017. |
| [14] | Kusaczuk M, Cechowska-Pasko M. Molecular chaperone ORP150 in ER stress-related diseases[J]. Curr Pharm Des, 2013, 19(15): 2807-2818. DOI: 10.2174/1381612811319150016. |
| [15] | Manekeller S, Seinsche A, Sioutis M, et al. Extended liver resection after preoperative chemotherapy: influence on regeneration and endoplasmic reticulum stress response[J]. Langenbecks Arch Surg, 2009, 394(4): 681-688. DOI: 10.1007/s00423-008-0402-7. |
| [16] | Ozawa K, Tsukamoto Y, Hori O, et al. Regulation of tumor angiogenesis by oxygen-regulated protein 150, an inducible endoplasmic reticulum chaperone[J]. Cancer Res, 2001, 61(10): 4206-4213. |
 2016, Vol. 37
2016, Vol. 37

