2. 武汉大学口腔医院修复科 湖北 武汉 430079;
3. 南昌大学第二附属医院口腔科 江西 南昌 330000
2. Dept. of Prosthodontics, School & Hospital of Stomatology, Wuhan University, Wuhan 430079, China;
3. Dept.of Stomatology, the Second Affiliated Hospital of Nanchang University, Nanchang 330000, China
近年来,氧化锆因其良好的美学效果和机械性能被用于种植基台,基台穿龈表面的细菌黏附和聚集是导致种植体周围炎的始动因子[1]。研究表明,牙龈卟啉单胞菌(Porphyromonas gingivalis,Pg.)和溶血性链球菌(Streptococcus sanguis,Ss.)与种植体周围炎的发生密切相关[2],且不同口腔材料会影响细菌的黏附[3]。如果基台材料能抑制致病菌在基台材料表面的黏附和聚集,即可减少种植体周围炎发生的概率。因此,本研究通过观察牙龈卟啉单胞菌和溶血性链球菌在临床上最常用基台材料氧化锆和钛表面的黏附性能,比较两种常用基台材料对口腔常见致病菌的抗黏附性能,为临床应用提供理论支持和参考。
1 材料与方法 1.1 实验材料氧化锆(LAVA,美国,由深圳洋紫荆牙科器材提供)和医用纯钛(宝鸡市钛城有色金属公司)加工成6.8 mm×6.8 mm×1.5 mm的块状,碳化硅砂纸湿润条件下逐级打磨(600#、800#、1 000#、1 200#、1 500#),流水下冲洗。将样本依次放入丙酮、无水乙醇、去离子水中超声洗涤,高温高压蒸汽灭菌,备用。
1.2 主要仪器扫描电子显微镜(scanning electron microscope, SEM,Quanta 200,FEI,荷兰)、原子力显微镜(atomic force microscope,AFM,SPM-9500J3,日本岛津),表面粗糙度仪(Marsurf PS,德国),接触仪(Contact Angle Meter,SL200B,美国),酶标仪(Ultra Microplate Reader,ELX808,BIO-TEK,美国)。
1.3 样本表面形貌、粗糙度和接触角的检测随机选取氧化锆和钛样本,在无尘环境下自然干燥,SEM和AFM观察样本平面和三维表面形貌,并进行表面粗糙度(Ra值)和湿润性接触角(contact angle)检测。结果以x±s表示。
1.4 实验菌株牙龈卟啉单胞菌(Pg.)ATCC 33277,溶血性链球菌(Ss.)ATCC 10556,以上菌株均由武汉大学口腔医学院口腔生物医学教育部重点实验室提供。Pg.和Ss.分别经厌氧复苏37 ℃培养72 h和48 h,涂片染色后形态学检查为纯培养物后再分别接种于BHI血琼脂平板厌氧培养72 h和48 h,16S rRNA基因测序鉴定为纯培养物后,备用。
1.5 细菌黏附SEM观察将氧化锆和钛样本浸泡于1×108 CFU/ml Pg.菌悬液和1×106 CFU/ml Ss.菌悬液中,厌氧培养箱中培养4 h。PBS冲洗后放入2.5%戊二醛溶液中固定2 h,PBS冲洗后梯度乙醇脱水(30%、50%、70%、80%、90%、95%、100%Ⅰ、100%Ⅱ),每梯度15 min,醋酸异戊酯与无水乙醇(1:1, V/V)浸泡30 min,再置入醋酸异戊酯30 min。临界值干燥,SEM观察细菌黏附情况。
1.6 MTT法间接检测氧化锆和钛表面黏附的细菌数量将氧化锆和钛样本浸泡于1×108 CFU/ml Pg.菌悬液和1×106 CFU/ml Ss.菌悬液中,厌氧培养箱中培养4 h。PBS冲洗后放入含10%MTT的BHI液体培养基中,继续厌氧培养1 h,去除培养基,加入二甲基亚砜(Dimethyl Sulphoxide,DMSO)溶液,用酶标仪检测570 nm波长处的吸光度(optical density,OD),每组5个样本,重复3次。
1.7 统计分析采用SPSS 16.0软件对材料表面的粗糙度、接触角和材料表面黏附细菌的OD值进行统计分析。数据以均数±标准差(x±s)表示,两组均数的比较采用t检验,多组均数的比较采用方差分析,以P<0.05为检验水准。
2 结果 2.1 样本表面形貌、粗糙度和接触角材料表面形貌结果见图 1和2。SEM可观察到氧化锆和钛表面平行打磨的纹路,AFM可观察到氧化锆和钛表面打磨的凹槽,且钛表面有一些微孔。SEM和AFM的结果均可观察到氧化锆表面比钛表面光滑。

|
图 1 氧化锆和钛表面的SEM形貌 A:氧化锆;B:钛 |

|
图 2 氧化锆和钛表面的AFM形貌 |
氧化锆和钛表面的粗糙度(Ra值)、接触角结果见表 1。可见氧化锆表面明显比钛表面光滑,结果与SEM和AFM观察的结果相一致;氧化锆表面的接触角小于钛表面,但没有统计学差异。
| 表 1 样本表面粗糙度和接触角 |
Pg.和Ss.在氧化锆和钛表面的黏附结果见图 3,可见氧化锆表面黏度的Pg.和Ss.呈散在分布,钛表面黏度的Pg.和Ss.分布则相对比较聚集,且氧化锆表面黏附的Pg.和Ss.数量均少于钛表面。

|
图 3 Pg.和Ss.在氧化锆和钛表面黏附的SEM图 |
MTT法测定氧化锆和钛表面黏附细菌量的OD值见图 4,结果可见培养4 h后氧化锆表面黏附的Pg.数量明显低于钛表面黏附的Pg.数量,而经培养后的Ss.在氧化锆和钛表面的黏附数量没有统计学差异。MTT法的测定结果和SEM观察结果基本相一致。
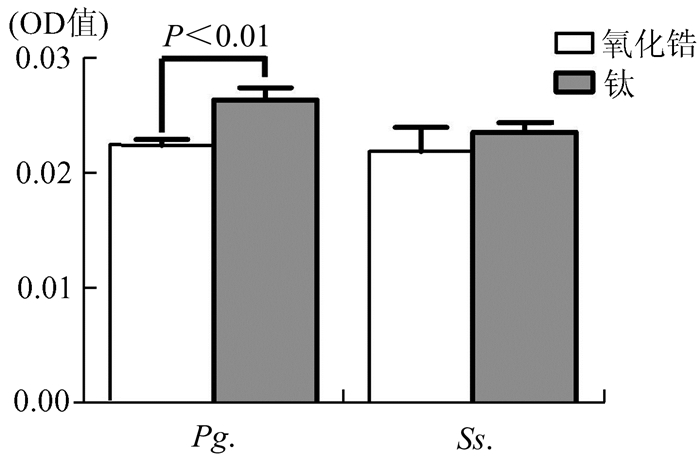
|
图 4 MTT法检测氧化锆和钛表面黏附细菌数量的OD值 |
种植体周围炎是种植义齿修复后的最常见并发症,严重影响其远期成功率。基台穿龈表面致病微生物的黏附和定植是发生种植体周围炎的始动因素,基台材料对口腔内常见致病菌的抗黏附性能可能会影响致病菌在基台表面的黏附和定植,进而影响种植体周围组织的健康。口腔内常见致病菌的黏附和定植有一定的顺序,研究表明,溶血性链球菌是口腔内最早的定植菌之一[4],牙龈卟啉单胞菌是牙周炎和种植体周围炎最常见的致病菌之一[5, 6]。因此本研究比较牙龈卟啉单胞菌和溶血性链球菌在常用基台材料氧化锆和钛表面的黏附性能。
基台材料表面的理化特性如粗糙度[7]、湿润性[8]等都能对口腔内微生物对定植都有重要影响。粗糙的材料表面可为细菌提供更多更大的黏附定植面积,材料表面越粗糙细菌越容易黏附,然而材料表面粗糙度与细菌黏附的定量关系目前尚未统一,但是有等学者认为,当粗糙度低于0.2 μm时细菌黏附的量就不再受材料表面粗糙度的影响[9]。材料表面的接触角是反映材料亲水性能的一个指数,接触角越小,湿润性越大,亲水性越强,细菌越容易黏附[10]。本研究结果中,氧化锆和钛表面的粗糙度分别是(0.09±0.01)μm和(0.12±0.01)μm,虽然两者的粗糙度有统计学差异,但两者的粗糙度均小于0.2 μm,因此可以认为氧化锆和钛表面的粗糙度对细菌黏附的量没有影响;其次,氧化锆和钛表面的接触角分别是(58.7±2.9)°和(55.1±2.5)°,虽然接触角没有统计学差异,但是接触角略小的钛表面则有利于细菌的黏附和定植;这个推论和SEM观察到Pg.和Ss.在氧化锆和钛表面黏附到结果相一致。
本研究中SEM定性和MTT定量两种检测方法的结果基本一致。有学者采用Real-time PCR法比较了氧化锆愈合基台和钛基台周围菌斑中的致病菌,结果发现氧化锆愈合基台周围定植的致病菌数量比钛愈合基台周围的致病菌数量多,但是没有统计学差异[11];也有研究采用平板菌落计数法发现氧化锆和钛表面黏附的牙周致病菌菌落数量没有差异[12]。这些结果的差异可能和不同的材料来源及研究方法等因素有关。
本研究结果提示,氧化锆表面的Pg.和Ss.黏附和定植数量低于钛表面。但是由于本实验方法与临床实际情况存在一定的差异,口腔内的局部微环境,材料在口内的耐腐蚀性及患者的口腔卫生等[13],都有可能影响到细菌的黏附。因此,氧化锆基台材料对口腔内致病菌的黏附影响还需要大样本长时间的临床观察和研究。
| [1] | Russell AA, Tawse-Smith A, Broadbent JM, et al. Peri-implantitis diagnosis and treatment by New Zealand periodontists and oral maxillofacial surgeons[J]. N Z Dent J, 2014, 110(1): 6-10. |
| [2] | Gerber J, Wenaweser D, Heitz-Mayfield L, et al. Comparison of bacterial plaque samples from titanium implant and tooth surfaces by different methods[J]. Clin Oral Implant Res, 2006, 17(1): 1-7. DOI: 10.1111/j.1600-0501.2005.01197.x. |
| [3] |
丁宁, 张祖太, 何敏, 等. 几种常用口腔材料细菌粘附性能比较[J].
北京口腔医学, 2014, 22(5): 258-260.
Ding N, Zhang ZT, He M, et al. Assessment of bacterial adhesion of different dental materials[J]. Beijing J Stomatol, 2014, 22(5): 258-260. |
| [4] | Chava VR, Manjunath SM, Rajanikanth AV, et al. The efficacy of neem extract on four microorganisms responsible for causing dental caries viz Streptococcus mutans, Streptococcus salivarius, Streptococcus mitis and Streptococcus sanguis: an in vitro study[J]. J Contemp Dent Pract, 2012, 13(6): 769-772. |
| [5] | Irshad M, Scheres N, Crielaard W, et al. Influence of titanium on in vitro fibroblast-Porphyromonas gingivalis interaction in peri-implantitis[J]. J Clin Periodontol, 2013, 40(9): 841-849. DOI: 10.1111/jcpe.2013.40.issue-9. |
| [6] | Irshad M, Scheres N, Anssari Moin D, et al. Cytokine and matrix metalloproteinase expression in fibroblasts from peri-implantitis lesions in response to viable Porphyromonas gingivalis[J]. J Periodont Res, 2013, 48(5): 647-56. DOI: 10.1111/jre.2013.48.issue-5. |
| [7] | Hahnel S, Wieser A, Lang R, et al. Biofilm formation on the surface of modern implant abutment materials[J]. Clin Oral Implants Res, 2015, 26(11): 1 297-1 301. DOI: 10.1111/clr.2015.26.issue-11. |
| [8] | Sardin S, Morrier JJ, Benay G, et al. In vitro streptococcal adherence on prosthetic and implant materials. Interactions with physicochemical surface properties[J]. J Oral Rehabil, 2004, 31(2): 140-148. DOI: 10.1046/j.0305-182X.2003.01136.x. |
| [9] | Chen CJ, Ding SJ, Chen CC. Effects of surface conditions of titanium dental implants on bacterial adhesion[J]. Photomed Laser Surg, 2016, 34(9): 379-388. |
| [10] | Das T, Sharma PK, Busscher HJ, et al. Role of extracellular DNA in initial bacterial adhesion and surface aggregation[J]. Appl Environ Microbiol, 2010, 76(10): 3 405-3 408. DOI: 10.1128/AEM.03119-09. |
| [11] | van Brakel R, Cune MS, van Winkelhoff AJ, et al. Early bacterial colonization and soft tissue health around zirconia and titanium abutments: an in vivo study in man[J]. Clin Oral Implant Res, 2011, 22(6): 571-577. DOI: 10.1111/clr.2011.22.issue-6. |
| [12] | Egawa M, Miura T, Kato T, et al. In vitro adherence of periodontopathic bacteria to zirconia and titanium surfaces[J]. Dent Mater J, 2013, 32(1): 101-106. DOI: 10.4012/dmj.2012-156. |
| [13] |
陈昌荣, 刘克华, 陈凯. 口腔卫生宣教在种植体周围炎基础治疗后疗效维护中的作用[J].
武汉大学学报:医学版, 2013, 34(6): 899-901.
Chen CG, Liu KH, Chen K. Role of oral health education in postoperative treatment of peri-implantitis[J]. Med J Wuhan Univ, 2013, 34(6): 899-901. |
 2018, Vol. 39
2018, Vol. 39


