糖尿病发病率日益增加,研究证明糖尿病患者存在认知功能损害[1]。认知功能损害表现为学习和记忆功能受损,以及视空能力受损和执行决策功能障碍,影响老年人的晚年生活质量。
CYP1B1是细胞色素酶P450(cytochrome P450, CYP) 蛋白中的一员,CYP家族和认知功能的关系也得到部分研究的证实,例如CYPs代谢睾丸激素和雌二醇,此物质属于神经活性类固醇,对认知和记忆有影响;当敲除小鼠脑专属的CYP46A1基因时,会降低脑内的胆固醇水平,并且在人体中CYP46A1的多态性与认知损害有一定的联系[2]。我们实验室前期研究表明,CYP1B1在脂肪代谢中起作用,并抑制高脂膳食诱导的脂肪组织炎症[3],且CYP1B1对高脂膳食诱导的认知损伤有调控作用,而这种调控作用与氧化应激有关[4]。因此,结合相关文献研究和前期结果,本实验采用高脂高糖饲料加低剂量链脲佐菌素建立 (Streptozcin, STZ) 小鼠2型糖尿病,探讨CYP1B1敲除对改善小鼠2型糖尿病导致的认知功能损害的影响,和对小鼠的学习记忆能力的保护作用。
1 材料与方法 1.1 仪器与试剂链脲佐菌素 (Sigma公司),血糖测试仪和血糖试纸 (Johnson One touch Ultra),柠檬酸和柠檬酸三钠 (上海生物工程),Morris水迷宫 (上海移数信息科技有限公司),计算机 (联想Intel P4兼容机),图像采集系统 (包括摄像机、图像采集卡、广角变焦镜头),Morris水迷宫数据采集和分析软件,脱脂奶粉 (武汉洁洋盛),避暗机器 (北京亚欧德鹏)。
1.2 实验动物CYP1B1基因敲除 (KO) 小鼠 (美国Frank Gonzalez博士赠送),SPF级C57BL/6J野生型 (WT) 小鼠 (武汉大学实验动物中心提供)。
1.3 饲料清洁级高脂高糖饲料 (上海普路腾生物科技有限公司提供),普通饲料 (湖北省疾病预防控制中心动物实验中心提供)。高脂高糖饲料的供能比例为:29.23%脂肪、52.04%碳水化合物和18.73%蛋白质,普通饲料的供能比例为:4.14%脂肪、75.52%碳水化合物和20.34%蛋白质。
1.4 实验方法 1.4.1 2型糖尿病小鼠模型建立20-22 g野生型 (WT) 和CYP1B1基因敲除 (KO) 雄性小鼠,随机分为高脂高糖膳食组 (high fat-high sucrose diet,HFSD) 和对照普通膳食组 (normal chew, NC),即WT-NC组、KO-NC组、WT-HFSD组和KO-HFSD组, 每组7只。3周相应饲料喂养后,在第3周末, 禁食8 h,测其空腹血糖后,取50 mg STZ溶于10 ml的0.1 mol/L柠檬酸缓冲液 (由0.1 mol/L柠檬酸钠和0.1 mol/L柠檬酸按照1:1.32配制, pH 4.5) 中, HFSD组腹腔注射STZ 100 mg/kg,NC组注射相应溶剂作为对照,继续喂养3周后在第6周末, 小鼠禁食不禁水8 h后, 用血糖仪测定血糖。小鼠2型糖尿病成模标准:空腹血糖≥11.1 mmol/L且多饮、多尿、多食、体重增加不明显,保持充足食物和水,每天更换垫料。成模后进行Morris水迷宫实验和避暗实验,检测各组小鼠的学习记忆能力。
1.4.2 Morris水迷宫[5] 1.4.2.1定位航行实验 (place navigation test, PNT) 在正式实验开始前让小鼠任意游泳2 min,让其熟悉实验环境,视力有缺陷和身体不平衡的需剔除。定位航行实验历时5 d,每天分为上午和下午两个时段,分别训练4次,每次90 s,随机选取不同入水点,同一次训练的全部小鼠采用相同的入水点。训练开始时,将小鼠面向池壁轻轻放入水中,系统自动记下小鼠自入水到找到平台所用的时间 (即潜伏期) 及轨迹图等,小鼠找到平台并需在平台上停留5 s。在规定时间内 (90 s) 找平台失败的小鼠,需将其引导到平台,并默认潜伏期为90 s。每次小鼠爬上或被引导到平台,在平台上休息20 s,训练间隔时间为1 h。将小鼠每天4个象限的潜伏期取算术平均值即得到小鼠的平均潜伏期。
1.4.2.2空间搜索实验 (spatial probe test, SPT) 实验第5天下午待定位航行实验结束后拿掉平台,随机任意选择一个象限作为入水点,将小鼠面向池壁放入水中,记录小鼠在90 s内穿越原平台位置的次数和原平台象限游泳时间。
1.4.3 避暗实验[6]利用小鼠具有趋暗避明的习性设计的装置,一半是暗室,一半是明室,中间有一小洞相连。暗室底部铺有通电的铜栅,并与一计时器相连,计时器可自动记录潜伏期的时间,动物进入暗室即受到电击,计时自动停止。记录小鼠进入暗室前的潜伏期和一定时间内进入的次数,可以反映小鼠的记忆情况。
1) 适应:将动物背向洞口放入明室,让动物在两室内自由活动2-3 min。
2) 训练:开启电刺激仪器,参数设置:电压40 V,时间5 min,将动物背向洞口放入明室,记录5 min内的潜伏期和电击次数。
3) 测验:24 h后进行,将动物背向洞口放入明室,记录5 min内的潜伏期和电击次数。
4) 消退:第5天进行。将动物背向洞口放入明室,记录5 min内的潜伏期和电击次数。实验指标:潜伏期:动物从放入明室开始按实验开始到进入暗室遭电击的计时时间。出错次数:实验时间内小鼠从明室进入暗室受到电击的次数。
1.4.4 统计学分析实验数据均以x±s进行表示。用SPSS 21.0软件进行分析,P<0.05时差异有统计学意义。
2 结果 2.1 小鼠2型糖尿病模型的建立注射STZ前,与NC组相比,HFSD组小鼠体重增量增加,注射STZ且相应饲料喂养3周后,与NC组比,HFSD组小鼠体重增量增加不明显,差异不显著 (表 1)。注射STZ前,KO组小鼠每只每日进食热能均高于WT组,注射STZ且相应饲料喂养3周后,HFSD组KO小鼠每只每日进食热能比WT组有所增加,NC组差异不明显。在注射STZ前,KO组小鼠空腹血糖低于WT组,KO-NC组和WT-HFSD组小鼠空腹血糖与WT-NC组相比,具有统计学意义 (P<0.05)。注射STZ且相应饲料喂养3周后,HFSD组小鼠空腹血糖高于NC组,且空腹血糖≥11.1 mmol/L, KO-NC组和WT-HFSD组小鼠空腹血糖与WT-NC组相比,具有统计学意义 (P<0.05)。
| 表 1 注射STZ前后各组小鼠体重的增量、每日进食热能、血糖的变化 (x±s) |
在注射STZ后与注射STZ前相比,NC组小鼠体重增量无明显变化,HFSD组小鼠体重增量减少,但是差异不显著 (表 1)。NC组小鼠进食热能无明显变化,HFSD组小鼠每只每日进食热能比之前都有所增加。HFSD组小鼠空腹血糖比之前都有所增加,且空腹血糖≥11.1 mmol/L, 具有统计学意义 (P<0.05)。
在6周的HFSD且注射STZ诱导小鼠2型糖尿病成模后,KO-HFSD组与WT-HFSD组相比,肝脏重量相差具有统计学意义 (P<0.05)。KO-HFSD组与WT-HFSD组,KO-NC组与WT-NC组相比,胰腺重量相差具有统计学意义 (P<0.05),其他脏器重量差异无明显差异 (表 2)。
| 表 2 小鼠脏器重量 |
各组小鼠在实验中,NC组小鼠生长活跃, 皮毛光泽, 体重增加, 反应良好, 精神佳, 无死亡。无论是KO还是WT组,HFSD组小鼠明显精神不振, 反应迟缓, 瘦小, 皮毛无光泽, 部分还有烂尾, 糖尿病的“三多一少”症状明显,且空腹血糖≥11.1 mmol/L,两组之间差异不明显。
综上所述,说明高脂高糖饮食加低剂量链脲佐菌素建立小鼠2型糖尿病模型成功。
2.2 避暗实验在第1天的训练期,潜伏期在各组之间无明显差异,在第2天的测验期和第5天的消退期,潜伏期在各组之间有明显差异,无论是NC组还是HFSD组,KO组均高于WT组,且KO-HFSD低于KO-NC, WT-HFSD低于WT-NC,但第2天的测验期,KO-HFSD与WT-HFSD相比,潜伏期延长,且具有统计学意义 (P<0.05)(图 1A)。在训练期,测验期和消退期,训练错误次数WT组均高于KO组,且KO-HFSD高于KO-NC, WT-HFSD高于WT-NC, 但差异不显著 (图 1B)。说明CYP1B1基因敲除可改善小鼠2型糖尿病造成的认知功能损害,对2型糖尿病小鼠的学习记忆能力有保护作用。
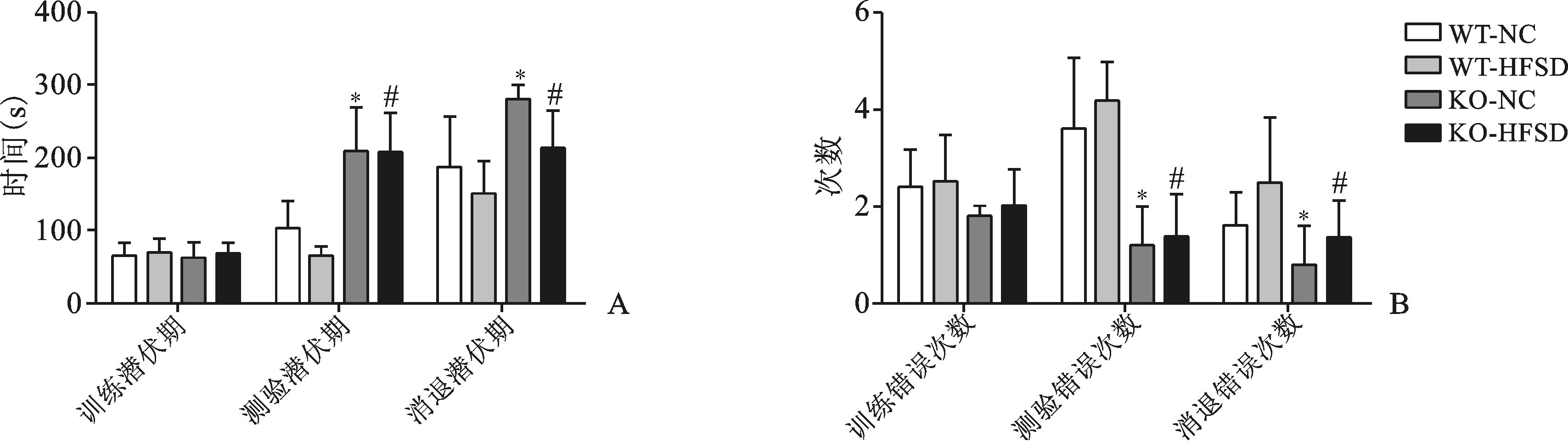
|
图 1 CYP1B1基因敲除对小鼠神经行为学的影响 A:CYP1B1基因敲除对小鼠被动回避反应避暗实验潜伏期的影响;B:CYP1B1基因敲除对小鼠被动回避反应避暗实验错误次数的影响;与WT-NC组比较,*P<0.05;与WT-HFSD组比较,#P<0.05,n=7 |
5天水迷宫实验显示,随着训练天数的延长,各组小鼠逃避潜伏期均呈缩短趋势,表明小鼠空间学习记忆能力随训练次数增加而增强。HFSD诱导的WT小鼠第3天到第5天的潜伏期显著高于NC组,说明学习能力明显受损 (P<0.05)。无论HFSD还是NC,KO小鼠的逃避潜伏期均较短 (图 2A)。空间搜索实验测试小鼠的记忆能力,KO组小鼠在原平台象限的时间明显长于WT组,且KO-HFSD组小鼠在原平台象限的时间明显长于WT-HFSD组 (图 2B), 表明CYP1B1基因敲除可改善小鼠2型糖尿病造成的认知功能损害,对2型糖尿病小鼠的学习记忆能力有保护作用。

|
图 2 CYP1B1基因敲除对小鼠神经行为学的影响 A:CYP1B1基因敲除对小鼠水迷宫定位航行实验的逃避潜伏期的影响;B:CYP1B1基因敲除对小鼠水迷宫空间搜索实验的原平台所在象限时间的影响;与WT-NC组比较,*P<0.05;与WT-HFSD组比较,#P<0.05,n=7 |
本实验首次发现CYP1B1基因敲除可改善小鼠2型糖尿病造成的认知功能损害,对2型糖尿病小鼠的学习记忆能力有保护作用。各组小鼠在实验中,NC组小鼠生长活跃, 皮毛光泽, 体重增加, 反应良好, 精神佳, 无死亡。无论是KO还是WT组,HFSD组小鼠明显精神不振, 反应迟缓, 瘦小, 皮毛无光泽, 部分还有烂尾, 糖尿病的“三多一少”症状明显,且空腹血糖≥11.1 mmol/L,两组之间差异不明显, 说明高脂高糖饮食加低剂量链脲佐菌素建立小鼠2型糖尿病模型成功。水迷宫中,WT小鼠在定位航行实验中找到平台的潜伏期比KO小鼠延长,空间搜索实验中,KO小鼠在目标象限的游泳时间比WT小鼠显著延长;在避暗实验中,WT小鼠在测验期和消退期潜伏期比KO小鼠显著缩短且出错次数增加;这些实验结果说明在STZ和高脂高糖诱导的小鼠2型糖尿病模型中,CYP1B1基因的缺失对糖尿病诱导的认知损害有保护作用。
有关糖尿病与认知损伤的研究很多[7],具体的机制涉及到氧化应激和炎症反应等[8],但目前氧化应激是比较公认的机制[9]。P450家族可以产生诱导有机体突变的代谢物,并可以产生活性氧簇,从而进一步导致氧化应激和细胞凋亡。有研究显示,抑制CYP1B1会同时降低氧化应激水平和JNK信号,而JNK信号通路在氧化应激中是最显著的。也有研究结果表明,CYP1B1代谢细胞产物从而调节细胞内的氧化应激水平,并且CYP1B1的缺失会引起内皮细胞内氧化应激水平升高。CYP家族和认知功能的关系也得到部分研究的证实,例如CYPs代谢睾丸激素和雌二醇,这些物质属于神经活性类固醇,对认知和记忆有一定的影响;当敲除小鼠脑专属的CYP46A1基因时,会降低脑内的胆固醇水平,并且在人体中CYP46A1的多态性与认知损害有一定的联系[2]。
我们的前期研究表明,CYP1B1敲除对高脂膳食诱导的氧化应激有抑制作用 (待发表),因此,CYP1B1敲除对认知功能的保护作用可能与其对机体氧化应激的调节有关。然而,认知行为是一个复杂的神经行为学过程,受动物大脑多种结构和分子的共同调控,因此CYP1B1基因敲除如何影响认知功能的机制有待进一步研究。
| [1] | Xu ZP, Yang SL, Zhao S, et al. Biomarkers for early diagnostic of mild cognitive impairment in type-2 diabetes patients: A multicentre, retrospective, nested case-control study[J]. EBioMedicine, 2016, 5: 105-113. DOI: 10.1016/j.ebiom.2016.02.014. |
| [2] | Lorbek G, Lewinska M, Rozman D. Cytochrome P450s in the synthesis of cholesterol and bile acids-from mouse models to human diseases[J]. FEBS J, 2012, 279(9): 1516-1533. DOI: 10.1111/j.1742-4658.2011.08432.x. |
| [3] |
吴连希, 邱高坤, JefcoateCR, 等. 脂肪组织炎症在CYP1B1基因敲除抑制小鼠营养性肥胖及其胰岛素抵抗中的作用[J].
环境与健康杂志, 2011, 28(6): 479-482.
Wu LX, Qiu GK, Jefcoate CR, et al. Effect of adipose tissue inflammation on nutritive obesity and insulin resistance in CYP1B1 knockout mice[J]. Journal of Environment and Health, 2011, 28(6): 479-482. |
| [4] |
唐雨萌. 肥胖引起的氧化应激与认知功能: 中国老龄化与健康高峰论坛——关注老年营养和长寿[C]. 上海: 2014.
Tang YM.Oxidative stress and cognitive function induced by obesity: China Aging and Health Forum-Concerned about nutrition and longevity of the aged[C].Shanghai: 2014. |
| [5] |
王俊亚, 张冬梅. Morris水迷宫实验的测试方法介绍及注意事项[J].
现代医药卫生, 2012, 28(21): 3289-3290.
Wang JY, Zhang DM. Morris water maze test method of introduction and precautions[J]. Modern Medicine and Health, 2012, 28(21): 3289-3290. |
| [6] |
王莹, 杨文微, 罗菊花. 避暗实验测定小鼠学习记忆功能方法的研究[J].
大理学院学报:综合版, 2011, 10(6): 25-27.
Wang Y, Yang WW, Luo JH. Study on the method of avoiding learning and memory in mice by dark experiment[J]. Journal of Dali University, 2011, 10(6): 25-27. |
| [7] |
时夏捷, 张育仁, 牛宏涛, 等. 2型糖尿病患者认知功能障碍与肾微血管病变的相关性研究[J].
中南大学学报:医学版, 2016, 41(2): 143-150.
Shi X, Zhang Y, Niu H, et al. Correlation between cognitive impairment and diabetic nephropathy in patients with Type 2 diabetes mellitus[J]. Journal of Central South University: Medical Science, 2016, 41(2): 143-150. |
| [8] | Muriach M, Flores-Bellver M, Romero FJ, et al. Diabetes and the brain: oxidative stress, inflammation, and autophagy[J]. Oxid Med Cell Longev, 2014, 2014: 102158. |
| [9] | Wang X, Zhao L. Calycosin ameliorates diabetes-induced cognitive impairments in rats by reducing oxidative stress via the PI3K/Akt/GSK-3beta signaling pathway[J]. Biochem Biophys Res Commun, 2016, 473(2): 428-434. DOI: 10.1016/j.bbrc.2016.03.024. |
 2017, Vol. 38
2017, Vol. 38

