Stanford A型主动脉夹层手术处理弓降部时需要停循环,因此脑保护极为重要。单纯深低温停循环(deep hypothermia circulatory arrest,DHCA)时脑部无血流灌注,逆行灌注不符合生理且脑部血流量极小,顺性脑灌注(antegrade cerebral perfusion,ACP)符合生理,是应用最广的脑保护方法,但到底哪一种更为合适,目前没有定论[1]。2008年1月-2014年1月急性复杂型Stanford A型主动脉夹层共120例,其中采用单侧脑灌注技术51例、双侧脑灌注技术69例,比较两组病人的死亡率及并发症率,旨在评价两种灌注技术的安全性及实用性。
1 资料与方法 1.1 临床资料 1.1.1 一般资料年龄19-72岁,平均(50.4±6.3)岁。男75例,女45例。突发胸背部或心前区撕裂样疼痛或胀痛115例,右颌下、右颈部疼痛3例,头昏、头痛2例。病程1 h-9 d。合并高血压105例、主动脉瓣关闭不全68例(其中马方综合征43例)、胸腔或心包腔积液54例、糖尿病25例、急性肾功能不全25例、冠状动脉受累4例,右肾上腺皮质腺瘤1例。均通过CTA扫描或核磁共振(MRI)及超声心动图(UCG)检查确诊:A1C型47例、A2C型18例、A3C型55例[2]。UCG提示主动瓣中重度关闭不全63例;升主动脉内均见强回声光带,升主动脉直径3.0-6.2 cm,平均(4.2±0.8) cm;左室射血分数(LVEF)0.35-0.60,平均0.45±0.10。术前心功能Ⅱ级57例,Ⅲ级59例,Ⅳ级4例。心电图检查左室增大伴劳损54例、心房纤颤28例、ST段及T波改变18例、右束支传导阻滞者13例、Ⅰ度房室传导阻滞7例。胸部X线显示上纵隔增宽66例。术前合并心脑血管系统疾病,如巨大左心室、左心房血栓、冠状动脉多支中重度狭窄、既往脑卒中病史者,未纳入资料(表 1)。
| 表 1 单、双侧脑灌注组临床资料比较 |
均使用Stockert Ⅲ型体外循环机、进口成人膜肺。
1.1.3 预充液成分根据体重和血液稀释分别预充库血及下列药物:浓缩红细胞、血浆、平衡液、20%白蛋白、甲基强的松龙、20%甘露醇,25%硫酸镁,5%碳酸氢钠、10%氯化钾、抗生素、肝素等,总预充量1 500 ml。
1.2 手术方法 1.2.1 体外循环及脑保护所有病人均选择胸骨正中切口、气管插管静脉复合全麻及深低温停循环、脑部低流量顺行灌注下完成手术。56例升主动脉心包反折处插供血管、64例右锁骨下动脉(RSA)插供血管,右心房插二阶梯管建立体外循环。并体循环下均匀降温至鼻咽温度28 ℃、阻断升主动脉、经左右冠状动脉开口灌注1:4冷心肌停搏液(15-20 ml/kg),心包内置冰屑,完成主动脉近端手术。温度降至鼻咽温18-20 ℃、肛温20-23 ℃时停循环,头低位,51例单侧脑灌注者阻断头臂干、左颈总动脉(LCA)、LSA,经RSA脑部低流量灌注[5-6 ml/(kg·min)];69例采用双侧脑灌注者切开主动脉弓部分别于头臂干及LCA开口插入供血管,生理盐水充盈球囊,通过“Y”接口与动脉供血管路相连,调整流量为6-8 ml/(kg·min)、灌注压力40-50 mmHg,开始双侧顺行脑灌注。停循环状态下完成远端支架象鼻手术,逐步恢复流量完成主动脉弓分支吻合及人工血管近段吻合。术中全程监测电解质及动、静脉血气分析、HCT、ACT,采用pH稳态进行血气管理,HCT维持于0.25-0.30。待SvO2上升至90%以上氧债偿还完全后逐步复温,复温时鼻咽温与水温温差小于6 ℃,鼻咽温度与直肠温度小于3 ℃,复温后常规改良超滤。复温过程应避免血压波动过大,维持平均动脉压(MAP)50-70 mmHg。
1.2.2 手术方法所有病人均行升主动脉置换、全主动脉弓置换及降主动脉内支架“象鼻”植入术。根据主动脉近段病变,A1C型夹层行单纯升主动脉人工血管置换术共39例、合并中重度主动脉瓣关闭不全行Wheat手术8例;A2C型夹层根据主动脉窦部累及情况行部分窦部成形术14例、David手术4例;A3C型行主动脉根部置换术(Bentall手术)55例。远端停循环、脑灌注,降主动脉真腔置入支架“象鼻”,根据术前CTA选择超过主动脉内径10%的支架人工血管。本组支架人工血管直径26-32 mm、长度80-100 mm。支架近端缝合固定支架后与四分支血管远端吻合,阻断四分支血管主干及各分支,通过灌注分支供血恢复循环。四分支人工血管远端吻合完成后即通过灌注分支恢复2/3全流量,依次吻合主动脉弓部三大分支,吻合一支开放一支。左锁骨下动脉位置深、显露差者术中支架象鼻近端覆膜部分行“开窗”术。各分支吻合口完成后,恢复全流量,匀速复温。排气后开放主动脉,继续复温、辅助循环,28-30 ℃心脏除颤复跳(10-20 W/s),鼻咽温度37 ℃、循环稳定后停机。术中合并冠状动脉旁路移植术4例、联合泌尿外科行右肾上腺皮脂腺瘤切除术1例(表 2)。
| 表 2 单、双侧脑灌注组术中资料比较 |
临床资料原始数据来自本院住院和门诊病历。采用Epidata 3.0软件建立数据库,将数据化资料采用Windows office 2007的Excel软件进一步整理。用SPSS 19.0软件进行统计分析,正态分布数据以均数±标准差(x±s)表示,组间均数比较采用t检验、u检验及Fisher精确概率法,P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果平均体外循环时间(168±44) min,平均心肌阻断时间(86±24) min,选择性脑灌注时间(38±8) min。无主动脉破裂、血栓脱落及假腔灌注等插管相关并发症发生。1例术中心脏不复跳,探查心表见前降支中段条索状改变,取大隐静脉行冠状动脉旁路移植术后顺利脱机。住院期间死亡6例,其中急性肾功能衰竭3例、肺部感染2例、偏瘫并发多器官功能衰竭1例。术后短暂性神经功能障碍26例、胸腔积液18例、肺部感染18例、二次开胸止血10例、急性肾功能衰竭行床边透析10例、气管切开10例、再次气管插管8例、伤口感染8例、声音嘶哑5例、延迟关胸3例、偏瘫4例、截瘫1例。出院前复查CTA 108例:主动脉、颈部分支及冠状动脉血流通畅,人工血管无扭曲,吻合口处造影剂无外渗,无显著内漏发生。
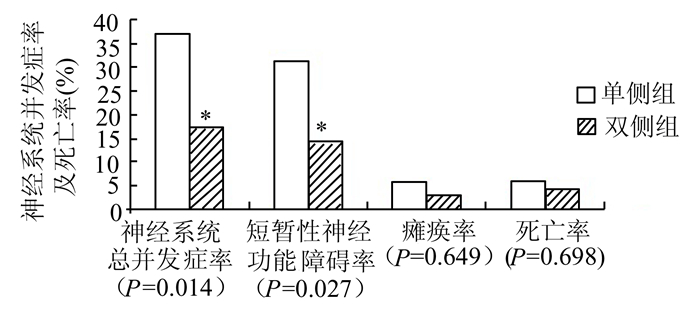
单侧脑灌注组死亡3例,死亡率5.88%(3/51);术后出现神经系统并发症19例,并发症率37.25%(19/51)。双侧脑灌注组死亡3例,死亡率4.35%(3/69);术后出现神经系统并发症12例,并发症率17.39%(12/69)。两组死亡率比较,P>0.05;神经系统并发症率比较,P<0.05(图 1)。
|
图 1 单、双侧脑灌注组中枢神经功能障碍发生率和死亡率比较(%) |
104例随访时间12-84月,平均(45.5±16.4)个月,10例失访:5例声音嘶哑者基本恢复;4例腹主动脉夹层动脉瘤,其中2例行人工血管置换术,另2例随诊观察;7例住院期间肾功能衰竭病人中,2例转为慢性肾功能衰竭,需定期行透析治疗,另5例肾功能正常;3例肢体偏瘫者2例肌力分别恢复为Ⅲ-Ⅳ级、Ⅱ-Ⅲ级,1例未恢复;1例截瘫者未恢复。104例均复查主动脉CTA,少量Ⅱ型内漏3例、左侧胸腔积液6例,除2例中量积液谨慎胸穿外,其余病例未作处理。
3 讨论脑损伤是主动脉弓部重建手术最严重的致残致死因素之一,尤其是主动脉夹层累及主动脉弓降部,术中如何进行脑保护极为关键。脑保护方法分为单纯深低温、顺性脑灌注及逆行脑灌注三种,Stanford A型主动脉夹层手术停循环时间长,单纯深低温不能提供安全有效的脑保护效果,目前最常用的方法是顺行选择性脑灌注[1],其中单侧脑灌注受到许多外科医生推崇,动脉血通过右锁骨下动脉或右腋动脉插管、经右椎动脉和右颈总动脉顺行灌注右侧脑部,并通过大脑动脉环、少量经颈面部进入左侧脑部,认为单侧脑灌注安全简单、操作方便、流量足够,可使脑部均匀降温,维持脑组织自身调节功能,延长脑缺血时的“安全时间”,既可满足全身循环需要,又便于停循环时实施脑保护[3]。他们认为头臂干(或右颈总动脉)和左颈总动脉双侧顺行脑灌注常需要在病变的主动脉弓分支血管上插管,容易造成动脉壁撕裂、粥样斑块或血栓脱落,而且动脉血流还与插管头端的位置是否合适有关,操作复杂,体外循环技术复杂。
事实上,脑血管存在诸多变异。Papantchev等研究发现,左侧或双侧后交通动脉发育不全或异常发生率占26.6%,前交通动脉发育不全或异常发生率占2.4%,前交通动脉和左侧后交通动脉发育不全或异常发生率占3.6%,右椎动脉或左侧大脑后动脉发育不全或异常发生率占7.2%,右大脑前动脉发育不全或异常发生率占7.2%,右椎动脉和大脑前动脉发育不全或异常发生率占1.2%,总变异率高达58.6%[4]。Willis环如此之高的变异率,即使有深低温作保护,单侧脑灌注依然会存在巨大隐患。Harrer等对同一组病人开始采用单侧脑灌注,后来改为双侧脑灌注,结果发现单侧灌注时左侧大脑半球处于低灌注状态,而改为双侧灌注后脑血氧饱和度由44.0%±7.9%上升到63.0%±5.0%,差别显著[5]。Pietro等认为停循环时间低于40-50 min,单、双侧脑灌注效果相似;一旦停循环时间超过40 min,双侧脑灌注更加安全[6]。临床上了解Willis环及其侧支循环是否完整首选CTA,其次是MRA和脑血管造影。Stanford A型主动脉夹层病情凶险,术前任何检查均存在较大风险,CTA、MRA可能导致造影剂肾病,尤其是术前肾动脉已受夹层累及的病人,MRA不适用于不能较长时间屏气的病人,脑血管造影增加夹层破裂的风险,都应该尽量避免。与单侧顺行性脑灌注比较,采用双侧顺行性脑灌注,术前无需冗余的检查过程,大大降低术前夹层破裂风险,又能保证Willis环发育不全的患者左右大脑半球的血供,避免单侧脑灌注右脑优势灌注而左脑灌注不足的弊端,更符合生理。本组病人采用双侧脑灌注技术69例,和同期单侧脑灌注51例相比,虽然两组死亡率及瘫痪率无统计学差异,但神经系统总并发症率及短暂性神经功能障碍率均明显降低(P分别为0.014和0.027),脑保护效果更加确实、可靠。分析死亡率及瘫痪率无明显差异的原因,可能与样本小及停循环时间较短有关,单、双侧组病人平均停循环时间均不超过40 min,导致差别不显著,也与Pietro研究结果一致[6]。
本组采用的双侧脑灌注技术,与传统技术有所不同。传统双侧选择性顺行脑灌注为多向插管(先行股动脉插管),需双泵灌注,体外循环技术复杂。本组改良双侧选择性顺行脑灌注为单泵多管,供血管在降温过程中灌注全身,停循环后切开主动脉弓部后直视下于头臂干及左颈总动脉腔内插管,视野清楚,避免了传统双侧插管可能导致夹层破裂、血栓或动脉粥样硬化斑块脱落的风险,通过“Y”形接头连接将双侧脑灌注管及灌注分支插管由单泵控制进行灌注,可以通过单泵多管实现经头臂干、左颈总动脉及人工血管灌注分支分别行脑及下半身同时灌注,由于机体自身血管舒缩改变血管阻力,可自动调节各分支血管流量,减少了体外循环管道,使体外循环操作技术更加简化。改良双侧顺行脑灌注管质地柔软,可根据手术进程调整管道位置,方便手术操作。因此,双侧脑灌注术中体外循环时间、心肌阻断时间及脑灌注时间均并无明显延长,技术简单、可行。
总之,与单侧脑灌注相比,双侧脑灌注技术更加安全,适用于所有病人,而无论Willis环是否完整,可避免术前过多检查,降低围术期夹层破裂风险,且不受脑灌注时间的限制,手术及体外循环管理技术也并不复杂,值得临床推广应用。
| [1] | Tian DH, Wan B, Bannon PG, et al. A meta-analysis of deep hypothermic circulatory arrest alone versus with adjunctive selective antegrade cerebral perfusion[J]. Ann Cardiothorac Surg, 2013, 2(3): 261-270. |
| [2] | 孙立忠, 刘宁宁, 常谦, 等. 主动脉夹层的细化分型及其应用[J]. 中华外科杂志, 2005, 43(18): 1171-1176. |
| [3] | Misfeld M, Leontyev S, Borger MA, et al. What is the best strategy for brain protection in patients undergoing aortic arch surgery? Asingle center experience of 636 patients[J]. Ann Thorac Surg, 2012, 93(5): 1502-1508. DOI: 10.1016/j.athoracsur.2012.01.106. |
| [4] | Papantchev V, Stoinova V, Aleksandrov A, et al. The role of Willis circle variations during unilateral selective cerebral perfusion: a study of 500 circles[J]. Eur J Cardiothorac Surg, 2013, 44(4): 743-753. DOI: 10.1093/ejcts/ezt103. |
| [5] | Harrer M, Waldenberger FR, Weiss G, et al. Aortic arch surgery using bilateral antegrade selective cerebral perfusion in combination with near-infrared spectroscopy[J]. Eur J Cardiothorac Surg, 2010, 38(5): 561-567. DOI: 10.1016/j.ejcts.2010.03.016. |
| [6] | Pietro GM, Giuseppe S, Nicola V. Is unilateral antegrade cerebral perfusion equivalent to bilateral cerebral perfusion for patients undergoing aortic arch surgery[J]. Interactive CardioVascular and Thoracic Surgery, 2008(7): 891-897. |
 2016, Vol. 37
2016, Vol. 37

 ,
,