2. 武汉大学人民医院 肿瘤中心, 湖北 武汉 430060
2. Dept. of Cancer Center, Renmin Hospital of Wuhan University, Wuhan 430060, China
巨噬细胞是一群异质性细胞, 在体内复杂的微环境中, 表现出独特的表型和功能[1, 2]。与T细胞一样,巨噬细胞在近年来也被分类为具有不同功能的细胞亚群。巨噬细胞在体内主要有两种经典的活化表型:经典活化型 (classically activated macrophages, M1) 和替代活化型 (alternatively activated macrophages, M2)。M1型巨噬细胞通过分泌促炎细胞因子和趋化因子,上调MHC抗原的表达,增强抗原呈递能力,参与正向免疫应答,具有IL-12high/IL-10low的表型特征。M2型巨噬细胞则具有较弱抗原提呈能力,并通过分泌抑制性细胞因子IL-10或TGF-β等下调免疫应答,抑制细胞对病原体的杀伤,促进组织修复和重构[3],具有IL-12low/IL-10high的表型特征。
巨噬细胞的促炎因子和抗炎因子的平衡在了解免疫系统如何应答病原感染中起到关键作用[4]。炎性因子的表达调控主要在于研究转录因子如何调控基因启动子活性。在巨噬细胞中,促炎因子的表达机制较为类似,然而抗炎因子的基因调控仍有待研究[5]。IL-12基因的诱导型启动子已有相继报道,可由类似的转录因子家族包括c-Rel,C/EBP,AP-1等转录因子调控[6, 7]。IL-10抑制炎性细胞因子的合成,促进Th2应答,但是其在巨噬细胞极化中的调控机制仍待解析。
本研究拟通过合成调控IL-12和IL-10表达的启动子序列,与pGL3-Basic空白载体连接构建pGL3-IL-12p40 promoter和pGL3-IL-10 promoter两个荧光素酶报告基因载体,用于探讨肿瘤相关巨噬细胞中的关键因子 (TGF-β家族及其下游靶基因) 调控IL-12和IL-10表达的分子机制和信号传导途径,并为以巨噬细胞极化为靶标的抗肿瘤药物的快速高通量的筛选提供研究工具。
1 材料与方法 1.1 材料 1.1.1 菌株、细胞和质粒大肠杆菌E.coli DH5α购自天根生化科技 (北京) 有限公司;Balb/C小鼠购于武汉大学实验动物中心;小鼠单核-巨噬细胞系RAW264.7、pGL3-Basic载体、pRL-TK载体由中山大学药学院微生物与生化药学实验室惠赠。
1.1.2 主要试剂RPMI 1640培养基、胎牛血清购置于Gibco公司;PCR反应试剂盒、Ex Taq DNA聚合酶、限制性内切酶 (Mlu Ⅰ、Bgl Ⅱ、Xho Ⅰ)、T4 DNA连接酶、DNA marker购置于大连宝生物有限公司;质粒小量提取试剂盒、琼脂糖凝胶回收试剂盒、PCR产物回收试剂盒购置于天根生化科技 (北京) 有限公司;AxyPrep基因组DNA小提试剂盒购于上海百赛生物技术有限公司;转染试剂Lipofectamine 2000购置于Invitrogen公司;双荧光素酶报告基因活性检测试剂盒购置于Promega公司。
1.2 方法 1.2.1 IL-12基因启动子生物信息学分析根据UCSC中小鼠全基因组序列,选取小鼠IL-12基因 (MGI:96540) 转录起始位点上游800 bp到下游55 bp为此次构建的启动子序列,其中包含ETS (-218/-213), NF-κB (-131/-122) 和C/EBP (-96/-88) 等结合位点[8]。选取小鼠IL-10基因 (MGI:96537) 转录起始位点上游1 538 bp到下游64 bp为启动子区域,其中包含CREB1(-514/-507), NF-κB (-487/-447) 和C/EBP (-396/-386)[9]。
1.2.2 引物设计和合成根据PCR引物设计原则和Gen Bank中小鼠IL-12p40和IL-10基因序列,应用Primer Premier 5.0软件设计引物:IL-12p40启动子上游引物加入MluⅠ酶切位点 (ACGCGT),下游引物加入Bgl Ⅱ酶切位点 (AGATCT),并分别在上游和下游引物的5′端加上保护碱基;IL-10启动子上游引物加入MluⅠ酶切位点 (ACGC GT),下游引物加入XhoⅠ酶切位点 (CTCGAG)。引物由上海英潍捷基有限公司合成,引物序列如表 1所示。
| 表 1 小鼠IL-12、IL-10启动子引物序列表 |
取6周左右Balb/C小鼠,脱颈处死,获得新鲜脾脏组织。将脾脏置于在200目滤网上研磨,制得单细胞悬液。1 500 r/min离心5 min后,以红细胞裂解液破除红细胞,PBS洗涤3次后,将细胞悬液置于10% FBS的RPMI 1640中过夜培养;培养24 h后,收集悬浮T细胞,用于基因组DNA的提取。提取步骤参考AxyPrep基因组DNA小量试剂盒。
1.2.4 小鼠IL-12p40和IL-10启动子区序列扩增以提取的基因组DNA为模板,用IL-12p40 F/R和IL-10 F/R两对引物 (见表 1),分别扩增IL-12p40启动子和IL-10启动子序列。扩增体系为:Ex Taq DNA聚合酶0.125 μl、10×缓冲液2.5 μl、dNTP mix 2 μl、模板DNA 2 μl、引物Forward 1 μl、引物Reverse 1 μl、灭菌双蒸水16.375 μl。反应条件为:95 ℃预变性5 min,95 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸1 min 30 s,扩增30个循环,72 ℃最后延伸10 min,16 ℃结束反应。取5 μl PCR产物于1%琼脂糖凝胶中,在100 V电压下电泳,凝胶成像系统上观察电泳结果。
1.2.5 小鼠IL-12p40和IL-10启动子荧光素酶报告基因载体的构建与鉴定分别从琼脂糖凝胶中切除需回收的PCR产物电泳条带IL-12p40 promoter和IL-10 promoter,用胶回收试剂盒对PCR反应产物进行纯化,纯化后再次进行琼脂糖凝胶电泳确认。确认后将IL-12p40 promoter和pGL3-Basic载体用Mlu Ⅰ、Bgl Ⅱ双酶切, 而将IL-10 promoter和pGL3-Basic载体用Mlu Ⅰ、Xho Ⅰ双酶切。胶回收试剂盒纯化酶切产物,将上述制备的IL-12p40和IL-10启动子片段与线性化双黏性末端的pGL3-Basic载体片段以3:1摩尔比用T4 DNA连接酶连接。体系置于冷循环水浴中16 ℃连接反应过夜。分别将连接产物转化感受态细菌DH5α后,经氨苄青霉素抗性筛选。挑取8个单菌落,接种于5 ml Amp+ LB培养基过夜培养,提取质粒后进行双酶切鉴定,以鉴定目的片段是否转入。将经过鉴定的阳性克隆菌落摇菌,小提质粒后测序鉴定。重组载体命名为pGL3-IL-12p40 promoter和pGL3-IL-10 promoter。
1.2.6 细胞培养及转染小鼠单核巨噬细胞RAW 264.7在含10%胎牛血清的RPMI 1640培养基中培养,培养条件为37 ℃、5% CO2,相对湿度95%。细胞用0.1%胰蛋白酶-EDTA进行消化传代。转染前1 d,以2×104个/ml的细胞密度接种到96孔培养板上。待细胞汇合率到达80%-90%时进行转染。细胞转染按照转染试剂Lipofectamine 2000说明书进行。在96孔板中分别转染pGL3-IL-12p40 promoter或pGL3-IL-10 promoter报告质粒与内参质粒pRL-TK,分别用20 ng/ml IFN-γ和20 ng/ml IL-4刺激,并设阴性对照组,在37 ℃、5%的CO2中培养24 h后检测荧光素酶的表达情况。
1.2.7 报告基因荧光素酶活性检测将96孔板转染了荧光素酶报告基因的RAW 64.7细胞培养上清吸弃,每孔加入75 μl的裂解液,室温裂解15 min,收集细胞裂解液,转移至96孔板白板中,采用荧光检测仪检测萤火虫荧光。计算报告质粒与内参质粒的荧光素酶活性比值,即相对荧光素酶活性。具体步骤参照仪器及试剂说明书。
1.2.8 报告基因模型应用于巨噬细胞活化相关分子的筛选以2×104个/ml的细胞密度将小鼠单核巨噬细胞RAW 264.7细胞接种入96孔板中,利用Lipofectamine 2000在96孔板中分别转染pGL3-IL-12p40 promoter或pGL3-IL-10 promoter报告基因与内参质粒pRL-TK,设置实验组如下:①TGF-β(20 ng/ml) 刺激组;②Nodal刺激组 (100 ng/ml);③过表达FOXO3a组;④过表达Snail组,并设置对应阴性对照组,24 h后检测荧光素酶的表达情况。
1.3 统计学处理所有数值均以三次独立实验的x±s表示。两组间的比较采用双尾不配对t检验。数据处理采用GraphPad Prism 5软件处理分析,P<0.05为差异有统计学意义。
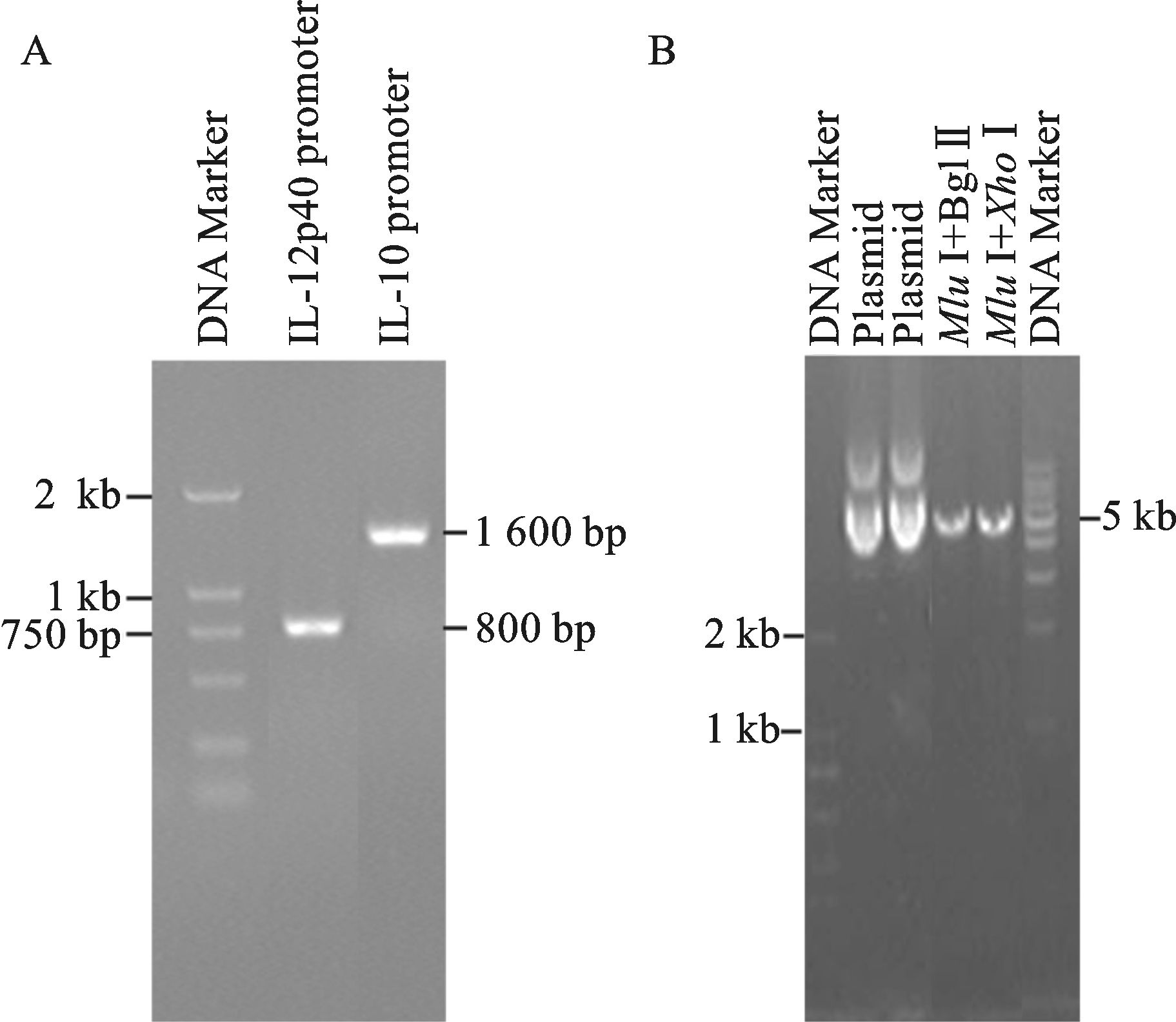
2 结果 2.1 PCR扩增小鼠IL-12p40和IL-10启动子序列以T细胞提取的全基因组DNA为模板,克隆出2段序列,分别为IL-12p40启动子序列 (855 bp)、IL-10启动子序列 (1 603 bp)。取部分PCR产物进行凝胶电泳,显示扩增条带大小略高于750 bp位置,与目的基因理论大小855 bp相符,提示IL-12p40启动子已扩增成功;而IL-10启动子PCR产物显示扩增条带在1-2 kb之间,与目的基因理论大小1 603 bp相符,提示IL-10启动子已扩增成功,见图 1A。目的基因与载体pGL3-Basic都分别用限制性内切酶Mlu Ⅰ/Bgl Ⅱ或MluⅠ/XhoⅠ双酶切,形成黏性末端。载体经双酶切后,取部分进行凝胶电泳,在5 kb大小附近,发现一条明亮的条带,与载体预期大小一致,见图 1B。
|
图 1 小鼠IL-12p40和IL-10基因启动子序列PCR产物凝胶电泳 |
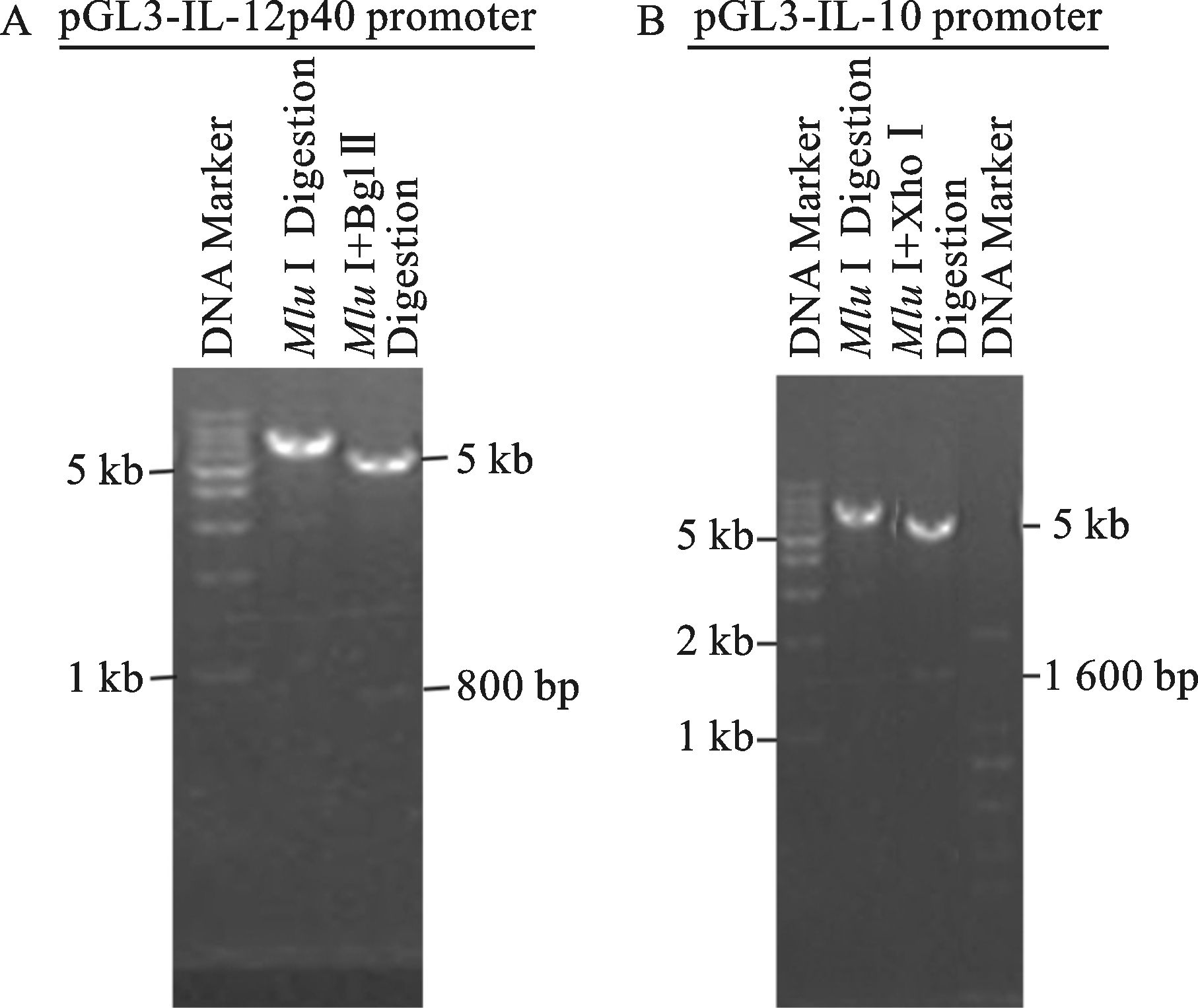
将双酶切回收的IL-12p40 promoter和IL-10 promoter分别与pGL3-Basic在含有连接酶的10 μl连接体系中16 ℃连接过夜,连接产物转化DH5α感受态细菌中,挑取单克隆后提取质粒,进行Mlu Ⅰ+Bgl Ⅱ或Mlu Ⅰ+Xho Ⅰ双酶切鉴定。理论上会出现855 bp/4 793 bp和1 603 bp/4 801 bp两组条带,实际结果与之相符 (图 2),初步判定其为阳性克隆。进一步测序结果与Gen Bank里小鼠IL-12p40和IL-10启动子序列进行BLAST比对后完全一致,证明pGL3-IL-12p40 promoter和pGL3-IL-10 promoter荧光素酶报告基因构建成功。
|
图 2 重组质粒pGL3-IL-12p40 promoter和pGL3-IL-10 promoter质粒的鉴定 |
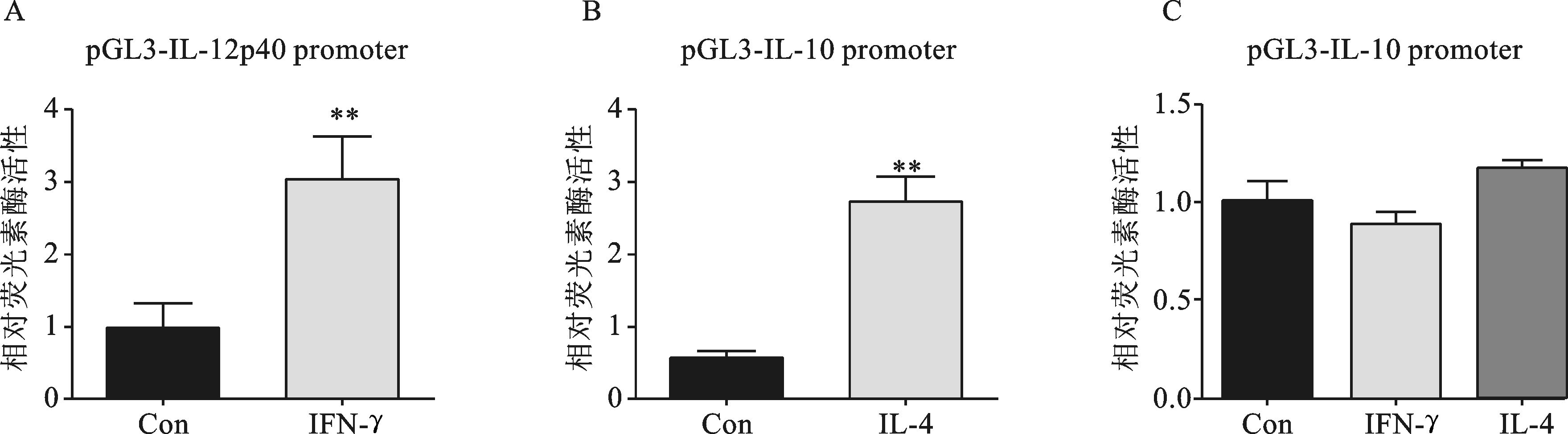
将构建好的重组质粒pGL3-IL-12p40 promoter,pGL3-IL-10 promoter和空白对照pGL3-Basic分别与内参质粒pRL-TK按4:1的比例转入RAW264.7细胞,分别加入或者不加入IFN-γ或IL-4刺激,在37 ℃,5% CO2中培养24 h后检测荧光素酶的表达情况。结果显示 (图 3),IFN-γ能显著增强pGL3-IL-12p40 promoter的表达活性,IL-4能显著增强pGL3-IL-10 promoter荧光素酶的表达活性,但是IFN-γ或IL-4并不影响空白质粒pGL3-Basic的荧光素酶活性,说明IL-12 promoter和IL-10 promoter序列已经准确插入到了荧光素酶基因上游,已经成功构建了具有生物活性的重组质粒pGL3-IL-12p40 promoter和pGL3-IL-10 promoter。
|
图 3 重组质粒pGL3-IL-12p40 promoter (A) 和pGL3-IL-10 promoter (B) 的活性鉴定 与Con组相比,**P<0.01 |
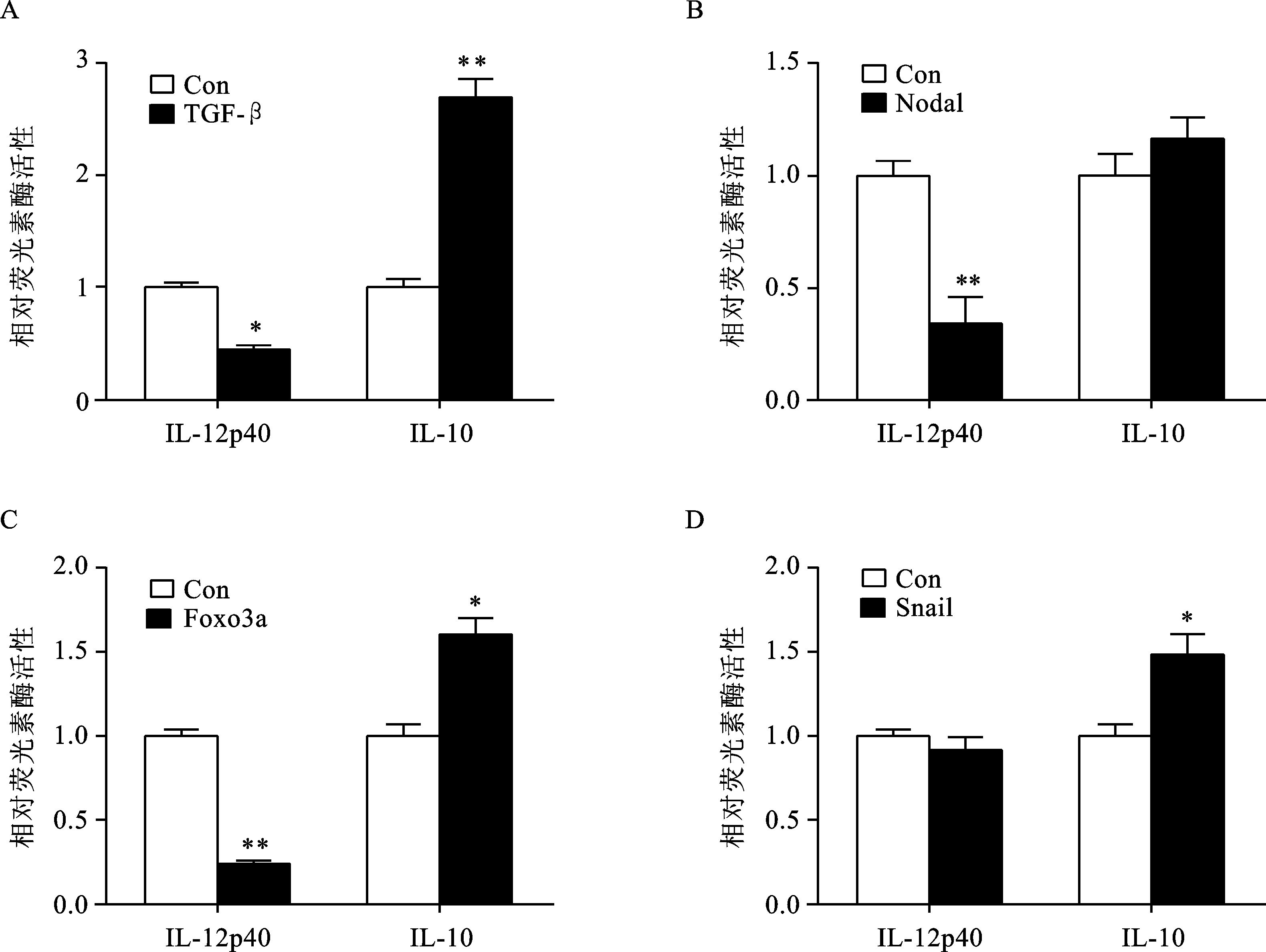
荧光素酶报告基因方法是检测转录因子与目的基因启动子区DNA相互作用的一种检测方法。通过荧光素酶报告基因检测法,分别检测不同处理条件下RAW264.7细胞中的IL-12p40和IL-10启动子的活性,判断并筛选与IL-12和IL-10表达调控相关的信号通路或转录因子,以各自的空白对照组作为对照。与对照组相比,TGF-β和Nodal蛋白处理组中IL-12p40的启动子表达明显下调,而IL-10启动子表达明显上调,差异具有显著性 (P<0.05/0.01)(图 4A、4B)。将Foxo3a表达质粒与报告基因质粒共转染RAW264.7,结果显示 (图 4C),IL-10荧光素酶的表达增强,而IL-12p40荧光素酶的表达抑制。由此说明,Foxo3a能够抑制IL-12靶基因过表达Foxo3a后,IL-12p40启动子活性明显被抑制,而IL-10启动子活性有所上调。同样,单核细胞过表达Snail后,IL-10启动子活性明显上调 (图 4D)。以上结果说明,Foxo3a和Snail对IL-12p40/IL-10基因具有调控作用,提示这两种转录因子在巨噬细胞活化中发挥一定的作用。
|
图 4 pGL3-IL-12p40 promoter/pGL3-IL-10 promoter筛选模型的应用 *P<0.05;**P<0.01 |
近年来研究表明,IL-12和IL-10是一对经典的巨噬细胞活化标志物。IL-12具有诱导巨噬细胞活化、促进Th1细胞和细胞毒性T细胞的增殖、诱导组织特异性自身免疫、对抗细菌和寄生虫感染中的作用[10]。IL-10可以通过抑制巨噬细胞、Th1细胞等的功能来抑制机体的细胞免疫应答,抑制多种炎性因子的表达如IL-12、IFN-γ,抑制MHC Ⅱ类抗原和共刺激B7分子表达、抑制细胞抗原呈递能力以及NO分泌等,从而抑制肿瘤免疫应答[4]。巨噬细胞的这种可塑性对于病理生理条件下机体的应答起着重要的作用[11, 12]。近年来巨噬细胞活化机制的研究不断被报道,多种转录因子如STAT家族、IRF家族、NF-κB等均在其中发挥着重要的作用[13]。研究机制并未被完全解读,我们拟通过IL-12和IL-10启动子报告基因模型,筛选可能影响巨噬细胞活化的转录因子和刺激物,为研究巨噬细胞活化的机制提供新的突破点。
本研究选用的荧光素酶报告系统是广泛应用于哺乳动物的第一个非同位素遗传报告系统,pGL3-Basic包含一种荧光素酶报告基因,不含任何启动子,当克隆的启动子插入到pGL3-Basic的多克隆位点后,启动子可促进下游萤火虫荧光素酶的表达,通过测量萤火虫荧光素酶活性来反映启动子的活性大小。萤火虫荧光素酶灵敏性好,可检测到0.1 fg的荧光素酶,而在哺乳类细胞极少有内源性荧光素酶活性,因此无背景信号,是现在应用最为广泛的一种理想的报道分子[14-16]。
本文通过提取小鼠脾细胞基因组DNA,特异性扩增调控IL-12p40和IL-10表达的启动子序列,与pGL3-Basic连接成重组体pGL3-IL-12p40 promoter和pGL3-IL-10 promoter,通过转化扩增,筛选出阳性克隆,并通过酶切、测序鉴定及生物活性的检测,结果表明,我们成功地构建了pGL3-IL-12p40 promoter和pGL3-IL-10 promoter两个荧光素酶报告基因载体,并在细胞内鉴定了在IFN-γ和IL-4的诱导下,能启动荧光素酶的表达,因此充分证明了我们构建的pGL3-IL-12p40 promoter和pGL3-IL-10 promoter具有生物学功能。进一步将此模型用于巨噬细胞活化通路中相关分子的筛选,发现TGF-β与其家族蛋白Nodal处理巨噬细胞后,可抑制IL-12启动子表达,上调IL-10启动子表达。而转录因子Foxo3a和Snail对IL-12p40/IL-10基因也具有调控作用,提示这两种转录因子在巨噬细胞极化中起到一定的作用。总之,本研究中成功构建pGL3-IL-12p40 promoter和pGL3-IL-10 promoter报告基因模型,为进一步研究IL-12和IL-10的转录调控机制和巨噬细胞极化过程中的相关信号通路分子的筛选奠定了基础。
| [1] | Gordon S, Taylor PR. Monocyte and macrophage heterogeneity[J]. Nat Rev Immunol, 2005, 5(12): 953-964. DOI: 10.1038/nri1733. |
| [2] | Gordon S, Martinez FO. Alternative activation of macrophages: mechanism and functions[J]. Immunity, 2010, 32(5): 593-604. DOI: 10.1016/j.immuni.2010.05.007. |
| [3] | Van Ginderachter JA, Movahedi K, Hassanzadeh Ghassabeh G, et al. Classical and alternative activation of mononuclear phagocytes:Picking the best of both worlds for tumor promotion[J]. Immunobiology, 2006, 211(6-8): 487-501. DOI: 10.1016/j.imbio.2006.06.002. |
| [4] | Stanilov NS, Miteva LD, Dobreva ZG, et al. Monocytes expression of IL-12 related and IL-10 genes in association with development of colorectal cancer[J]. Mol Biol Rep, 2012, 39(12): 10895-10902. DOI: 10.1007/s11033-012-1987-z. |
| [5] | Bondeson J, Browne KA, Brennan FM, et al. Selective regulation of cytokine induction by adenoviral gene transfer of IκBα into human macrophages:lipopolysaccharide-induced, but not zymosan-induced, proinflammatory cytokines are inhibited, but IL-10 is nuclear factor-κB independent[J]. J Immunol, 1999, 162(5): 2939-2945. |
| [6] | Stein B, Baldwin AS Jr. Distinct mechanisms for regulation of the interleukin-8 gene involve synergism and cooperativity between C/EBP and NF-kappa B[J]. Mol Cel Biol, 1993, 13(11): 7191-7198. DOI: 10.1128/MCB.13.11.7191. |
| [7] | Plevy SE, Gemberling JH, Hsu S, et al. Multiple control elements mediate activation of the murine and human interleukin 12 p40 promoters: evidence of functional synergy between C/EBP and Rel proteins[J]. Mol Cel Biol, 1997, 17(8): 4572-4588. DOI: 10.1128/MCB.17.8.4572. |
| [8] | Liu JG, Cao SJ, Herman LM, et al. Differential regulation of interleukin (IL)-12 p35 and p40 gene expression and interferon (IFN)-gamma-primed IL-12 production by IFN regulatory factor 1[J]. J Exp Med, 2003, 198(8): 1265-1276. DOI: 10.1084/jem.20030026. |
| [9] | Tone M, Powell MJ, Tone Y, et al. IL-10 gene expression is controlled by the transcription factors Sp1 and Sp3[J]. J Immunol, 2000, 165(1): 286-291. DOI: 10.4049/jimmunol.165.1.286. |
| [10] | Ma XJ. TNF-alpha and IL-12: a balancing act in macrophage functioning[J]. Microbes Infect, 2001, 3(2): 121-129. DOI: 10.1016/S1286-4579(00)01359-9. |
| [11] | Mantovani A, Sozzani S, Locati M, et al. Macrophage polarization: tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes[J]. Trends Immunol, 2002, 23(11): 549-555. DOI: 10.1016/S1471-4906(02)02302-5. |
| [12] | Benoit M, Desnues B, Mege JL. Macrophage polarization in bacterial infections[J]. J Immunol, 2008, 181(6): 3733-3739. DOI: 10.4049/jimmunol.181.6.3733. |
| [13] | Lawrence T, Natoli G. Transcriptional regulation of macrophage polarization: enabling diversity with identity[J]. Nat Rev Immunol, 2011, 11(11): 750-761. DOI: 10.1038/nri3088. |
| [14] | Wang K, Liu SC, Wang JL, et al. Transcriptional regulation of human USP24 gene expression by NF-kappa B[J]. J Neurochem, 2014, 128(6): 818-828. DOI: 10.1111/jnc.2014.128.issue-6. |
| [15] | Hu F, Meng YN, Gou LX, et al. Analysis of promoters and CREB/AP-1 binding sites of the human TMEM174 gene[J]. Exp Ther Med, 2013, 6(5): 1290-1294. |
| [16] |
戎晶晶, 陈之遥, 周国华. 生物素化荧光素酶的克隆表达及其固定化研究[J].
中国生物工程杂志, 2007, 27(9): 41-46.
Rong JJ, Chen ZY, Zhou GH. Immobilization of luciferase by cloning and expression of biotinylated luciferase[J]. China Biotechnology, 2007, 27(9): 41-46. |
 2017, Vol. 38
2017, Vol. 38

