2. 浙江省立同德医院骨科 浙江 杭州 310012
2. 2 Dept.of Orthopedics, Tongde Hospital of Zhejiang Province, Hangzhou, Zhejiang 310012, China
骨性关节炎(osteoarthritis,OA)从病理上看是软骨下骨、关节软骨的破坏以及继发的软骨细胞的凋亡[1, 2]。最近有研究报道:OA的形成主要是炎症始发的细胞外基质合成与降解的失衡导致的关节软组织破坏[3]。临床OA患者术中切片结果显示软骨细胞的皱缩以及凋亡小体的形成。因此软骨细胞凋亡是OA发病机制中的重要环节[4]。已有研究证实:白细胞介素-1β(interleukin-1β,IL-1β)作为一种致炎细胞因子在OA的发生和发展中起到重要作用[5]。IL-1β主要通过提高基质降解酶的水平以及诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的水平,再经过Caspase 9途径促进软骨细胞凋亡进而导致软骨的丢失。临床上常用非甾体消炎药物进行治疗,但是消化道出血等并发症限制了其临床应用。近些年来目光逐渐转向传统中药,槲皮苷是一种具有多种生物活性的药物,在自然界分布广泛[6]。研究证实槲皮苷具有多种药理作用,可以清除氧自由基、抗炎以及抑制破骨细胞骨吸收。但是槲皮苷是否对IL-1β诱导的软骨细胞凋亡有影响以及通过何种机制发挥作用尚不知。因此本研究通过IL-1β作用软骨细胞,然后施加不同浓度槲皮苷,观察对软骨细胞凋亡的作用及其潜在机制。
1 材料与方法 1.1 实验试剂8周龄健康清洁级雄性SD大鼠5只[合格证号:SCXK(渝2002008)],重量为180-200 g,由第三军医大学动物实验中心提供,槲皮苷(大连美仑生物技术有限公司,中国),IL-1β(Peprotech公司,美国),DMEM/F12培养基、PBS溶液、胎牛血清、胰酶(美国Gibco公司),AnnexinV-FITC细胞调亡检测试剂盒(博士德公司,中国)、二甲亚砜(DMSO,Ameresco,美国),Trizol(Invitrogen,美国),小鼠抗大鼠Bax、Bcl-2以及Caspase 9一抗(Abcam公司,美国),RIPA、PMSF、ECL显色液以及山羊抗小鼠二抗(博士德公司,中国),ReverTra Ace qPCR逆转录试剂盒(Takara公司,日本),SYBR® Green Realtime PCR Master Mix定量试剂盒(Takara公司,日本),iNOS酶联免疫法(ELISA)试剂盒(酶联公司,中国)。本研究通过我院动物伦理协会批准。
1.2 软骨细胞的提取以及细胞的处理SD大鼠颈椎脱臼处死后碘伏乙醇消毒,膝前路进入暴露膝关节,用刀小心刮取表面软骨,剪刀将软骨剪碎,加入0.25%的胰蛋白酶,采用酶消化法分离培养软骨细胞,原代细胞分离出后,加入含10%胎牛血清的DMEM/F12培养基继续培养,放置于37 ℃,含5%CO2、饱和湿度培养箱中培养,1周后首次换液,以后每2-3 d换液,至细胞80%-90%融合后进行传代培养。第2代时对软骨细胞进行鉴定,采用阿尔新蓝染色以及Ⅱ型胶原染色进行鉴定。取第3代软骨细胞饥饿过夜后消化后调整细胞密度为3×105/ml,然后随机分为5组,对照组(不施加任何干预),IL-1β组(50 μg/ml IL-1β作用24 h),槲皮苷组在添加50 μg/ml IL-1β同时添加不同浓度槲皮苷(100, 200, 400 μmol/L)作用24 h。每组设立5个复孔,实验共重复3次。
1.3 流式细胞仪检测槲皮苷对IL-1β诱导的大鼠软骨细胞调亡的影响AnnexinV-FITC细胞调亡检测试剂盒用于检测各组细胞的凋亡率,各组作用24 h后将培养皿取出,用消化酶将细胞消化,加入胎牛血清终止消化后移至离心管中,1 000 g离心5 min,用pH 7.4-7.6的PBS重悬细胞并计数,取5×104个细胞加入500 μl AnnexinV-FITC,再加入5 μl碘化丙啶染色液混匀,避光孵育30 min后进行流式检测(BD公司,美国),凋亡率=细胞凋亡数/细胞总数×100%。每个样本的检测共重复3次。
1.4 聚合酶链式反应(PCR)检测Bcl-2、Bax、Caspase 9的mRNA表达情况取出培养皿,应用Trizol提取细胞总RNA,使用ReverTra Ace qPCR逆转录试剂盒按照试剂盒说明将其逆转录为cDNA。检测目标分子引物如下:Bcl-2,上游5′-CAA ACT GCT AAA TGA CGA GG-3′,下游5′-GGG AAA GGT TGT GTA GGG TC-3′;Bax,上游5′-AGATCCTGACCGAGCGTGGC-3′,下游5′-CCA GGG AGG AAG AGG ATG CG-3′。Caspase 9,上游5′-AGATCCTGACCGAGCGTGGC-3′,下游5′-CCA GGG AGG AAG AGG ATG CG-3,β-actin,上游5′-AGATCCTGACCGAGCGTGGC-3′,下游5′-CCA GGG AGG AAG AGG ATG CG-3′;使用SYBR® Green Realtime PCR Master Mix定量试剂盒进QRT-PCR。以β-actin作为内参,根据公式2-ΔΔCt进行半定量计算。
1.5 免疫印记法(Western Blot)检测相关蛋白表达用3 ml/g蛋白裂解液充分裂解后离心收集蛋白。BCA法测定总蛋白浓度后分别取等量蛋白加入等体积的2×SDS上样缓冲液煮沸10 min,进行SDS-PAGE蛋白电泳,再分别进行转膜,封闭,一抗孵育过夜(1:150),二抗以1:5 000稀释37 ℃孵育2.5 h,加入ECL显色剂显色后,凝胶成像系统成像(伯乐公司,中国),Image J(National Institutes of Health,美国)软件计算灰度值。相对灰度值=(所测蛋白灰度值/内参GAPDH灰度值)×100%。各样本均平行重复3次。
1.6 ELISA检测iNOS表达24 h后将各组处理后的细胞取出,标准稀释液进行稀释,按照ELISA试剂盒说明书操作,加样结束后,加终止液后混匀,设置450 nm波长的酶标仪上进行检测,计算出OD值,计算iNOS表达量活性。
1.7 统计学分析应用SPSS 20.0进行统计学分析。观测数据主要为计量资料,以x±s表示,多组间整体比较采用单因素方差分析,两两比较采用Dunnet-t检验,以P<0.05为差异有统计学意义。
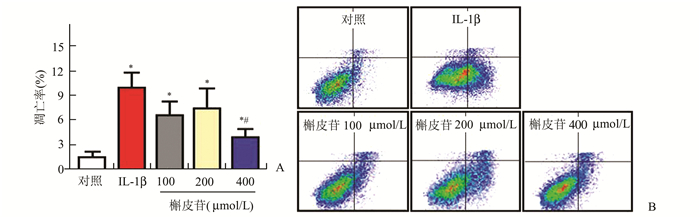
2 结果 2.1 各组凋亡率比较凋亡结果显示:与对照组比较,IL-1β组、100,200,400 μmol/L槲皮苷组处理后软骨细胞的凋亡率明显增加,差异有统计学意义(P<0.05)。与IL-1β组比较,400 μmol/L槲皮苷组处理后可以显著降低软骨细胞凋亡率,差异有统计学意义(P<0.05),而100 μmol/L与200 μmol/L槲皮苷组处理后软骨细胞凋亡率与IL-1β组比较差异无统计学意义(P>0.05)。5组凋亡率统计结果见图 1A,凋亡率图示见图 1B。
|
图 1 5组软骨细胞凋亡率比较结果 与对照组比较,*P<0.05;与IL-1β组比较,#P<0.05 |
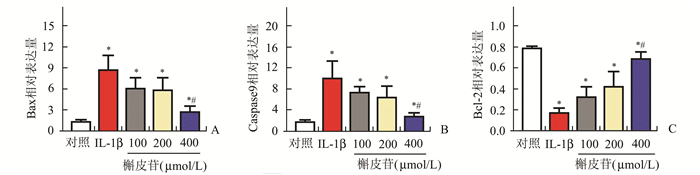
PCR结果显示,与对照组比较,IL-1β组、100,200以及400 μmol/L槲皮苷组处理后软骨细胞凋亡基因Bax以及Caspase 9的表达量显著升高,而抗凋亡基因Bcl-2明显下降,差异均有统计学意义(P<0.05);与IL-1β组比较,400 μmol/L槲皮苷组处理后凋亡基因Bax以及Caspase 9明显下降,而抗凋亡基因Bcl-2明显升高,差异有统计学意义(P<0.05),见图 2。
|
图 2 5组软骨细胞Bcl-2、Bax、Caspase 9基因表达情况 与对照组比较,*P<0.05;与IL-1β组比较,#P<0.05 |
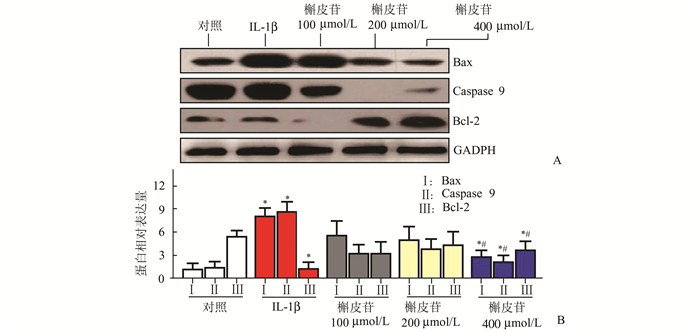
Western Blot结果显示,与对照组比较,IL-1β组、400 μmol/L槲皮苷组处理后软骨细胞凋亡蛋白Bax以及Caspase 9的表达量显著升高,而抗凋亡蛋白Bcl-2明显下降,差异有统计学意义(P<0.05);与IL-1β组比较,400 μmol/L槲皮苷组处理后凋亡蛋白Bax以及Caspase 9明显下降,而抗凋亡蛋白Bcl-2明显升高,差异均有统计学意义(P<0.05),见图 3。
|
图 3 5组软骨细胞Bcl-2、Bax、Caspase 9蛋白表达情况比较 与对照组比较,*P<0.05;与IL-1β组比较,#P<0.05 |
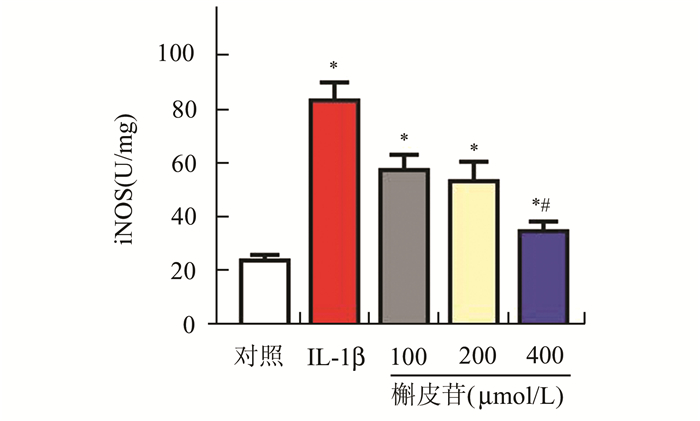
与对照组比较,IL-1β组、100,200,400 μmol/L槲皮苷组处理后软骨细胞iNOS的表达量显著升高,差异有统计学意义(P<0.05);与IL-1β组比较,400 μmol/L槲皮苷组处理后iNOS的表达量明显下降,差异有统计学意义(P<0.05),见图 4。
|
图 4 5组软骨细胞iNOS表达情况比较 与对照组比较,*P<0.05;与IL-1β组比较,#P<0.05 |
世界范围内OA的发病率占60岁以上的人群的10%以上。长期以来,OA被认为是关节腔的压力增高和软骨基质减弱共同导致OA的发生发展。随着分子生物学的发展,发现OA涉及到软骨、骨以及滑膜释放炎症介质等过程,导致基质金属酶的含量增加,最终导致软骨细胞凋亡。IL-1β作为一种致炎细胞因子,在OA的发生发展中起到重要作用[7]。临床上常用非甾体药物治疗OA,但是传统的非甾体药物副作用较大且价格昂贵。植物中提取的天然化合物具有副作用小以及较强抗炎作用。槲皮苷属于黄酮醇类药物,具有广泛的抗炎活性,但是在软骨细胞凋亡中的作用效果及其可能机制尚未见报道。
本研究首次探讨了槲皮苷对软骨细胞凋亡的影响,通过50 μg/ml IL-1β建立软骨细胞凋亡模型,应用槲皮苷后,软骨细胞凋亡率下降。进一步研究软骨细胞内凋亡相关基因与蛋白的表达情况,发现槲皮苷可能是通过Bax/Bcl-2通路发挥抗凋亡作用。本研究应用AnnexinV-FITC/PI双染法对各个阶段凋亡的软骨细胞进行确认,50 μg/ml IL-1β加入软骨细胞中,软骨细胞的凋亡率升高了5倍,与文献结果相似[8]。通过施加不同浓度槲皮苷后软骨细胞凋亡率下降,其中400 μmol/L槲皮苷的作用效果最明显。我们认为原因可能是:①槲皮苷属于黄酮醇类物,具有广泛的生物活性,最近的文献显示黄酮类药物有强大的抗炎作用[9];②槲皮苷可以通过抑制NF-κB信号通路抑制p65的表达进而调节MMP-13的表达,延缓关节软骨的退变,并且呈剂量依赖性;③槲皮苷通过减少活性氧簇发挥抗氧化应激的作用减少软骨细胞的凋亡。袁小亮等[10]的体内实验进一步佐证了槲皮苷在OA中的作用,研究者通过制备大鼠OA模型并应用槲皮素进行干预发现槲皮素有延缓OA发生作用。
进一步研究表明槲皮苷通过线粒体凋亡通路发挥抗凋亡作用,Bcl-2以及Bax是属于Bcl-2家族,包括了促凋亡分子(Bax)以及抗凋亡分子(Bcl-2)等[11]。但是这两种分子均与线粒体凋亡途径相关,通过影响线粒体膜电位使细胞发生凋亡[11]。Bcl-2会使细胞抗性增加,当Bcl-2表达增加时,会形成同源二聚体,抑制细胞凋亡[12]。同源Bax如果表达过高,也会形成Bac/Bax同源二聚体,加速细胞凋亡[13]。本研究通过PCR以及Western Blot方法从基因转录以及蛋白表达两方面研究发现,IL-1β作用于软骨细胞后,软骨细胞Bax明显升高,而Bcl-2明显降低,Bax下游的Caspase 9表达明显升高,提示IL-1β可能通过影响软骨细胞Bax以及Bcl-2的水平以及下游的Caspase 9的表达诱导软骨细胞凋亡。施加槲皮苷可以抑制Bax的表达,增加Bcl-2的表达,进而抑制下游的Caspase 9的表达,抑制软骨细胞凋亡进而延缓OA的发生。原因可能是槲皮苷通过抗氧化应激以及抗炎作用减弱炎症介质诱导的软骨细胞凋亡。另外槲皮苷可以减少致炎因子iNOS的水平,而iNOS在OA的发生发展中有十分重要的作用,iNOS可以抑制软骨细胞的基质合成以及Ⅱ型胶原合成。软骨细胞的基质以及Ⅱ型胶原是整个软骨细胞生存的微环境。软骨细胞的基质以及Ⅱ型胶原合成减少不利于软骨细胞存活,使软骨细胞凋亡增加,槲皮苷可以通过减少iNOS的水平进而减少NO的水平发延缓OA的发生发展,但是其具体机制需要进一步研究。
总之,槲皮苷可以通过减少Bax的表达以及增加Bcl-2的表达抑制IL-1β导致的软骨细胞凋亡,进而延缓OA的进程。但是尚缺乏体内实验进一步验证槲皮苷最佳剂量。
| [1] | Bang D, Xu J, Keenan R, et al. Cardiovascular disease prevalence in patients with osteoarthritis, gout, or both[J]. Bull Hosp Jt Dis (2013), 2016, 74(2): 113-118. |
| [2] | Cho SD, Youm YS, Kim JH, et al. Patterns and influencing factors of medial meniscus tears in varus knee osteoarthritis[J]. Knee Surg Relat Res, 2016, 28(2): 142-146. DOI: 10.5792/ksrr.2016.28.2.142. |
| [3] | Antony B, Jones G, Jin X, et al. Do early life factors affect the development of knee osteoarthritis in later life: a narrative review[J]. Arthritis Res Ther, 2016, 18(1): 202. DOI: 10.1186/s13075-016-1104-0. |
| [4] | Gu R, Liu N, Luo S, et al. MicroRNA-9 regulates the development of knee osteoarthritis through the NF-kappaB1 pathway inchondrocytes[J]. Medicine (Baltimore), 2016, 95(36): e4315. DOI: 10.1097/MD.0000000000004315. |
| [5] |
武豪杰, 王晓, 张明辉, 等. 白细胞介素-1β和基质金属蛋白酶-9在兔膝关节骨性关节炎模型滑膜中的表达及意义[J].
中华实验外科杂志, 2016, 33(3): 741-743.
Wu HJ, Wang X, Zhang MH, et al. Expression and significance of interleukin-1 beta and matrix metalloprotein-9 in synovial membrane of rabbit knee osteoarthritis model[J]. Chinese Journal of Experimental Surgery, 2016, 33(3): 741-743. DOI: 10.3760/cma.j.issn.1001-9030.2016.03.056. |
| [6] | He F, Li D, Wang D, et al. Extraction and purification of quercitrin, hyperoside, rutin, and afzelin from zanthoxylum bungeanum maxim leaves using an aqueous two-phase system[J]. J Food Sci, 2016, 81(7): C1 593-C1 602. DOI: 10.1111/1750-3841.13331. |
| [7] |
闫虎, 苏友新, 林学义. IL-1β诱导新西兰大白兔膝关节退变软骨细胞的体外培养及鉴定[J].
中国中西医结合杂志, 2014, 34(1): 81-86.
Yan H, Su YX, Lin XY. In vitro culture and identification of IL-1 β induced degeneration of cartilage cells in New Zealand white rabbits knee joint[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2014, 34(1): 81-86. |
| [8] | Chien SY, Huang CY, Tsai CH, et al. Interleukin-1β induces fibroblast growth factor 2 expression and subsequently promotes endothelial progenitor cell angiogenesis in chondrocytes[J]. Clin Sci (Lond), 2016, 130(9): 667-681. DOI: 10.1042/CS20150622. |
| [9] | Satué M, Arriero Mdel M, Monjo M, et al. Quercitrin and taxifolin stimulate osteoblast differentiation in MC3T3-E1 cells and inhibit osteoclastogenesis in RAW 264.7 cells[J]. Biochem Pharmacol, 2013, 86(10): 1476-1486. DOI: 10.1016/j.bcp.2013.09.009. |
| [10] |
袁小亮, 李林福, 施伟梅, 等. 槲皮素对关节软骨中MMP-13, TIMP-1表达的影响[J].
时珍国医国药, 2016, 27(2): 283-285.
Yuan XL, Li LF, Shi WM, et al. Effects of quercetin on the expression of MMP-13, TIMP-1 in joint cartilage[J]. Lishizhen Medicine and Materia Medica Research, 2016, 27(2): 283-285. |
| [11] | Karaliotas GI, Mavridis K, Scorilas A, et al. Quantitative analysis of the mRNA expression levels of BCL2 and BAX genes in human osteoarthritis and normal articular cartilage:An investigation into their differential expression[J]. Mol Med Rep, 2015, 12(3): 4514-4521. DOI: 10.3892/mmr.2015.3939. |
| [12] | Badr R, Hashemi M, Javadi G, et al. Assessment of global ischemic/reperfusion and Tacrolimus administration on CA1 region of hippocampus: gene expression profiles of BAX and BCL2 genes[J]. Bratisl Lek Listy, 2016, 117(6): 358-362. |
| [13] | Zhou Y, Liu SQ, Yu L, et al. Berberine prevents nitric oxide-induced rat chondrocyte apoptosis and cartilage degeneration in a ratosteoarthritis model via AMPK and p38 MAPK signaling[J]. Apoptosis, 2015, 20(9): 1187-1199. DOI: 10.1007/s10495-015-1152-y. |
 2018, Vol. 39
2018, Vol. 39

