干眼(dry eye)是由于泪液分泌不足或泪液过度蒸发而引起的一系列眼部不适症状,并伴有角膜上皮损伤的一组疾病[1]。轻度干眼使用人工泪液每日4次滴眼即可有效控制疾病的症状及体征。中、重度干眼常伴有浅层点状角膜病变(superficial punctate keratopathy,SPK)[2],在临床上除针对相关病因治疗外,主要采用不含防腐剂的人工泪液频繁滴眼,虽能有效缓解症状,但修复角膜上皮的效果仍不佳[3]。表皮生长因子(epidermal growth factor,EGF)临床用于角膜损伤及手术创面的修复显示安全有效。临床研究表明[14],重组人表皮生长因子(recombinant human epidermal growth factor,rhEGF)可有效治疗干眼伴SPK,且疗效不低于公认有效药物,rhEGF对于干眼症状也具有一定的缓解作用,而且对中度干眼伴SPK的疗效更为明显,并具有较好耐受性和安全性。
眼表分析仪是一种新型的眼科检查技术,具有无创性、干扰小的特性,能够直观观察睑板腺腺体、测量泪河高度、观察脂质层、准确计算泪膜破裂时间(break-up time,BUT)。临床上对人眼视觉质量的评价越发重要,双通道视觉质量分析系统(optical quality analysis system,OQAS)作为一种新型的无创的检查手段,是目前唯一能对视觉质量进行全面客观评价的仪器。为此,我们探讨人工泪液联合rhEGF滴眼液治疗中度干眼伴SPK的有效性,并应用眼表分析仪直接观察眼表变化,OQAS分析视觉质量,为中度干眼伴SPK的治疗及疗效观察进一步提供客观、准确的依据。
1 对象与方法 1.1 对象选取2015年3-7月期间在武汉大学人民医院眼科中心诊断为中度干眼伴SPK的患者48例(96眼)作为研究对象,其中男20例(40眼),女28例(56眼),年龄23-69岁,平均(48.5±19.2) 岁。所有研究对象球镜度为(-6.00-+3.00) D,柱镜度为(-0.50-+0.50) D。所有受检者检查前均签署知情同意书,本研究经本院伦理委员会审查通过。
入选标准:① 有干燥感、异物感、烧灼感、疲劳感、视力波动等症状;② BUT≤5 s或Schirmer Ⅰ试验(Schimer-ⅠTest,SⅠT)≤5 mm/5 min;③ 角结膜荧光素染色(fluorescein staining,FL)评分≥1分。
排除标准:重度干眼伴SPK患者;有眼部过敏疾病的患者;有过敏体质患者;有眼部感染性疾病的患者;青光眼患者;严重全身疾病及严重免疫功能低下患者;有精神、神经系统疾病而无法合作者;有其他可能影响泪液检查的眼科手术或其他对角膜有影响的疾病(如糖尿病)的患者;4周内眼部及全身曾使用过可能影响角膜上皮生长代谢药物者;妊娠期、哺乳期妇女。
1.2 方法受试者随机分为治疗及对照组,其中治疗组24例(48眼),对照组24例(48眼)。治疗组每天给予rhEGF衍生物滴眼液(商品名金因舒,5 000 IU/ml,3 ml/支,深圳华生元基因工程发展有限公司),1滴/次,4次/d;人工泪液(商品名新泪然,5 ml/支,15 mg羟丙甲纤维素2910, 5 mg右旋糖酐70,10 mg甘油,Alcon Laboratories,Inc.),1滴/次,4次/d,两种药间隔10 min。对照组单独使用人工泪液,1滴/次,4次/d。治疗至角膜荧光素染色消失,最短用药2周,最长4周。分别在用药第1,(3±1),(7±1),(14±2),(28±1) 天各访视一次,共5次。
1.3 疗效指标 1.3.1 主要疗效指标主要指标为各个访视点各组角膜荧光染色(FL)由阳性转阴性的眼数占各组总眼数的比例,即角膜FL消失率。使用荧光素钠试纸条置于患者结膜囊内,令患者瞬目2-3次使染料分布均匀,在裂隙灯的钴蓝激光滤光片16倍下观察角膜荧光着色情况。治疗前对各受试者进行角膜FL评分:将角膜分为4个均等象限,分别对各个象限进行评分,染色阴性为0分,染色点 < 5个为1分,出现密集点状或斑片状着色为3分,2分介于二者之间。计算4个象限评分总和。在各个访视点观察各受试者角膜FL是否消失。角膜FL消失率=各组角膜FL转阴性的眼数/各组总眼数×100%。
1.3.2 次要疗效指标 1.3.2.1 眼部主观症状评价使用眼表指数评分(ocular surface disease index,OSDI)调查问卷进行评分。评分标准为每项积分按症状持续时间进行计算,从未有过症状为0分,少部分时间1分,约一半时间2分,大部分时间3分,症状持续4分,12题可选择不必全部回答。总分=以上分数和×25/答题数,满分100分。
1.3.2.2 SⅠT在无表麻下将长35 mm、宽5 mm滤纸条至于患眼下睑结膜囊内,观察5 min后滤纸条的浸湿长度。
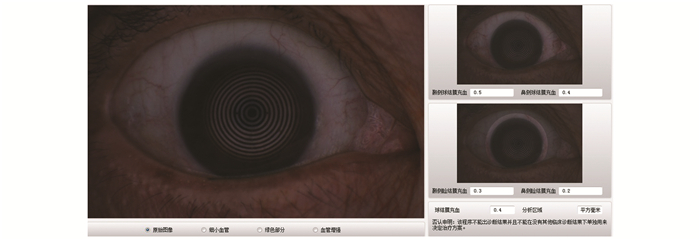
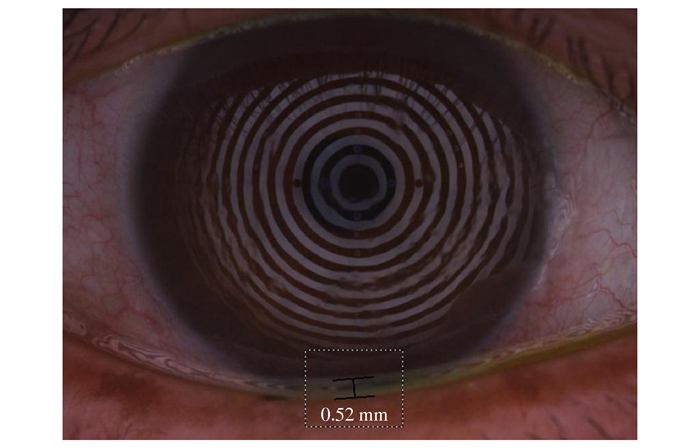
1.3.2.3 眼表综合分析仪测量方法及相关参数使用Keratograph 5M非侵入性眼表综合分析仪(德国Oculus公司)进行测量。① 球结膜充血程度分析:调焦至结膜血管最清晰,嘱患者正常瞬目后充分暴露球结膜同时采集数据,系统分析后自动显示评分数值,见图 1;② 泪河高度测量:对患者泪河图像进行拍摄,并应用系统内置的测量工具对瞳孔中央正下方的泪河高度进行测量,见图 2;③ BUT:嘱患者瞬目2次后一直睁眼,由系统记录出患者泪膜首次破裂的时间及位点。所有参数经同一眼科医生检查2次,取均值,见图 3A、3B。
|
图 1 Keratograph 5M分析球结膜充血程度 |
|
图 2 Keratograph 5M拍摄泪河图像,并使用系统内置的测量工具对瞳孔中央正下方的泪河高度进行测量 |

|
图 3 Keratograph 5M测量BUT结果 A:显示角膜各个部位的泪膜破裂时间,相同颜色区域表示泪膜在同一时间破裂,颜色越深(红色),泪膜破裂越早;B:显示泪膜破裂部分与时间的关系曲线,并显示BUT |
通过基于双通道技术的OQAS Ⅱ系统(西班牙Visiometeics公司)评估视觉质量。经过充分滤过和校准的780 mm点光源在视网膜上成像,经过视网膜反射的光线再次穿过屈光介质,OQAS采集图像并进行分析。为避免球差和散光的影响,受检者屈光不正需全部矫正。要求受检者注视视标,被测眼处于屏幕中央并清晰聚焦,选定瞳孔直径为4 mm,OQAS采集若干视网膜点扩散函数(point spread function,PSF)图像并进行处理。
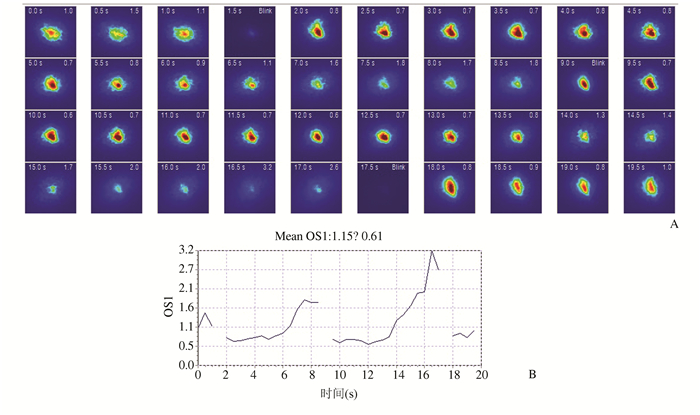
相关参数:① 调制传递函数(modulation transfer function,MTF)截止频率(MTF cut off):反映光学系统分辨率高低及人眼能探测到的最大空间频率,低空间频率类似较低视力或大体视觉,高空间频率表示较好的视力或精细视觉[4],即MTF cut off越大,视觉质量越好;② 斯特列尔比(strehl ratio,SR):SR=有像差时的高斯像点处的光强/无像差时的高斯像点处的光强,SR值越高越接近无像差的光学系统,视觉质量越好;③ 客观散射指数(objective scatter index,OSI)均值及标准差:通过分析双通道(DP)图像12-20 arc min范围内的环形区域与中央峰值1 arc min半径的圆形区域内光强度的比值来表示,评价眼球散射改变,OSI均值越大,散射越大,视觉质量越差,反之越好;动态观察前嘱患者眨眼2次,之后禁止眨眼,系统每隔0.5 s记录一次双通道图像,持续20 s(共40张图像),计算OSI标准差,标准差越大,泪膜越不稳定,见图 4A、4B。
|
图 4 OQAS Ⅱ动态观察泪膜情况 A:OQAS Ⅱ动态采集图像过程,0.5 s一次获取视网膜图像,20 s共计40张图像;B: 20 s内OSI值的变化结果,瞬目后OSI为正常值,随后受试者保持睁眼,OSI值逐渐增大,当受试者不能保持睁眼时眨眼,OSI又回到正常值,曲线波动越大,泪膜越不稳定 |
应用SPSS 19.0统计软件进行数据录入和统计分析。定量数据资料均满足正态分布,计量资料以均数±标准差(x±s)表示。采用配对t检验,以P < 0.05差异为有统计学意义。
2 结果 2.1 一般资料比较两组患者年龄、性别、症状、体征、工作环境、病情等相关资料比较,差异无统计学意义(P > 0.05),故具有可比性。
2.2 治疗结果比较 2.2.1 角膜FL消失率治疗前,两组角膜FL评分结果比较差异无统计学意义(P > 0.05)。随着用药时间的延长,两组中均有部分患眼出现FL消失(阴性),治疗组在用药后(3±1) d、(7±1) d、(14±2) d、(28±1) d的角膜FL消失率均明显高于对照组。两组各访视点角膜FL消失率的差异均具有显著统计学意义(P < 0.01),见表 1。
| 表 1 治疗组与对照组各访视点(d)的角膜荧光素染色消失率(%) |
治疗前后,两组OSDI问卷评分、SⅠT、球结膜充血程度、泪河高度、BUT、MTF cut off、SR、OSI均值及标准差的差异均无统计学意义(P > 0.05)。
随着用药时间延长,两组患者自觉症状都有明显好转,OSDI问卷得分降低,治疗组在各个访视点的OSDI问卷得分显著低于对照组;两组SⅠT结果数值均增加且治疗组在各个访视点SⅠT)均显著高于对照组;两组OSDI问卷评分(t=-7.22、-3.13、-2.71、-5.50,P < 0.01)、SⅠT(t=5.66、4.70、5.97、2.08,P < 0.05) 结果比较,在各个访视点的差异均具有显著统计学意义,见表 2、3。
| 表 2 两组患者治疗前后OSDI问卷评分结果比较(x±s, 分) |
| 表 3 两组患者治疗前后SⅠT结果比较(x±s,mm) |
Keratograph 5M分析发现,治疗后两组球结膜充血程度都有所减轻,球结膜充血评分随用药逐渐降低,且在各个访视点治疗组得分显著低于对照组;两组泪河高度及BUT均改善,在各个访视点泪河高度及BUT均增高,且对照组明显低于治疗组;两组球结膜充血评分、泪河高度、BUT结果比较,各个访视点的差异均具有显著统计学意义(P < 0.05或P < 0.01),见表 4-6。
| 表 4 两组患者治疗前后球结膜充血程度评分结果比较(x±s, 分) |
| 表 5 两组患者治疗前后泪河高度结果比较(x±s,mm) |
| 表 6 两组患者治疗前后BUT结果比较(x±s,s) |
OQAS Ⅱ结果表示,两组MTF cut off、SR逐渐升高,OSI均值减小,OSI标准差即OSI波动幅度减小,且治疗组在各个访视点的数值改变均大于对照组。两组OQAS Ⅱ各参数结果比较,在各个访视点的差异均具有显著统计学意义(P < 0.05或P < 0.01),见表 7-10。
| 表 7 两组患者治疗前后MTF cut off结果比较(x±s,c/deg) |
| 表 8 两组患者治疗前后SR结果比较(x±s,mm) |
| 表 9 两组患者治疗前后OSI均值比较(x±s, mm) |
| 表 10 两组患者治疗前后OSI标准差比较(x±s, mm) |
SPK是由多种原因引起的角膜上皮病变,干眼是与泪膜相关的疾病。泪膜与角膜上皮相互作用相互影响,完整的角膜上皮有利于维持泪膜的张力与稳定,泪膜的不完整会损伤角膜上皮,加大泪膜正常附着的难度,加重角膜上皮损伤及病变[2]。
Wilson等[5]在人的主要细胞成分中均发现存在有EGF及其受体mRNA和蛋白质。众多试验研究表明,EGF通过结合细胞膜上的表皮生长因子受体促进表皮细胞、内皮细胞等多种细胞增殖[6-9]。Cohen等[10]于1975年分离出人EGF(hEGF),hEGF通过与细胞受体的膜外部分结合,激活酪氨酸激酶,诱导蛋白磷酸化,启动DNA合成,激活RNA、蛋白质合成,促进细胞的增生和迁移。Urdea等[4]于1983年成功基因重组hEGF(rhEGF)并证明其与天然hEGF生物学活性相同。动物实验表明,rhEGF能显著提高角膜上皮特别是角膜缘细胞的生长能力[11],并对碱烧伤后的角膜上皮损伤的修复有明显促进作用[12]。正常情况下,EGF的含量与生理所需处于相对稳定的状态,当角膜上皮受到损伤时(如SPK),损伤部位的EGF受体增多,内源性EGF受体向损伤部位集中[13]。中度以上的干眼,尤其是以泪液分泌减少的干眼,由于患者泪液分泌减少或泪液蒸发过强,导致角膜损伤部位集中的EGF无法满足损伤修复的需要,此时角膜损伤无法得到及时的修复,角膜上皮愈合减慢,愈合质量差,严重的还会出现角膜的持续性上皮缺损(persistent epithelial defects,PED)[14]。在这种状况下,仅仅给予人工泪液滴眼只能暂时稳定泪膜、减少外界刺激,暂时缓解症状,无法从根本上解决上皮损伤修复不良。此时,局部应用外源性EGF(如rhEGF衍生物滴眼液),补充损伤部位对EGF的需求,提高EGF含量,才能加速损伤的修复和愈合[15]。本研究结果证实人工泪液联合rhEGF衍生物滴眼液治疗中度干眼伴SPK的效果明显优于单独使用人工泪液,rhEGF衍生物滴眼液能有效缩短症状及体征改善的时间。
干眼造成泪膜质量下降,稳定性降低,导致进入眼睛的波前光线路径产生改变[16],对视觉质量产生明显影响[17]。中度干眼伴SPK患者损伤局部的泪膜改变更大,这种局部的变化加重了角膜前表面的散射,影响眼球像差,影响视网膜成像,从而更加影响视觉质量[18, 19]。以往干眼的视觉质量指标包括主观症状、对比敏感度、角膜地形图、波前像差仪等。但由于泪膜变化影响眼球散射,单纯分析像差可能会造成对视觉损失程度的评判不够准确[20]。Benito等[21]发现干眼患者OSI均值及标准差与健康眼之间存在差别,其眼球散射更加明显。双通道技术作为一种非侵入性的检查方法,测量眼球像差及散射情况,可以更全面客观地评估中度干眼伴SPK患者的视觉质量。本研究比较两组OQAS Ⅱ结果发现,两组MTF cut off、SR值均随着用药时间延长逐渐升高,表明两组患者的视觉系统探测微小细节的能力都逐渐改善;OSI均值逐渐降低,表明眼球散射情况逐渐改善;OSI值标准差的波动逐渐减小,表明泪膜逐渐趋于稳定。并且,治疗组在各个访视点的OQAS Ⅱ的测量结果都明显优于对照组,表明rhEGF衍生物滴眼液联合人工泪液在改善中度干眼伴SPK患者视觉质量上明显优于单用人工泪液。
rhEGF衍生物滴眼液联合人工泪液能有效改善中度干眼伴SPK的临床症状及体征,并能显著提高患者的视觉质量,效果优于单用人工泪液。由于个体差异,部分中度干眼伴SPK患者症状与体征差异较大,研究其视觉质量可能为诊断和治疗提供更多客观的指标,有利于治疗过程的动态观察及评估。眼表综合分析仪及双通道视觉质量分析系统提供客观量化的指标,并突破传统方法,使患者在无药物无刺激的舒适状态下快速完成检查,辅助医生对患者进行个性化治疗。
| [1] |
FosterCS, AzarDT, DohlmanCH, 等.
角膜:理论基础与临床实践[M]. 第4版.天津: 天津科技翻译出版公司, 2007: 601.
Stephen CF, Azar DT, Dohlman CH. The cornea: scientific foundations and clinical practice[M]. Fourth Edition.Tianjin: Tianjin Science and Technology Translation And Publishing Co., LTD, 2007: 601. |
| [2] | Labbé A, Brignole-Baudouin F, Baudouin C. Ocular surface investigations in dry eye[J]. J Fr Ophthalmol, 2007, 30(1): 76-97. DOI: 10.1016/S0181-5512(07)89557-X. |
| [3] |
徐锦堂, 孙秉基, 方海洲.
眼表疾病的理论基础与临床[M]. 天津: 天津科学技术出版社, 2002: 477-479.
Xu JT, Sun BJ, Fang HZ. Cornea surface disorder[M]. Tianjin: Tianjin Science and Technology Press, 2002: 477-479. |
| [4] | Alió JL, Piñero DP, Ortiz D, et al. Clinical outcomes and postoperative intraocular optical quality with a microincision aberration-free aspheric intraocular lens[J]. J Cataract Refract Surg, 2009, 35(9): 1548-1554. DOI: 10.1016/j.jcrs.2009.03.055. |
| [5] | Wilson SE, He YG, Lloyd SA. EGF, EGF receptor, basic FGF, TGF beta-1 and IL-1 alpha mRNA in human corneal epithelial cells and stromal fibroblasts[J]. Invest Ophthalmol Vis Sci, 1992, 33(5): 1756-1765. |
| [6] | Mitsumoto T, Nishimura T, Toda S, et al. Combined effect of extracellular matrices and growth factors on bovine corneal endothelial cells in culture[J]. Jpn J Ophthalmol, 2001, 45(2): 115-124. DOI: 10.1016/S0021-5155(00)00358-0. |
| [7] | Wilson SE, Lloyd SA. Epidermal growth factor and its receptor, basic fibroblast growth factor, transforming growth factor beta-1, and interleukin-1 alpha messenger RNA production in human corneal endothelial cells[J]. Invest Ophthalmol Vis Sci, 1991, 32(10): 2747-2756. |
| [8] | Woost PG, Jumblatt MM, Eifernan RA, et al. Growth factors and corneal endothelial cells: Ⅱ. Characterization of epidermal growth factor receptor from bovine corneal endothelial cells[J]. Cornea, 1992, 11(1): 11-19. DOI: 10.1097/00003226-199201000-00002. |
| [9] | Couch JM, Cullen P, Casey TA, et al. Mitotic activity of corneal endothelial cells in organ culture with recombinant human epidermal growth factor[J]. Ophthalmology, 1987, 94(1): 1-6. DOI: 10.1016/S0161-6420(87)33512-2. |
| [10] | Kilic E, Ozdemir YG, Bolay H, et al. Pinealectomy aggravates and melatonin administration attenuates brain damage in focal ischemia[J]. J Cerebr Blood Flow Metab, 1999, 19(5): 511-516. |
| [11] | Taningchi E, Nagae Y, Watanale H, et al. The effect of recombinant epidermal growth factor in corneal angiogenesis[J]. Nippon Ganka Gakkai, 1991, 95(1): 52-58. |
| [12] |
张静, 亓晓琳, 史伟云, 等. 重组人表皮生长因子促进动物角膜上皮修复的作用[J].
国际眼科杂志, 2009, 9(9): 1660-1664.
Zhang J, Qi XL, Shi WY, et al. Effect of recombinant human epidermal growth factor on the reparation of corneal epithelium[J]. Int J Ophthalmol-Chi, 2009, 9(9): 1660-1664. |
| [13] | Brazzell RK, Stem ME, Aquavella JV, et al. Human recombinant epidermal growth factor in experimental corneal wound healing[J]. Invest Ophthalmol Vis Sci, 1991, 32(2): 336-340. |
| [14] |
贺燚, 孙秉基, 李家臣, 等. 重组人表皮生长因子衍生物滴眼液治疗干眼所引起的角膜上皮损伤的临床研究[J].
中华眼外伤职业眼病杂志, 2009, 31(3): 169-172.
He Y, Sun BJ, Li JC, et al. Clinical study of rhEGFD eyedrops for treatment of superficial punctate keratopathy associated with dry eye[J]. Chin J Ocul Traum Occupat Eye Dis, 2009, 31(3): 169-172. |
| [15] | Foreman DM, Pancholi S, JarvisEvans J, et al. A simple organ culture model for assessing the effects of growth factors on corneal re-epithelialization[J]. Exp Eye Res, 1996, 62(5): 555-564. DOI: 10.1006/exer.1996.0065. |
| [16] | Licznerski TJ, Kasprzak HT, Kowalik W. Application of twyman-green interferometer for evaluation of in vivo breakup characteristic of the human tear film[J]. J Biomed Opt, 1999, 4(1): 176-182. DOI: 10.1117/1.429904. |
| [17] | Montés-Micó R. Role of the tear film in the optical quality of the human eye[J]. J Cataract Refract Surg, 2007, 33(9): 1631-1635. DOI: 10.1016/j.jcrs.2007.06.019. |
| [18] | Tutt R, Bradley A, Begley C, et al. Optical and visual impact of tear break-up in human eyes[J]. Invest Ophthalmol Vis Sci, 2000, 41(13): 4117-4123. |
| [19] | Thibos LN, Hong X. Clinical applications of the Shack-Hartmann aberrometer[J]. Optom Vis Sci, 1999, 76(12): 817-825. DOI: 10.1097/00006324-199912000-00016. |
| [20] | Martinez-Roda JA, Vilaseca M, Ondategui JC, et al. Optical quality and intraocular scattering in a healthy young population[J]. Clin Exp Optom, 2011, 94(2): 223-229. DOI: 10.1111/j.1444-0938.2010.00535.x. |
| [21] | Benito A, Pérez GM, Mirabet S, et al. Objective optical assessment of tear-film quality dynamics in normal and mildly symptomatic dry eyes[J]. J Cataract Refract Surg, 2011, 37(8): 1481-1487. DOI: 10.1016/j.jcrs.2011.03.036. |
 2017, Vol. 38
2017, Vol. 38

 ,
,