2. 武汉科技大学天佑医院 湖北 武汉 430064
2. Tianyou Hospital Affiliated to Wuhan University of Science and Technology, Wuhan 430064, China
国际糖尿病联盟(international diabetes federation, IDF)最新数据显示,2013年,在世界范围内有3.82亿糖尿病患者,至2035年糖尿病患者人数将上升到5.92亿,中国2013年糖尿病的患病人数为9 840万,居全球首位;到2035年,中国的糖尿病患病人数将达到1.43亿[1]。有研究表明,低度慢性炎症状态在肥胖和2型糖尿病的发生发展中起着重要的作用。脂肪组织和肌肉组织中浸润的巨噬细胞产生的炎症因子,如肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、白细胞介素1β(IL-1β)等,可促进胰岛素抵抗的形成[2],而胰岛素抵抗是2型糖尿病发病的关键环节之一。C反应蛋白(CRP)也与胰岛组织炎症密切相关,2型糖尿病患者的胰岛组织可表现出典型的炎症反应,进一步导致胰岛β细胞功能障碍。有研究表明,循环中炎症因子大部分来自于外周血单个核细胞(peripheral blood mononuclear cells, PBMCs),同时PBMCs可迁移至脂肪组织,激活脂肪组织产生炎症因子,如TNF-α、IL-6。因此,PBMCs可作为研究及评价全身炎症反应和胰岛素抵抗相关性的模型[3]。
核受体是一种可调控代谢或炎症反应的重要受体。NR2E1(nuclear receptor subfamily 2,group E,member 1)属于核受体中的孤儿核受体,广泛表达于中枢神经系统、胰岛、肾上腺、脾脏、淋巴细胞等组织细胞。有研究发现NR2E1敲除小鼠的体重与脂肪垫含量较对照组明显减少[4]。同时,一项全基因组关联分析(GWAS)研究表明,肉牛中转录因子PPARGC1A、HNF4G可与NR2E1协同作用调节肌肉内脂肪沉积[5]。在人类遗传学研究中,PPARGC1A与胰岛素抵抗、肥胖和2型糖尿病的易感性密切相关,HNF4G与高度肥胖相关。在2型糖尿病发生发展过程中,目前尚无NR2E1与慢性炎症反应相关性的研究。本研究旨在通过测定29名新诊断2型糖尿病患者及48名健康志愿者PBMCs中NR2E1的表达水平、血清中炎症因子水平,分析NR2E1与炎症因子TNFα、IL-6的相关性,测定健康对照志愿者PBMCs经16.7 mmol/L葡萄糖、250 μmol/L棕榈酸刺激后NR2E1与炎症因子TNFα、IL-6的表达水平,以探讨NR2E1的表达与新诊断2型糖尿病患者慢性炎症状态间的关系。
1 对象与方法 1.1 研究对象29例糖尿病组研究对象来自2013年8月至2014年3月间于武汉大学中南医院就诊的新诊断的2型糖尿病患者,其中男性21例,女性8例。所有入组患者2型糖尿病的诊断依据参照WHO糖尿病专家委员会(1999)提出的诊断和分类标准,并排除急性感染、应激状态、高血压病、心血管疾病以及肝肾疾病等慢性疾病。对照组为2013年8月至2014年3月间于武汉大学中南医院体检中心筛选出的健康体检者,共48例,经糖耐量试验,排除糖尿病患者,并详细询问既往史,其中男性28例,女性20例。所有研究对象签署知情同意书。
1.2 方法 1.2.1 资料收集通过调查问卷的方式收集研究对象的基本资料、既往史及家族史,由专业医务人员测量身高、体重,体重指数(BMI)=体重/身高2(kg/m2)。
1.2.2 临床血生化指标检测清晨空腹状态下抽取研究对象的静脉血,于我院检验科测定空腹血糖(FBG)、空腹血清胰岛素(FIN)、糖化血红蛋白(HbA1c)、甘油三酯(TG)、游离脂肪酸(FFAs)、超敏C反应蛋白(hs-CRP)等指标的水平。稳态模型评估胰岛素抵抗指数(HOMA-IR)=FIN (μU/mL)×FBG (mmol/L)/22.5。
1.2.3 梯度离心法收集PBMCs抽取研究对象空腹静脉血2 ml于含有肝素钠的试管中,加入2 ml外周血单个核细胞提取液(天津灏洋生物科技公司),2 000 r/min离心25 min,收集第2层中PBMCs,使用PBS溶液洗涤细胞2次,2 000 r/min离心10 min,收集PBMCs用于后续实验。
1.2.4 外周血单个核细胞体外培养用含10%胎牛血清的RPMI 1640培养基重悬PBMCs,以2 ml/孔接种至6孔板内,37 ℃ 5% CO2培养至70%-80%融合后,弃上清,加入新鲜的含0,16.7 mmol/L葡萄糖以及250 μmol/L棕榈酸继续培养24 h。
1.2.5 总RNA提取和实时荧光定量PCR采用RNA提取试剂盒(北京赛百盛公司),按照说明书提取PBMCs总RNA,并采用紫外分光光度计测定RNA在260 nm和280 nm处吸光值以评价RNA样品纯度。总RNA采用逆转录试剂盒(Promega)逆转录为cDNA,置于-80 ℃冰箱中保存备用。Primer premier 5.0软件设计引物如下:NR2E1(NM_003269.4)上游引物5′-TGAGTGAGGTAGATTGCTGTCC-3′,下游引物5′-ATTCGTTTCCTGTCTGGTGTG-3′;β-actin (NM_001101.3)上游引物5-CCTGGCACCCAGCACAAT-3′,下游引物5′-GGGCCGGACTCGTCATAC-3′(引物由上海生物工程有限公司合成)。反应体系25 μl,包括SYBR Premix Ex Taq Ⅱ(日本Takara公司)12.5 μl,上下游引物各1 μl,ROX Reference Dye Ⅱ(日本Takara公司)0.5 μl,cDNA模板2 μl,余下体积不足部分由双蒸水补足。荧光实时定量PCR扩增条件为:95 ℃预变性5 min,95 ℃变性30s,58 ℃退火30 s,72 ℃延伸30 s,循环35次,最后72 ℃延伸10 min,通过熔解曲线图评估PCR产物纯度。Mx3000P软件分析扩增曲线确定周期阈值(Ct)。以β-actin为内参校正每个样品的Ct值。以2-ΔΔCT表示糖尿病组及对照组中目标基因表达水平的倍数变化比。
1.2.6 Western blotting测定外周血单个核细胞中蛋白水平应用蛋白变性裂解液提取上述PBMCs中的总蛋白,测定蛋白浓度后,SDS聚丙烯酰胺凝胶电泳转印至PVDF膜上,用含5%脱脂奶粉的PBS-T溶液封闭,分别用稀释后的一抗(1:500兔抗人NR2E1, 1:10 000兔抗人GAPDH)(美国Santa Cruz)孵育,洗脱后用HRP标记的山羊抗兔二抗(1:10 000)孵育过夜,ECL发光液暗室曝光显色,扫描胶片,AlphaEaseFC 4.0软件分析灰度值,以NR2E1蛋白和GAPDH的灰度比值表示NR2E1蛋白表达水平。
1.2.7 TNF-α和IL-6浓度测定采用人TNF-α和IL-6 ELISA试剂盒(武汉博士德公司),依照试剂盒说明书测定血浆及条件刺激细胞培养上清中TNF-α和IL-6浓度。
1.3 统计学分析采用SPSS 19.0分析数据,结果均以均数±标准差(x±s)表示,正态分布资料采用两独立样本t检验,变量的线性关系采用Person’s相关性分析。P < 0.05代表差异有统计学意义。
2 结果 2.1 研究人群的临床特征研究人群的临床特征如表 1所示,对照组和糖尿病组研究对象年龄、性别、身高、体重等指标间均无统计学差异。糖尿病患者组FBG、FIN、HbA1c、TG、FFAs和HOMA-IR、hs-CRP较对照组明显升高,差异具有统计学意义(P<0.01或P<0.05)。
| 表 1 各组研究人群的临床特征(x±s) |
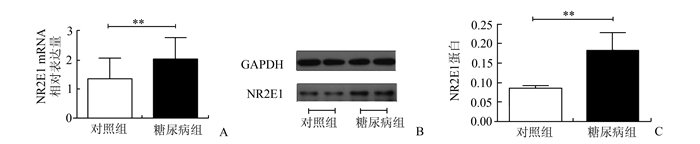
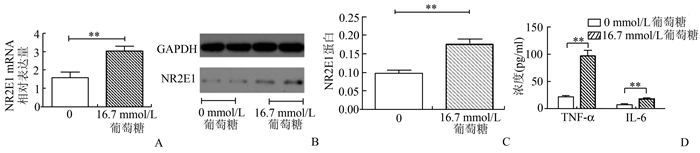
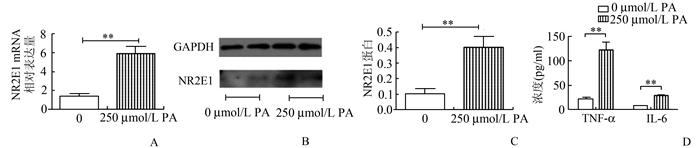
糖尿病组PBMCs中NR2E1 mRNA相对表达量较对照组升高(2.03±0.74 vs 1.36±0.70,P<0.01),NR2E1蛋白表达水平较对照组显著升高(0.182±0.046 vs 0.085±0.007,P<0.01)(图 1)。健康志愿者外周血分离PBMCs分别给与16.7 mmol/L葡萄糖以及250 μmol/L棕榈酸刺激24 h后,NR2E1 mRNA水平较未刺激PBMCs组明显上调(0 vs 16.7 mmol/L葡萄糖:1.59±0.29 vs 3.14±0.22,P<0.01;0 vs 250 μmol/L棕榈酸:5.96±0.77 vs 1.35±0.33,P<0.01);NR2E1蛋白表达水平也明显增加(0 vs 16.7 mmol/L葡萄糖:0.095 5±0.009 4 vs 0.180 0±0.013 0,P<0.01;0 vs 250 μmol/L棕榈酸:0.106±0.031 vs 0.403±0.069,P<0.01)(图 2,图 3)。
|
图 1 Western blotting法检测对照组及糖尿病组外周血单个核细胞中NR2E1蛋白表达水平 A. NR2E1 mRNA相对表达量;B. Western blot检测NR2E1蛋白水平表达;C.经GAPDH为内参校正后NR2E1蛋白相对表达量ontrol group=对照组,diabetes group=糖尿病组;GAPDH蛋白分子质量为37 kU,NR2E1蛋白分子质量为43 kU;**P<0.01 |
|
图 2 体外16.7 mmol/L高糖刺激培养PBMCs后NR2E1 mRNA及蛋白水平 A. NR2E1 mRNA相对表达量;B. Western blot检测NR2E1蛋白水平表达;C.经GAPDH为内参校正后NR2E1蛋白相对表达量;D.细胞上清液中TNF-α及IL-6的浓度;**P<0.01 |
|
图 3 体外250 μmol/L棕榈酸(PA)刺激培养PBMCs后NR2E1 mRNA及蛋白水平 A. NR2E1 mRNA相对表达量;B. Western blot检测NR2E1蛋白水平表达;C.经GAPDH为内参校正后NR2E1蛋白相对表达量;D.细胞上清液中TNF-α及IL-6的浓度;**P<0.01 |
糖尿病组患者血浆TNF-α和IL-6浓度高于对照组[分别为(94.54±28.94) vs (49.21±6.95) pg/ml,P<0.01;(18.53±6.58) vs (7.53±1.15) pg/ml,P<0.01]。同时,16.7 mmol/L葡萄糖及250 μmol/L棕榈酸刺激PBMCs的上清中TNF-α和IL-6的浓度较未刺激组明显增加[分别为0 vs 16.7mmol/L葡萄糖:TNF-α: (98.00±9.30) vs (21.60±2.42) pg/ml,P<0.01;IL-6 (17.78±1.58) vs (7.54±0.87) pg/ml,P<0.01;0 vs 250 μmol/L棕榈酸:TNF-α: (122.55±15.61) vs (22.03±2.04) pg/ml,P<0.01;IL-6 (29.01±1.62) vs (7.58±0.60) pg/ml,P<0.01]。
2.4 糖尿病患者NR2E1以及其他参数相关性分析在年龄、性别、BMI均衡的情况下,NR2E1 mRNA与HbA1c (r=0.772,P<0.01)、HOMA-IR指数(r=0.811,P<0.01)以及FFAs (r=0.752,P<0.01)呈明显正相关。此外,NR2E1 mRNA与炎症相关因子,如hs-CRP (r=0.492,P<0.05),TNF-α蛋白(r=0.625,P<0.01),IL-6蛋白(r=0.630,P<0.01)密切相关。
3 讨论本研究首次发现新诊断2型糖尿病患者外周血单个核细胞中NR2E1 mRNA和蛋白水平较对照组明显增加,健康志愿者PBMCs经高糖、高脂刺激后NR2E1的表达较未刺激组明显升高。仅在真涡虫中观测到进食状态中NR2E1表达较空腹状态高[6],目前尚无NR2E1与糖脂代谢相关的研究报道。NR2E1能够募集P53、Pax6、Gli2(GLI family zinc finger 2)等辅助因子及调控SHH (sonic hedgehog)、Wnt/β-catenin、MAPK (mitogen-activated protein kinases)等信号通路[7],其中Pax6、Gli2等转录因子与胰岛β细胞功能密切相关[8]。我们推测,高糖高脂可能增加NR2E1的表达,但NR2E1与糖脂毒性的相互作用机制尚需进一步研究。
慢性低度炎症和免疫系统的活化在2型糖尿病发生发展中起着重要作用。在2型糖尿病患者的脂肪组织、肝脏、肌肉和胰腺中均可观察到炎症反应,并伴有巨噬细胞的浸润。巨噬细胞分泌的促炎性细胞因子包括TNF-α、IL-6和IL-1β以自分泌和旁分泌的方式激活JNK通路和NF-κB通路从而干扰外周组织胰岛素信号传导,促进胰岛素抵抗。同时,游离脂肪酸也可激活NF-κB通路促进TNF-α、IL-6等炎症因子的释放,进一步促进胰岛素抵抗的形成。C反应蛋白(CRP)是IL-6调控下肝脏分泌的炎症反应标记物,超敏CRP (hs-CRP)与胰岛素抵抗相关。长期高浓度炎症因子刺激可导致β细胞功能障碍和凋亡[9]。慢性低度炎症刺激能引起胰岛β细胞数量减少,功能障碍以及糖刺激胰岛素分泌减少[10, 11]。我们的研究显示,新诊断2型糖尿病患者外周血中游离脂肪酸,hs-CRP、炎症因子TNF-α、IL-6表达水平较对照组明显升高。体外培养的健康志愿者PBMCs经高糖高脂刺激后炎症因子的表达较未刺激PBMCs明显升高。这些结果与之前的研究相符[12]。同时,我们的研究首次发现新诊断2型糖尿病患者NR2E1表达水平与TNF-α、IL-6表达水平呈正相关。有文献报道中枢神经系统涉及免疫及炎症紊乱相关疾病,如神经退行性病变,与NR2E1有关[13]。NR2E1能够调控炎症因子IL-1β对NSPCs (neural stem progenitor cells)增殖和分化的损伤[14],在NSPCs中可观察到IL-1β与NR2E1表达呈剂量依赖性。我们的研究提示,其他的炎症相关疾病,如2型糖尿病,也可能与NR2E1表达有关。我们的研究结果表明在新诊断2型糖尿病患者中,NR2E1表达水平与HbA1c、TG、HOMA-IR等因素相关,进一步提示NR2E1表达水平可能与糖脂水平,胰岛素抵抗相关,但尚需在动物与细胞实验中通过敲除或过表达NR2E1进一步研究NR2E1在糖脂代谢中的作用。
| [1] | Aguiree FBA, Cho NH, Dahlquist G, et al. IDF Diabetes Atlas. 6th ed[C]. Brussels, Belgium: International Diabetes Federation, 2013. |
| [2] | Daniele G, Guardado Mendoza R, Winnier D, et al. The inflammatory status score including IL-6, TNF-alpha, osteopontin, fractalkine, MCP-1 and adiponectin underlies whole-body insulin resistance and hyperglycemia in type 2 diabetes mellitus[J]. Acta Diabetol, 2014, 51: 123-131. DOI: 10.1007/s00592-013-0543-1. |
| [3] | Ghanim H, Aljada A, Hofmeyer D, et al. Circulating mononuclear cells in the obese are in a proinflammatory state[J]. Circulation, 2004, 110: 1564-1571. DOI: 10.1161/01.CIR.0000142055.53122.FA. |
| [4] | Young KA, Berry ML, Mahaffey CL, et al. Fierce: a new mouse deletion of Nr2e1; violent behaviour and ocular abnormalities are background-dependent[J]. Behav Brain Res, 2002, 132: 145-158. DOI: 10.1016/S0166-4328(01)00413-2. |
| [5] | Ramayo-Caldas Y, Fortes MR, Hudson NJ, et al. A marker-derived gene network reveals the regulatory role of PPARGC1A, HNF4G, and FOXP3 in intramuscular fat deposition of beef cattle[J]. J Anim Sci, 2014, 92: 2832-2845. DOI: 10.2527/jas.2013-7484. |
| [6] | Raska O, Kostrouchova V, Behensky F, et al. SMED-TLX-1 (NR2E1) is critical for tissue and body plan maintenance in Schmidtea mediterranea in fasting/feeding cycles[J]. Folia Biol (Praha), 2011, 57: 223-231. |
| [7] | Sehgal R, Sheibani N, Rhodes SJ, et al. BMP7 and SHH regulate Pax2 in mouse retinal astrocytes by relieving TLX repression[J]. Dev Biol, 2009, 332: 429-443. DOI: 10.1016/j.ydbio.2009.05.579. |
| [8] | Sun G, Alzayady K, Stewart R, et al. Histone demethylase LSD1 regulates neural stem cell proliferation[J]. Mol Cell Biol, 2010, 30: 1997-2005. DOI: 10.1128/MCB.01116-09. |
| [9] | Zhang S, Kim KH. TNF-alpha inhibits glucose-induced insulin secretion in a pancreatic beta-cell line (INS-1)[J]. FEBS Lett, 1995, 377: 237-239. DOI: 10.1016/0014-5793(95)01272-9. |
| [10] | Handschin C, Choi CS, Chin S, et al. Abnormal glucose homeostasis in skeletal muscle-specific PGC-1alpha knockout mice reveals skeletal muscle-pancreatic beta cell crosstalk[J]. The Journal of Clinical Investigation, 2007, 117: 3463-3474. DOI: 10.1172/JCI31785. |
| [11] | Wensveen FM, Jelencic V, Valentic S, et al. NK cells link obesity-induced adipose stress to inflammation and insulin resistance[J]. Nat Immunol, 2015, 16(4): 376-385. DOI: 10.1038/ni.3120. |
| [12] | Xue J, Zhao H, Shang G, et al. RIP140 is associated with subclinical inflammation in type 2 diabetic patients[J]. Exp Clin Endocrinol Diabetes, 2013, 121: 37-42. |
| [13] | Shi Y. Orphan nuclear receptors in drug discovery[J]. Drug Discov Today, 2007, 12: 440-445. DOI: 10.1016/j.drudis.2007.04.006. |
| [14] | Green HF, Nolan YM. Unlocking mechanisms in interleukin-1beta-induced changes in hippocampal neurogenesis--a role for GSK-3beta and TLX[J]. Transl psychiatry, 2012, 2: e194. DOI: 10.1038/tp.2012.117. |
 2016, Vol. 37
2016, Vol. 37

