2. 广州军区武汉总医院 湖北 武汉 430070
2. Wuhan General Hospital of Guangzhou Military Command, Wuhan 430070, China
呼吸道合胞病毒(respiratory syncytial virus,RSV)属于副黏病毒科,肺炎病毒属,核心为单股RNA,外有核壳,最外一层为带刺状突起的包膜。因不含血凝素,故无血凝作用。RSV病毒能在人体呼吸道细胞和人肾、猴肾等细胞中生长培养,并产生明显的细胞病变[1]。RSV是婴幼儿下呼吸道感染的重要病原,每年约有将近50%住院治疗的婴幼儿毛细支气管炎和25%的婴幼儿肺炎是RSV感染所致。文献报道,出生后第1年,大约一半婴儿感染过RSV,超过65%的1岁前感染过RSV的儿童在2岁时RSV再感染率高达100%,其主要病变累及毛细支气管、支气管和肺泡而致RSV肺炎,临床表现为发热、咳嗽和呼吸困难、喘憋等,RSV所致肺炎临床表现较危重,病死率高[2]。
目前临床应用利巴韦林和干扰素治疗RSV感染[3],可减轻症状,缩短病程和排毒时间,但存在疗效不够理想,有明显的毒副作用等不足之处。另外RSV感染后,患者免疫力不强,自然感染不能防止再感染。母体通过胎盘传给胎儿的抗体亦不能防止婴儿被感染[4]。至今未有安全有效的预防疫苗,灭活疫苗接种会使感染更加严重[5]。因此开发一种高效、安全、副作用少的抗RSV新药具有重大意义。
多年来我们一直从事筛选中药有效成分抗病毒研究,从茶叶中提取其重要成分儿茶素,并通过体内外药效学试验证实该成分对H1N1、H5N1等各型流感病毒均有抑制作用,此项成果已申请专利。我国中草药资源丰富、毒副作用小、价格低廉、在病毒性疾病的治疗中有潜在优势[6],以茶叶为原料开发抗呼吸道感染新药,符合当前国家预防重大传染病的战略需求,同时还可推动我国的中药产业化研究的进一步发展,在近期内实现明显的经济效益。
1 材料与方法 1.1 体内实验试剂、细胞及病毒表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)由Sigma公司提供,母液浓度为20 mg/ml,过滤除菌分装,4 ℃避光保存,实验前用含2%的胎牛血清的DMEM培养基稀释到所需浓度。Hep-2细胞由武汉大学医学病毒学研究所保存,DMEM基础培养液中加入10 %的新生胎牛血清,100 kU/L青霉素,100 mg/L链霉素,置37 ℃培养箱中培养传代。呼吸道合胞病毒(RSV)由武汉大学医学病毒学研究所保存,并用R eed-Muench法测定其TCID50 (组织培养感染剂量)为10-4.6/ml。
1.2 EGCG细胞毒性实验DMEM (含10%胎牛血清,V/V)培养的Hep-2细胞用胰酶消化后稀释成1×105-3×105个/ml,每孔100 μl接种于96孔板。细胞长成单层后,加入用DMEM (含2%胎牛血清,V/V)稀释的不同浓度(2,4,8,16,32,64和128 μg/ml)的EGCG,培养24 h,通过MTT法检测Hep-2细胞的存活率。Hep-2细胞存活率=药物组平均OD值/细胞对照组平均OD值×100%。
1.3 EGCG抗病毒吸附作用取不同浓度的EGCG (2,4,8,16,32 μg/ml)加入已长满80%单层Hep-2细胞的96孔板中,37 ℃孵育2 h,弃上清,PBS洗3次,再加入100 TCID50 RSV (10-2.6/ml)病毒20 μl/孔,35 ℃吸附1 h,弃上清,PBS洗3次,再加入细胞维持液100 μl/孔,35 ℃培养,观察细胞病变效应(CPE),待到病毒对照孔CPE呈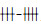
病毒抑制率=(实验组OD值-病毒对照组OD值)/(细胞对照组OD值-病毒对照组OD值)×100 %
1.4 EGCG对病毒直接作用取不同浓度EGCG (2,4,8,16,32 μg/ml)各100 μl分别与20 μl的100 TCID50(10-2.6/ml)的RSV病毒液混合,于35 ℃作用1 h,随后将药物和病毒的混合液加入已长满80%单层Hep-2细胞的96孔板中,置于培养箱中35 ℃吸附1 h,弃上清,用PBS洗3次,最后加细胞维持液100 μl /孔,37 ℃培养,观察CPE,待到病毒对照孔CPE呈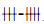
先用100TCID50 RSV (10-2.6/ml)病毒20 μl /孔感染已长满80%单层Hep-2细胞,35 ℃吸附1 h后,弃病毒液,于培养孔中加入含不同浓度EGCG (2,4,8,16,32 μg/ml)100 μl/孔,37 ℃培养,观察CPE,待到病毒对照孔CPE呈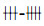
随机将15-17 g的BALB/c小鼠(购自武汉大学A3动物中心,动物质量合格证:4200500387)分成5组,即正常对照组、安慰剂对照组(Pla,即RSV病毒感染阳性对照组)、高剂量组[HD,1 000 mg/(kg·d)]、中剂量组[MD,500 mg/(kg·d)]、低剂量组[LD,250 mg/(kg·d)],每组10只饲养于独立通气笼盒(individual ventilated cages,IVC)系统中。正常对照组:小鼠在乙醚麻醉后鼻腔滴注50 μl无血清DMEM高糖培养基,待全部吸入鼻腔后2 h,按照0.2 ml/10 g给予生理盐水灌胃; Pla组:小鼠在乙醚麻醉后鼻腔滴注50 μl 4.5×106 PFU/ml的RSV,待全部吸入鼻腔后2 h,按照0.2 ml/10 g生理盐水灌胃; HD、MD和LD组:小鼠在乙醚浅麻醉后鼻腔滴注50 μl 4.5×106 PFU/ml的RSV,待全部吸入鼻腔后2 h,按照0.2 ml/10 g,根据给药量1 000 mg/(kg·d)制备相应浓度的药物,灌胃给药,各组连续灌胃7 d。
1.7 肺组织病理切片治疗7 d后将小鼠麻醉处死,无菌取肺组织,并观察其外观,称重,计算肺指数。右肺放入4%甲醛固定24 h后行冲水、脱水、透明、浸蜡和包埋。切片后HE染色,镜下观察肺组织受损和炎症浸润情况。
1.8 肺组织中RSV核酸检测对各组所收集的小鼠肺组织应用实时定量RT-PCR检测RSV核酸水平,所用引物及具体过程为:针对RSV病毒M基因的保守区域设计引物探针; RSV F:5′-TGGAAACATACGTGAACAAGC-3′
RSV R:5′-ACATGGGCACCCATATTG TA-3′
RSVPF:5′-FAM-TCCACATACACAGCTGCTGTTCAAT-TRAMA-3′。
反应条件:40 ℃ 30 min,95 ℃ 3 min; 然后93 ℃ 45 s,55 ℃ 15 s,10个循环(预扩增); 93 ℃ 45 s,55 ℃ 15 s,30个循环。
1.9 空斑试验检测RSV病毒滴度对各组所收集的小鼠肺组织应用空斑实验检测小鼠肺组织匀浆(按10 ml/g加入组织平衡液(pH 7.4,0.01 mol/L Tris-HCL,0.000 1 mol/L EDTA-2Na,0.01 mol/L蔗糖,0.8%的氯化钠溶液),研磨肺组织,4 ℃ 10 000 r/min离心5 min,取上清-80 ℃保存)病毒滴度。
1.10 统计学分析实验所得到的数据用统计软件SPSS 13的Probit回归法计算药物半数毒性浓度TC50和半数有效浓度IC50,得到药物治疗指数(treatment index,TI=TC50 / IC50)。采用治疗指数作为评价指标来衡量各药物浓度对病毒抑制的效力。采用Linear-Regression分析不同作用方式下,不同浓度的EGCG提取物与各指标(细胞存活率、病毒抑制率)之间进行相关性分析。
2 结果 2.1 EGCG对Hep-2细胞的毒性作用EGCG对Hep-2细胞毒性作用表现为:细胞粘连、变圆、破碎脱落,胞质内颗粒增加,折光性增强并且吸光值明显下降。随着EGCG的浓度增加细胞存活率呈递减趋势,用SPSS 13.0的Probit回归法计算、经直线回归分析,药物浓度与细胞存活率之间存在直线相关关系(r2=0.80,P < 0.05),EGCG半数毒性浓度TC50为51.8 μg/ml。结果见表 1。
| 表 1 EGCG对Hep-2细胞的毒性作用 |
目测含不同浓度的EGCG的实验组各孔组均出现以细胞肿胀变圆,折光度增强,聚集成葡萄串状为特征的典型CPE,随着EGCG的浓度增加细胞存活率呈递增趋势,用SPSS 13.0的Probit回归法计算、经直线回归分析,药物浓度与细胞存活率之间存在直线相关关系(r2=0.96,P < 0.05),结果见表 2。
| 表 2 EGCG抗病毒预防作用 |
实验结果显示各药物处理组病毒抑制率与病毒对照组无显著差异,且不受药物浓度的影响,表明EGCG对RSV无直接杀伤作用。用SPSS 13.0的Probit回归法计算、经直线回归分析,药物浓度与细胞存活率之间存在直线相关关系(r2=0.25,P>0.05),结果见表 3。
| 表 3 EGCG抗病毒直接杀伤作用 |
EGCG在2-32 μg/ml范围内,对RSV有明显抑制作用,并且EGCG在该浓度范围内,病毒抑制率与药物浓度呈对数直线关系(r2=0.93,P < 0.05),EGCG的抗病毒生物合成的半数有效浓度IC50为5.77 μg/ml,治疗指数(TI)为8.97,表明EGCG对RSV有抗细胞内生物合成作用。结果见表 4。
| 表 4 EGCG抗病毒生物合成作用 |
肺组织外观从大体解剖可见:对照组肺脏呈淡粉红色,弹性好; RSV组肺脏明显充血,有大片暗红色实变病灶,甚至弥漫整个肺叶; EGCG组肺脏病变较轻,充血不明显,实变病灶范围较小。从表 5中可看出RSV组体重减轻,而肺重增加,肺指数提高,与对照组比较有显著性差异(P < 0.01),EGCG组与RSV组比较,体重增加,肺重降低,肺指数降低,且具有显著性差异(P < 0.05)。
| 表 5 EGCG对小鼠肺指数的影响 |
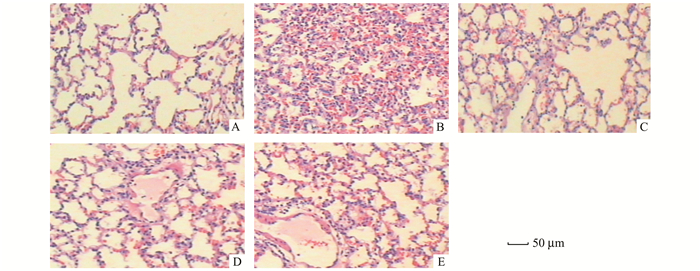
对各组所收集的小鼠肺组织进行HE染色病理切片观察。结果显示,正常对照组小鼠肺组织HE染色无明显炎症改变,而安慰剂对照组小鼠在接种病毒第3天肺组织呈明显炎症反应,肺泡上皮增生肥大,肺泡内有浆液性渗出物和红细胞渗出,淋巴细胞、吞噬细胞浸润,间质充血,增厚; 终末及细小支气管黏膜上皮细胞坏死脱落,炎性细胞浸润,管周有片状或弥漫性炎性细胞浸润,主要是淋巴细胞,偶见嗜酸粒细胞,并可见多核细胞。HD组、MD组和LD组小鼠肺组织病理改变程度均轻于Pla组,肺泡壁炎性病变逐渐减轻,炎性细胞浸润减少肺内各级支气管结构基本正常,上皮无增生,脱落; 管周无淋巴细胞增生和炎性细胞浸润,肺泡间隔无明显增厚,肺泡内无炎性渗出。且随着给药浓度的逐渐增加,肺组织的炎症改变程度逐渐减轻(图 1)。
|
图 1 EGCG对感染RSV小鼠肺部炎症的影响 A.正常对照组; B.病毒对照组(Pla); C.EGCG高剂量(HD); D.EGCG中剂量(MD); E.EGCG低剂量(LD) |
对各组所收集的小鼠肺组织应用实时定量RT-PCR检测RSV核酸水平,结果显示:HD组、MD组和LD组小鼠肺组织病毒核酸表达量下降,与安慰剂对照组相比变化有明显差异,病毒核酸表达抑制率与药物浓度呈对数直线关系(r2=0.9847,P < 0.05),存在显著的量效关系,结果见图 2。
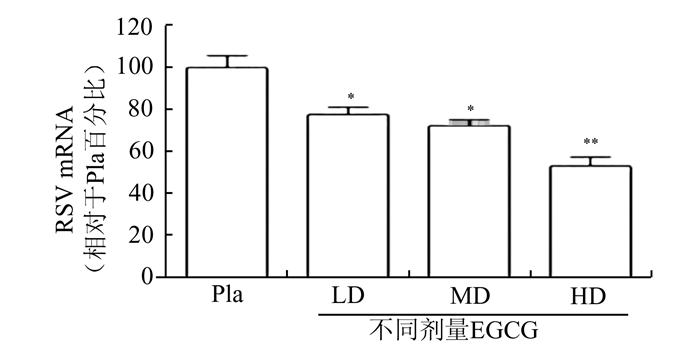
|
图 2 EGCG对RSV感染小鼠肺组织中病毒核酸的影响 |
对各组所收集的小鼠肺组织应用空斑实验检测小鼠肺组织匀浆病毒滴度,结果发现随着EGCE浓度的增加,各给药组RSV病毒滴度显著减少; 且给药组与安慰剂对照组比较,差异均具有显著性(P < 0.05)(图 3),结果表明灌胃给予EGCG能降低RSV在小鼠体内复制。
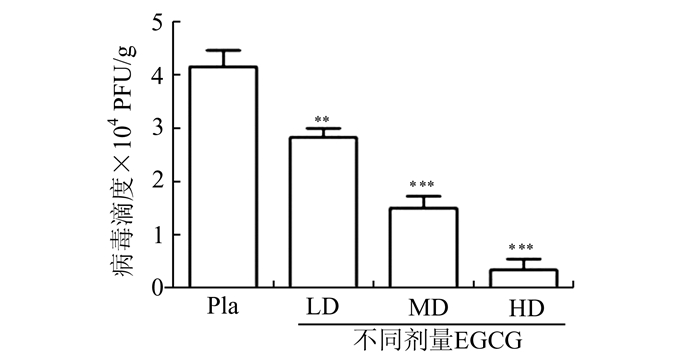
|
图 3 EGCG对RSV感染小鼠肺组织中病毒滴度的影响 |
茶多酚是从茶叶中提取的一类组成复杂、相对分子质量不同、性质与结构差异很大的多羟基酚类混合物。其中以儿茶素为主的黄烷醇类化合物是茶多酚的主体部分,占茶多酚总量的60%-80%,包括表没食子儿茶素没食子酸酯(EGCG)、表没食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)、表儿茶素(EC),尤其是EGCG最引人注目,在茶叶生物化学中研究最广泛、最深入。EGCG是茶叶中特有的儿茶素,含量最高,占茶多酚制品的40%-50%[7],它是2-连苯酚基苯并吡喃与没食子酸形成的酯,同时因其结构中有6个邻位酚羟基而具有优于其他儿茶素的许多性质。现代科学研究表明EGCG具有显著的抗突变、抗氧化作用,能增强机体免疫力,抑制肿瘤生长,减少肝脂和胆固醇的生成,且对痢疾、伤寒、金黄色葡萄球菌也有很强的抑制作用[8, 9]。国外有文献报道EGCG体外可通过抑制HIV-1逆转录酶的活性发挥抗HIV的作用[10],另外还可通过抑制细胞内内涵体或溶酶体的酸化影响流感病毒的感染性[11]。但未见报道EGCG抗RSV。本实验旨在通过观察细胞病变效应(CPE)[12]、噻唑蓝(MTT)[13]比色法检测细胞存活率和病毒抑制率,以及通过病毒滴定检测病毒滴度来对EGCG抗RSV的作用效果及其抗病毒机制进行研究,从而为EGCG体内抗RSV研究以及临床前试验提供理论依据。
针对RSV病毒的复制特点,设置了EGCG对RSV的直接灭活作用、EGCG对RSV吸附的影响以及抗病毒生物合成作用3个实验组,初步研究了EGCG抗RSV机制。研究结果显示,EGCG预先与细胞孵育24 h后再感染RSV,则发现EGCG可抑制病毒复制,EGCG半数有效浓度(IC50)为5.49,治疗指数为9.43(表 2)。推测EGCG可能与细胞的病毒受体竞争性结合,阻断了病毒的吸附,达到了预防作用。但EGCG对RSV的直接灭活作用的各剂量组均出现细胞皱缩、变圆、脱落、不聚集、碎裂等CPE特征,这提示EGCG对RSV病毒无直接杀伤作用或抑制其活性(表 3)。此外,研究还发现EGCG抗病毒生物合成组IC50为5.77 μg/ml,治疗指数8.97,并在2-32 μg/ml范围内呈明显的直线关系,这提示EGCG具有抗病毒生物合成作用(表 4)。同时通过MTT法检测细胞存活率,显示EGCG对Hep-2细胞毒性很低,其TC50为51.8 μg/ml (表 1)。这均说明在体外,EGCG在无毒浓度范围就具有抗RSV的作用。
本实验先建立了RSV感染BALB/c小鼠的动物模型,然后用不同浓度EGCG治疗7 d,从小鼠肺组织分离RSV。RSV组小鼠体重减轻,而肺重增加,肺指数提高,与对照组比较有显著性差异,经过不同浓度EGCG治疗后,体重增加,肺重降低,肺指数降低(表 5)。各组小鼠肺的肉眼所见,RSV组肺组织弹性差,外观呈灰白色或暗紫色,说明RSV感染后的鼠肺有明显的水肿,瘀血; HE染色后镜下观察,RSV感染鼠肺血管、毛细支气管旁及肺泡出现水肿和不同程度的炎症浸润,细支气管可见上皮损伤及管腔阻塞,肺泡毛细血管内皮肿胀,囊泡形成。经过不同浓度EGCG治疗后有较明显的改善肺部微循环,清除血小板聚集,消除肺部炎症修复肺损伤的作用(图 1)。检测RSV mRNA表明,HD、MD和LD组的RSV病毒拷贝数明显低于RSV感染组,统计学有极显著差异,表明EGCG在RSV感染的动物体内有抑制病毒作用(图 2)。RSV感染后2 h给药,连续灌胃给药7 d,不同浓度EGCG处理后可明显抑制小鼠肺组织中的病毒复制,且随着给药剂量的增加,感染小鼠肺组织中病毒滴度逐渐降低(图 3)。
通过上述研究,本研究发现EGCG在体外和体内均能抑制RSV感染,且无毒副作用。EGCG在体外能保护细胞免受RSV的感染和抑制RSV在细胞内的复制,在体内能抑制RSV在小鼠体内的复制并减轻病毒感染所致的组织病理损害,降低病毒滴度。基于此,EGCG可用于制备抗RSV的药物,同时也可用于制备治疗和/或预防RSV引起的肺部疾病的药物。
| [1] | Saito ST, Gosmann G, Pungartnik C, et al. Green tea extract-patents and diversity of uses[J]. Recent Pat Food Nutr Agric, 2009, 1(3): 203-215. DOI: 10.2174/2212798410901030203. |
| [2] | Shay DK, Holman RC, Roosevelt GE, et al. Bronehiolltis-associated mortality and estimates of respiratory syneytial virus associated deaths among US children, 1979-1997[J]. J Infect Dis, 2001, 183(1): 16-22. DOI: 10.1086/jid.2001.183.issue-1. |
| [3] | Goritzka M, Makris S, Kausar F, et al. Alveolar macrophage-derived type Ⅰ interferons orchestrate innate immunity to RSV through recruitment of antiviral monocytes[J]. J Exp Med, 2015, 212(5): 699-714. DOI: 10.1084/jem.20140825. |
| [4] | 王新佳. 呼吸道合包病毒的研究进展[J]. 中国医刊, 2013, 48(1): 15-18. |
| [5] | Zhang YW, Yuan LC, Zhang YM, et al. Burden of respiratory syncytial virus infections in China: Systematic review and meta-analysis[J]. J Glob Health, 2015, 5(2): 1-7. |
| [6] | 李慧, 贾新华. 中药抗病毒机制的研究进展[J]. 江苏中医药, 2015, 47(6): 82-85. |
| [7] | Hsu S. Compounds Derived from Epigallocatechin-3-Gallate (EGCG) as a Novel Approach to the Prevention of Viral Infections[J]. Inflamm Allergy Drug Targets, 2015, 14(1): 13-18. DOI: 10.2174/1871528114666151022150122. |
| [8] | Welliver RC. Respiratory syncytial virus and other respiratory viruses[J]. Pediatr Infect Dis J, 2003, 22(2): 6-12. DOI: 10.1097/00006454-200302001-00002. |
| [9] | Yang GY, Liao J, Li CC, et al. Effect of black tea and green tea polyphenols on c-jun phosphorylation and H2O2 production in transformed and nontransformed human bronchial cell lines: possible mechanisms of cell growth inhibition and apoptosis induction[J]. Carcinogenesis, 2000, 21: 2035-2039. DOI: 10.1093/carcin/21.11.2035. |
| [10] | Fassina G, Buffa A, Benelli R, et al. Polyphenolic antioxidant (-)-epigallocatechin-3-gallate from green tea as a candidate anti-HIV agent[J]. AIDS, 2002, 16(6): 939-941. DOI: 10.1097/00002030-200204120-00020. |
| [11] | 朱萍, 谷红静, 谢正德, 等. 呼吸道合胞病毒的分离鉴定及其致病力的初步评价[J]. 免疫学杂志, 2015, 62(4): 322-325. |
| [12] | Pozzolini M, Scarfi S, Benatti U, et al. Interference in MTT cell viability assay in activated macrophage cell line[J]. Anal Biochem, 2003, 313(2): 338-348. DOI: 10.1016/S0003-2697(02)00631-0. |
| [13] | Kim M, Kim SY, Lee HW, et al. Inhibition of influenza virus internalization by (-)-epigallocatechin-3-gallate[J]. Antiviral Research, 2013, 100(2): 460-472. DOI: 10.1016/j.antiviral.2013.08.002. |
 2016, Vol. 37
2016, Vol. 37



 为25%-50%细胞出现CPE;
为25%-50%细胞出现CPE;  为50%-75%细胞出现CPE
为50%-75%细胞出现CPE


 为25%-50%细胞出现CPE;
为25%-50%细胞出现CPE;  50%-75%细胞出现CPE
50%-75%细胞出现CPE

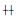
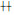 为25%-50%细胞出现CPE;
为25%-50%细胞出现CPE; 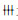 为50%-75%细胞出现CPE
为50%-75%细胞出现CPE


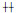
 为25%-50%细胞出现CPE;
为25%-50%细胞出现CPE;  为50%-75%细胞出现CPE
为50%-75%细胞出现CPE