2. 湖北省黄冈市中心医院 湖北 黄冈 438000
2. Dept. of Medical Oncology, Central Hospital of Huanggang City, Huanggang 438000, Hubei, China
宫颈癌是一种严重危害妇女健康的恶性肿瘤性疾病,目前宫颈癌已成为全世界范围内女性发病率第3位、死亡率第4位的恶性肿瘤[1]。我国子宫颈癌粗发病率由1989至1990年的3.06/10万上升到2007至2008年的11.87/10万[2]。治疗前对宫颈癌临床病理特征进行准确的评估,是取得成功治愈的关键。鳞状细胞癌抗原(squamous cell carcinoma antigen, SCC-Ag)自1977年发现以来,作为宫颈鳞癌的肿瘤标志物,其血清水平高低与宫颈鳞癌发生发展关系密切,被用于宫颈鳞癌的辅助诊断、预后评估、治疗评价及复发随访中。目前关于SCC-Ag与宫颈鳞癌临床病理特征相关性的研究较多,但结论尚不统一。淋巴结转移是宫颈癌预后相关最主要的危险因素, Ⅱ期以下宫颈癌不伴淋巴结转移的患者5年生存率约100%,而伴有淋巴结转移者仅为63.4%[3]。治疗前对患者淋巴结转移状态进行初步评估有助于个体化治疗并为手术提供有价值的参考。关于治疗前SCC-Ag对淋巴结转移的预测作用研究较少且争议较大。本研究对我院2011年1月-2014年12月收治的237例治疗前行血清SCC-Ag检测并行根治性手术(广泛性全子宫切除+盆腔淋巴结清扫术)的宫颈鳞癌患者的临床资料进行回顾性分析,探讨鳞状细胞癌抗原(SCC-Ag)与ⅠB1-ⅡB期宫颈鳞癌患者临床病理特征的相关性,尤其是对淋巴结转移的预测价值。
1 资料与方法 1.1 研究对象及其临床病理特征依次选入自2011年1月-2014年12月在我院放化疗科及妇瘤科住院且资料完整的宫颈鳞癌患者。入选条件为:①经病理证实的ⅠB1-ⅡB期宫颈鳞癌患者[按国际妇产科联盟(FIGO)2009年的诊断标准], 无其他原发恶性肿瘤病史;②治疗前检测血清SCC-Ag滴度;③所有患者初始治疗为广泛性全子宫切除+盆腔淋巴结清扫术;④排除其他影响血清SCC-Ag水平的疾病,如天疱疮、肾衰竭等非肿瘤性疾病。符合以上条件者共237例。
患者的平均年龄48岁(22-83岁),其中≤35岁者14例,>35者223例。ⅠB1期73例,ⅠB2期23例,ⅡA1期76例,ⅡA2期31例,ⅡB期34例。根据术后病检结果,低分化75例,中-低分化29例,中分化98例,高-中分化16例,高分化19例。菜花型生长137例,结节型生长34例,溃疡型生长36例,糜烂型生长30例。肿瘤直径≤4 cm者170例,>4 cm者67例。伴脉管内癌栓20例,不伴者217例。肌层浸润深度 < 1/2者125例,≥1/2者97例,侵犯全层者15例。淋巴结阳性者52例,阴性者185例。宫旁阳性者15例,阴性者222例。其中有恶性肿瘤家族史者31例,无家族史者206例。
1.2 血清SCC-Ag的检测所有患者治疗前应用酶联免疫法测定血清SCC-Ag浓度。取所有患者SCC-Ag滴度的中位数2.2 ng/ml为阳性界值。
1.3 统计学方法采用SPSS 21.0统计软件进行分析。单因素比较采用χ2检验,多因素分析采用Logistic回归模型分析;绘制受试者工作特征(recevier operator characteristic, ROC)曲线, 明确治疗前血清SCC-Ag对淋巴结转移的预测价值,并筛选最佳界值。以P < 0.05为差异有统计学意义。
2 结果 2.1 血清SCC-Ag滴度与宫颈鳞癌患者临床病理特征的相关性分析结果单因素分析显示,治疗前SCC-Ag滴度升高与肿瘤直径、淋巴结转移、肿瘤分化相关(P < 0.05),见表 1。我们进一步采用多因素Logistic回归模型将以上可能影响治疗前SCC-Ag水平的临床病理特征进行分析,结果显示,肿瘤直径≥4 cm (P < 0.01)、淋巴结转移(P < 0.05)、脉管癌栓(P < 0.05)、高中分化(P < 0.01)均是影响血清SCC-Ag≥2.2 ng/ml的独立危险因素。其中肿瘤直径≥4 cm影响最大,然后依次为脉管癌栓、淋巴结转移、肿瘤细胞分化好,见表 2。
| 表 1 治疗前SCC-Ag水平与临床病理特征的单因素分析 |
| 表 2 SCC-Ag水平与临床病理特征的Logistic回归分析 |
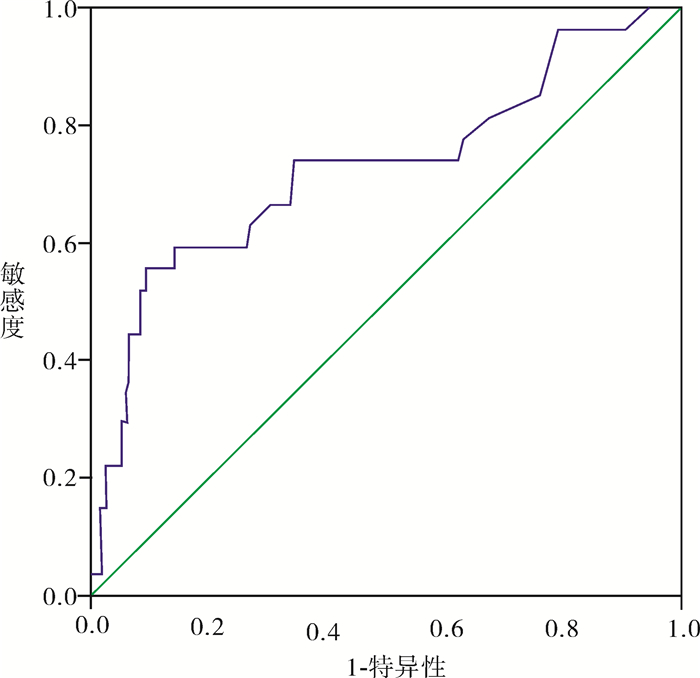
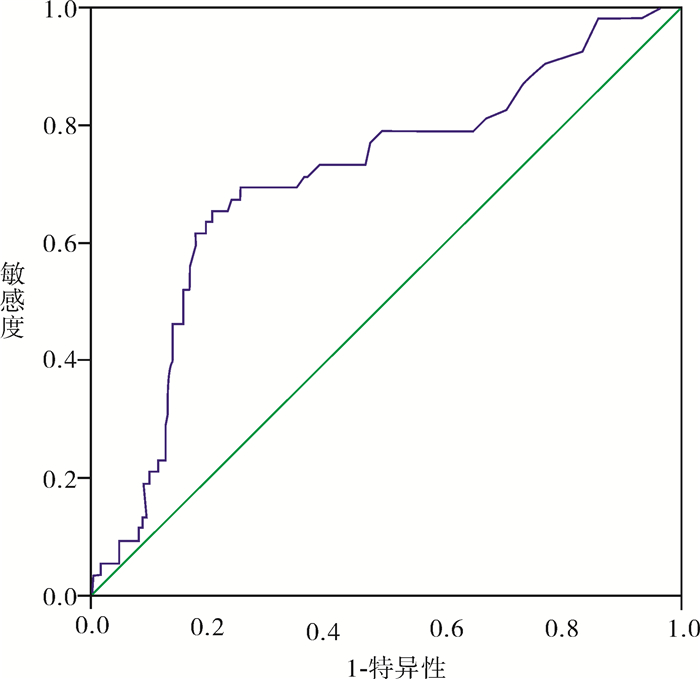
将237例患者中淋巴结阳性组和淋巴结阴性组的各SCC-Ag值代入统计软件中绘制ROC曲线(图 1)。曲线下面积为0.705,P < 0.01,95%可信区间为0.622-0.789,诊断价值中等。当临界值为5.4 ng/ml,灵敏度加特异度值最大。继续排除肿瘤直径的影响,绘制ⅠB1、ⅡA1期SCC-Ag水平预测宫颈鳞癌淋巴结转移的ROC曲线(图 2),结果显示曲线下面积为0.728,P < 0.01,95%可信区间为0.608-0.848。当临界值为7.4 ng/ml,灵敏度与特异度之和最大。两组曲线不同SCC-Ag水平的灵敏度、特异度、阳性预测值、阴性预测值见表 3。而ⅠB2、ⅡA2期绘制的ROC曲线显示曲线下面积为0.598。
|
图 1 治疗前血清SCC-Ag水平(237例)预测淋巴结转移的ROC曲线 |
|
图 2 ⅠB1、ⅡA1期患者治疗前SCC-Ag水平预测淋巴结转移的ROC曲线 |
| 表 3 不同SCC-Ag临界值对淋巴结转移的预测价值 |
SCC-Ag是肿瘤相关抗原TA-4的亚单位,分子质量为48 000 U的糖蛋白。SCC-Ag由正常鳞状细胞产生的,鳞癌组织的快速生长使得SCC-Ag大量分泌并扩散入血[4]。SCC-Ag已成为检测宫颈鳞癌最可靠的肿瘤标志物。
多项研究已证实血清SCC-Ag水平升高与宫颈鳞癌肿块大、分期晚、分化好、间质浸润深和淋巴结转移密切相关[5-8]。本研究Logistic回归多因素分析显示,影响宫颈鳞癌治疗前SCC-Ag滴度水平的独立危险因素包括:肿瘤直径、有无脉管癌栓、淋巴结状态、肿瘤细胞分化程度。我们发现肿瘤直径对SCC-Ag滴度水平影响最大, 肿瘤直径>4 cm时SCC-Ag水平升高的相对危险度为≤4 cm的7.39倍。肿瘤体积随着肿瘤直径增加而增大,容易分泌更多的SCC-Ag入血。脉管内存在的癌栓分泌的SCC-Ag直接进入血液循环,而淋巴结转移患者癌细胞分泌的SCC-Ag通过淋巴循环进入血液。以上因素导致肿瘤负荷增加,分泌的SCC-Ag增加,肿瘤侵袭性增强,分泌的SCC-Ag更容易入血,从而导致血清SCC-Ag水平较正常升高。高、中分化患者的血清SCC-Ag水平较低分化者升高,与SCC-Ag主要在角化细胞及未角化大细胞中表达,而小细胞中仅有少量表达有关。
淋巴结转移是影响浸润性宫颈癌预后的主要危险因素,因此临床医师在术前了解淋巴结状态显得尤为重要。对于高度怀疑淋巴结转移的患者,可以采取更加有效的治疗方式,如增加腹主动脉旁淋巴结切除术或者新辅助治疗。血SCC-Ag检测可以在一定程度上判断患者淋巴结转移情况。关于SCC-Ag预测淋巴结转移价值的研究相对较少,且存在较大争议,而且不同的研究所得出的临界值及预测价值也各不相同。因此有必要对我中心SCC-Ag预测可手术宫颈癌淋巴结转移的价值进行探讨。Lin等[9]指出淋巴结转移是影响血清SCC-Ag水平≥8 ng/ml的独立危险因素。而Li等[10]的研究得出治疗前SCC-Ag水平>3.5 ng/ml是淋巴结转移的独立危险因素(P < 0.001)。本研究中,淋巴结转移是影响血清SCC-Ag水平≥2.2 ng/ml的独立危险因素,但其受肿瘤直径的影响更大。陈军莹等[11]就众多学者对宫颈鳞癌患者中SCC-Ag诊断淋巴结转移价值的研究进行了Meta分析,结果显示SCC-Ag诊断宫颈癌淋巴结转移的合并敏感度为60%, 合并特异性为76%,SROC曲线下面积为0.712 6。其中SCC-Ag所取的分界值为1.5-8 ng/ml。我们的研究所取的分界值也在此范围之内,ROC曲线下面积为0.705(欠理想)。高宝荣等[6]认为SCC-Ag为4 ng/ml是筛选淋巴结转移的最佳界值。本研究中,SCC-Ag取临界值为5.4 ng/ml时预测淋巴结转移的效果最佳,灵敏度和特异度分别为65.4%、79.5%。van de Lande等[12]认为同一临界值在不同的临床分期对淋巴结转移的预测价值是不同的,当SCC-Ag≥1.65 ng/ml时,与ⅠB2+ⅡA期相比,它能够更准确地预测ⅠB1期患者的淋巴结转移情况。本研究结果也显示,当SCC-Ag≥2.2 ng/ml时,绘制所有ⅠB1-ⅡB期宫颈癌患者术前SCC-Ag水平预测淋巴结转移的ROC曲线,曲线下面积为0.705。而绘制肿瘤直径小的ⅠB1、ⅡA1期的ROC曲线,曲线下面积增加至0.728,诊断价值提高。ⅠB2、ⅡA2期绘制的ROC曲线显示曲线下面积仅为0.598。这说明肿瘤直径越小,肿瘤负荷越小,SCC-Ag水平才能更准确地预测淋巴结转移。这主要是因为多因素分析已经证明肿瘤直径对治疗前SCC-Ag水平影响最大,其次为脉管内癌栓。但是在临床工作中,我们发现由于病理医师技术水平的差异,可能存在部分脉管癌栓未被检出的患者,因此其与SCC-Ag水平的相关性可能存在较大的误差。由此我们认为在肿瘤直径更小的ⅠB1和ⅡA1期中,淋巴结转移是影响SCC-Ag水平升高最重要的危险因素。尽管SCC-Ag预测淋巴结转移的作用不够显著,但van de Lande等[12]发现SCC-Ag水平>1.1 ng/ml与预后差相关,SCC-Ag水平升高但淋巴结阴性的患者,其总生存率与淋巴结阳性患者接近(不考虑肿瘤标志物水平)。Li等[10]的研究也发现治疗前SCC-Ag水平 < 3.5 ng/ml较>3.5 ng/ml的患者能够获得更好的3年无瘤生存率和总生存率。这说明SCC-Ag水平升高但淋巴结阴性的患者可能存在隐性淋巴结转移,即临床病理不能检出的亚临床病灶。也有可能是由于手术技术原因导致有个别转移淋巴结未被清除。因此对于治疗前SCC-Ag水平升高的患者,我们更有理由怀疑他们可能存在淋巴结转移。本研究由于随访时间较短,故未做治疗前SCC-Ag水平与预后相关性的统计分析,计划后期继续完善。
就目前的研究结果来看,仅采用治疗前SCC-Ag水平预测淋巴结转移并不十分可靠。Patsner等[13]甚至认为SCC-Ag水平的升高与淋巴结转移之间并无相关性,这可能是当时检测技术不成熟导致的。我们认为SCC-Ag水平在预测淋巴结转移方面的价值还是十分肯定的,可以进一步扩大样本量,尽可能排除其它影响SCC-Ag水平的危险因素,分析分期相同且临床病理特征相同(除淋巴结转移外)的病例,从而有希望使治疗前血清SCC-Ag水平预测淋巴结转移的价值大大提高。本研究由于病例数量有限,故未做此分析。可以有效结合CT、MRI、PET-CT等影像学检查来提高诊断准确性。此外,还可以通过联合检测多种肿瘤标志物(如CEA、CA199、CA125等)来提高诊断预测价值。
综上所述,治疗前SCC-Ag水平与宫颈鳞癌多项临床病理危险因素,如肿瘤直径、有无脉管癌栓、淋巴结状态、肿瘤细胞分化程度密切相关。治疗前血SCC-Ag水平升高对预测盆腔淋巴结转移是有意义的,而且能够更准确地预测肿瘤直径更小的ⅠB1、ⅡA1期患者的淋巴结转移情况,即使术后病检提示淋巴结阴性也有可能是因为存在隐性淋巴结转移。
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90. DOI: 10.3322/caac.v61:2. |
| [2] |
胡尚英, 郑荣寿, 赵方辉, 等. 1989至2008年中国女性子宫颈癌发病和死亡趋势分析[J].
中国医学科学院学报, 2014, 36 (2): 119-125.
Hu SY, Zheng RS, Zhao FH, et al. Trend analysis of cervical cancer incidence and mortality rates in chinese women during 1989-2008[J]. Acta Academiae Medicinae Sinicae, 2014, 36(2): 119-125. |
| [3] | Metindir J, Bilir Dilek G. Evaluation of prognostic significance in extracapsular spread of pelvic lymph node metastasis in patients with cervical cancer[J]. Eur J Gynaecol Oncol, 2008, 29(5): 476-478. |
| [4] | Sun JR, Zhang YN, Sun XM, et al. Prediction model of pelvic lymph node metastasis in early stage cervical cancer and its clinical value[J]. Minerva Chir, 2011, 66(6): 537-545. |
| [5] | Jeong BK, Choi DH, Huh SJ, et al. The role of squamous cell carcinoma antigen as a prognostic and predictive factor in carcinoma of uterine cervix[J]. Radiat Oncol, 2011, 29(3): 191-198. DOI: 10.3857/roj.2011.29.3.191. |
| [6] |
高宝荣, 赵桂玲, 张虹. SCC-Ag对早期宫颈癌患者淋巴结转移评估的价值[J].
中国肿瘤临床, 2010, 37 (11): 630-633.
Gao BR, Zhao GL, Zhang H. Significance of preoperative serum squamous cell carcinoma antigen on lymphatic metastasis in early-stage cervical cancer[J]. Chinese Journal of Clinical Oncology, 2010, 37(11): 630-633. |
| [7] |
栾晓梅, 张瑶, 王诗卓, 等. 检测血清鳞状细胞癌抗原对宫颈鳞状细胞癌诊治及预后的临床意义[J].
中华医学杂志, 2012, 92 (19): 1330-1333.
Luan XM, Zhang Y, Wang SZ, et al. Clinical significance of serum squamous cell carcinoma antigen in the diagnosis, treatment and prognosis of cervical squamous cell carcinoma[J]. National Medical Journal of China, 2012, 92(19): 1330-1333. |
| [8] | Kim DY, Shim SH, Kim SO, et al. Preoperative nomogram for the identification of lymph node metastasis in early cervical cancer[J]. Br J Cancer, 2014, 110(1): 34-41. DOI: 10.1038/bjc.2013.718. |
| [9] | Lin H, ChangChien CC, Huang EY, et al. The role of pretreatment squamous cell carcinoma antigen in predicting nodal metastasis in early stage cervical cancer[J]. Acta Obstet Gynecol Scand, 2000, 79(2): 140-144. DOI: 10.1034/j.1600-0412.2000.079002140.x. |
| [10] | Li X, Zhou J, Huang K, et al. The predictive value of serum squamous cell carcinoma antigen in patients with cervical cancer who receive neoadjuvant chemotherapy followed by radical surgery: a single-institute study[J]. PLoS One, 2015, 10(4): 1-12. |
| [11] |
陈军莹, 姚德生, 伍志娟, 等. SCC-Ag在宫颈鳞癌病例中诊断淋巴结转移效能的Meta分析[J].
肿瘤防治研究, 2012, 39 (7): 811-817.
Chen JY, Yao DS, Wu ZJ, et al. Diagnostic value of serum squamous cell carcinoma antigen on lymphatic metastasis in cervical cancer: a meta analysis[J]. Cancer Research on Prevention and Treatment, 2012, 39(7): 811-817. |
| [12] | van de Lande J, Davelaar EM, von Mensdorff-Pouilly S, et al. SCC-Ag, lymph node metastases and sentinel node procedure in early stage squamous cell cervical cancer[J]. Gynecol Oncol, 2009, 112(1): 119-25. DOI: 10.1016/j.ygyno.2008.09.042. |
| [13] | Patsner B, Orr JW, Allmen T. Does preoperative serum squamous cell carcinoma antigen level predict occult extracervical disease in patients with stage Ib invasive squamous cell carcinoma of the cervix[J]. Obstet Gynecol, 1989, 74(5): 786-788. |
 2016, Vol. 37
2016, Vol. 37

