2. 武汉市中心医院肾内科, 湖北 武汉 430014;
3. 分子诊断湖北省重点实验室 湖北 武汉 430014
2. Dept. of Nephrology, Wuhan Central Hospital, Wuhan 430014 ,China;
3. Key Laboratory for Molecular Diagnosis of Hubei Province,Wuhan Central Hospital, Wuhan 430014 ,China
慢性肾脏病矿物质和骨代谢紊乱[1](chronic kidney disease-mineral and bone disorder,CKD-MBD)广泛存在于血液透析患者中,血管的钙化影响了患者血透通路的使用周期,进而影响了生存周期,血液透析患者体内可以检测到内源性的哇巴因(Ouabain)浓度上升,哇巴因具有诱导多种细胞纤维化的功能 [2, 3],哇巴因在血管钙化中是否具有一定功能,目前尚不清楚;蒲黄有抗动脉粥样硬化和保护内皮细胞的作用,有研究报告提示蒲黄可以降低血脂,改善血液流变学,改善微循环,改善内皮损伤,兴奋子宫,抑制免疫应答。因此我们设计此研究在于 阐明哇巴因及蒲黄在血管平滑肌细胞(human vascular smooth muscle cell,VSMC)钙化形成机制中的作用,从而为改善血透患者血管壁的钙化寻找新的契机。
1 资料与方法 1.1 研究对象采用人血管平滑肌细胞(hVSMC)为研究所需的细胞系,购自美国ATCC细胞库。购买SPF级雄性C57小鼠(42000600),饲养于华中科技大学实验动物中心,用于含蒲黄的药学血清的制备,定期给予生蒲黄煎剂灌胃,1周后,处死小鼠,获取含有蒲黄的小鼠血清,作为治疗组用药。
1.2 方法 1.2.1 细胞培养及分组体外培养hVSMC细胞,给予不同浓度的哇巴因(0,1,10,100,1,10 μmol/L)刺激同时观察不同时间后细胞生长凋亡情况,并采用MTT法检测细胞存活能力;选取适合的哇巴因浓度和时间点,加入含有蒲黄药物血清进行干预(蒲黄组提前加入细胞1 h),根据以下处理因素分组:正常培养基、正常培养基+哇巴因、正常培养基+哇巴因+蒲黄;采用Von Kossa法检测在此条件下各组细胞中钙沉积含量;采用免疫印记发检测钠钾ATP酶(NKA)α1的蛋白表达,骨桥蛋白(Osteopontin,OPN)的蛋白表达。
1.2.2 药物血清制备选取8只C57小鼠(19-21 g;36-45日龄),连续给予生蒲黄煎剂(2 g蒲黄溶于100 ml蒸馏水中熬制,浓缩终体积至20 ml,得到终浓度为0.1 g/ml的蒲黄煎剂待用,灌胃时根据每只小鼠的体重调整灌胃中药的剂量,灌胃的剂量为1 g/kg,此浓度来源于Wang研究小组[4];1周后处死小鼠,每只小鼠获得0.8-1 ml全血,离心后获得0.4-0.5 ml血清,主要用于后续的细胞试验中。血清药理学实验方法是将复杂的成分经过消化道吸收分布、代谢排除等体内过程,再取含药的血清进行药理实验,比较接近药物体内环境中产生药理作用的真实过程,适用于中药的作用机制的研究。
1.2.3 MTT法检测细胞存活能力体外培养人VSMC细胞,将细胞重悬成单个细胞悬液并计数,接种到3个96孔板,次日加入不同浓度的哇巴因(0,1,10,100,1,10 μmol/L),分别培养24,48,72 h,培养终止前4 h每孔加入20 μl 5 mg/ml的MTT,吸去孔内培养液后,再加入150 μl DMSO酶标仪490 nm检测OD值。
1.2.4 钙离子检测购买Von Kossa检测试剂盒检测不同分组的VSMC细胞中钙离子的沉积,试验流程同既往报道。
1.2.5 Western Blot法检测各蛋白的表达制备10%SDS-PAGE胶,20 μg/孔上样,电泳2 h后转膜,5%脱脂牛奶封闭1 h。抗NKAα1抗体1∶5 000,抗OPN抗体1∶1 000,4 ℃孵育过夜;HRP标记的二抗 1∶2 000,室温孵育1 h。EML发光试剂盒显影。应用GAPDH作为内参照。Image-J图像软件分析蛋白条带的强度值(ED)。各样品(NKA、OPN)与GAPDH的ED比值为NKA和OPN蛋白表达的相对丰度值。
1.2.6 统计学方法应用SPSS 13.0统计软件,符合正态分布的计量资料用均数±标准差表示,两组间比较用两样本t检验,多组间两两比较用方差分析(one-way ANOVA)中的SNK检验。以P<0.05为差异有统计学意义。
2 结果 2.1 hVSMC细胞的生长凋亡情况不同浓度哇巴因刺激hVSMC,倒置显微镜下观察各组细胞的生长凋亡情况,发现浓度为0,1,10 nmol/L组细胞到第7天时几乎没有凋亡细胞,浓度为100 mol/L组、1 μmol/L组细胞在第7天内细胞几乎全部凋亡,因此能够让hVSMC细胞在7 d内细胞不完全凋亡的最大筛选浓度为10 nmol/L。通过MTT法检测得到结果和上述相符(见图 1)。
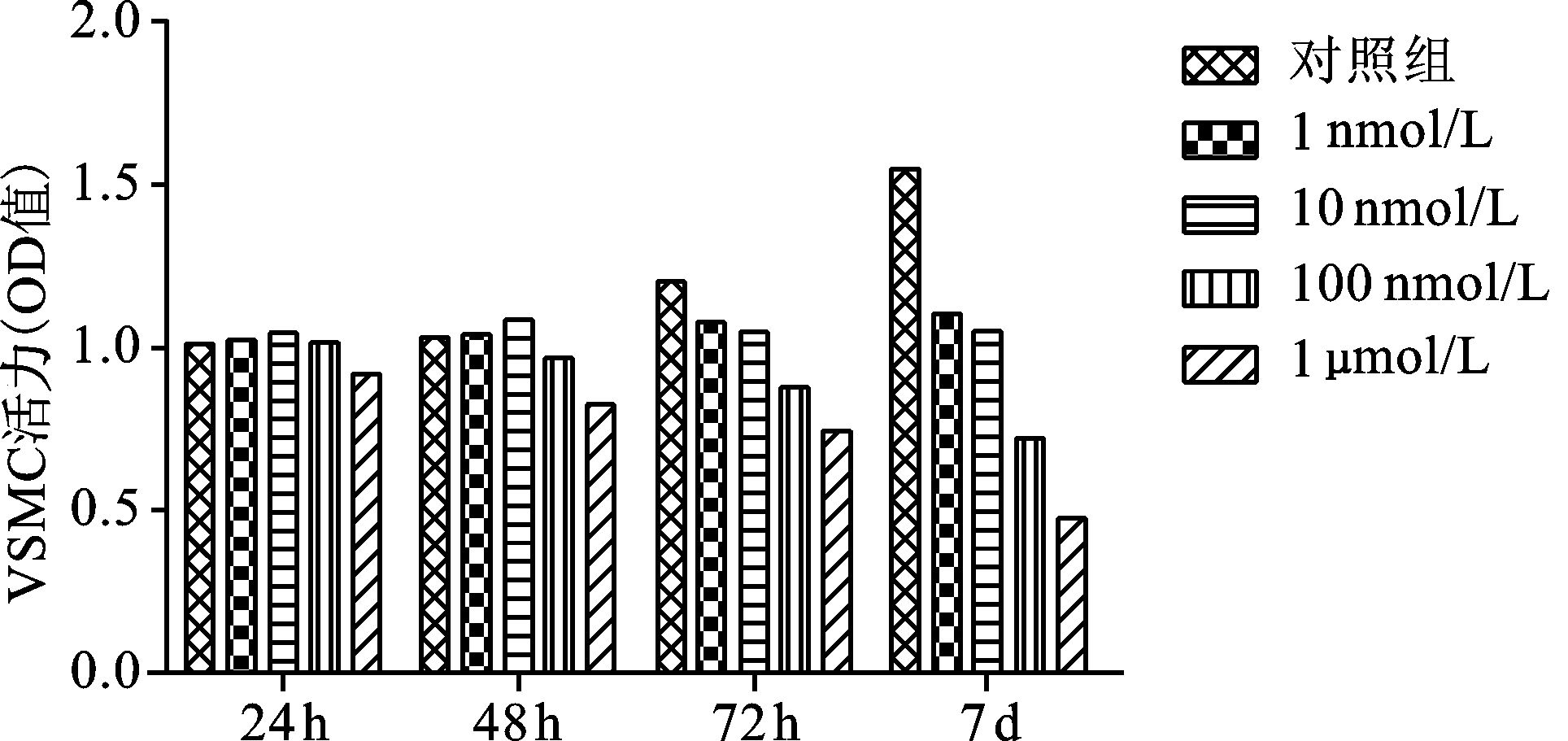
|
图 1 哇巴因不同浓度对VSMC细胞生长状况的影响 |
将正常条件下培养的hVSMC细胞作为空白对照组,哇巴因10 nmol/L组为实验组,对各组hVSMC细胞培养7 d,倒置相差显微镜下观察各组细胞生长情况及钙化情况,结果发现到第7天时,哇巴因组可见大量的钙沉积,而空白对照组未见钙沉积,对第7天各组细胞进行Von Kossa染色,发现哇巴因组较培养皿中可见大量黑色结节存在,阳性细胞(黑色结节存在的细胞)百分比明显上调,且有统计学差异(哇巴因组vs正常组,2.4±0.8 vs 0.0±0.6),如图 2所示。
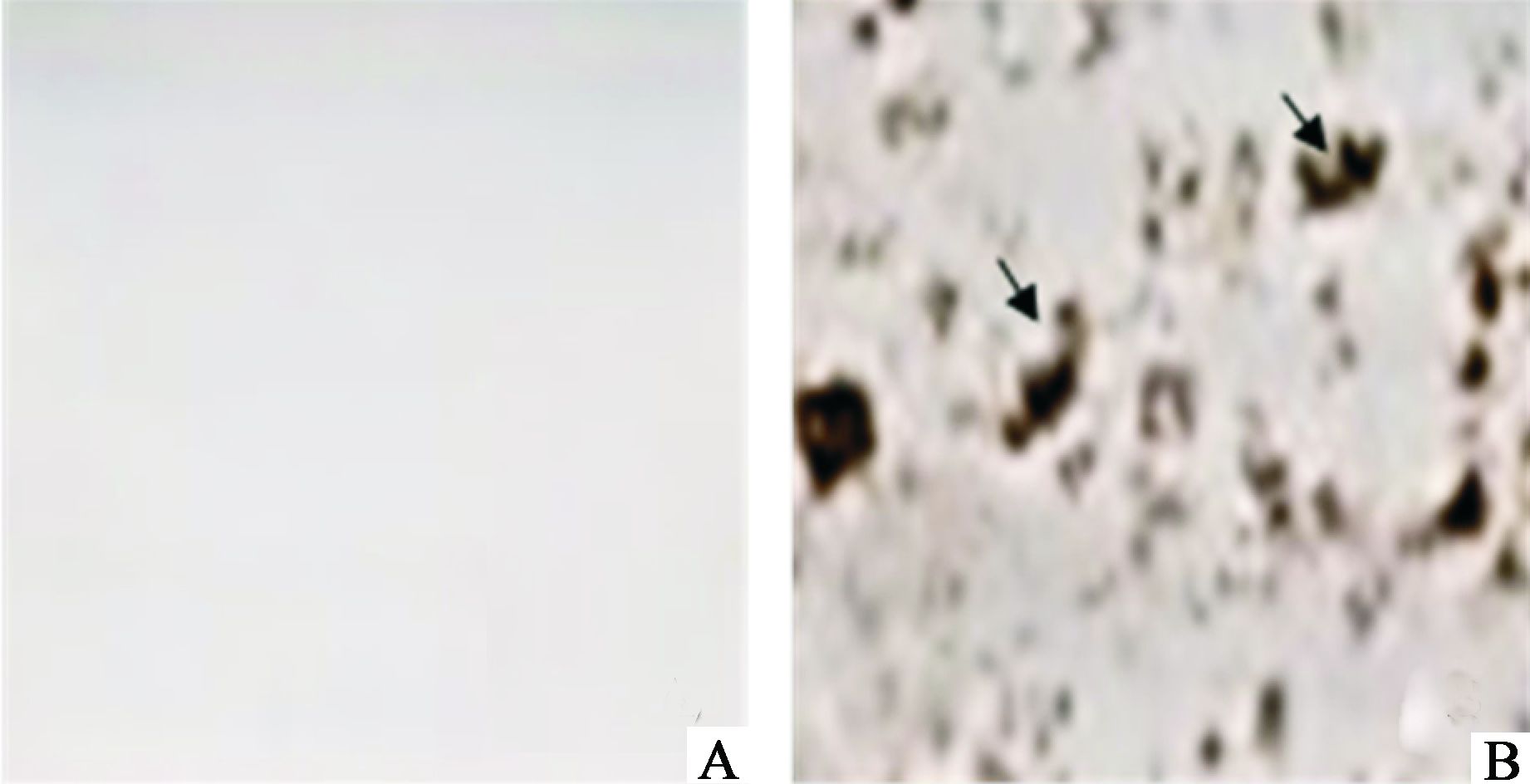
|
图 2 哇巴因可诱导VSMC细胞钙化(Von Kossa法) A.正常对照组B.哇巴因刺激细胞7 d后可观察到Von Kossa染色的阳性细胞数明显增多。箭头所示为阳性细胞。 |
不同浓 度哇巴因可诱导VSMC中NKAα1的表达先上调再下降,同时我们也观察到OPN表达先上调再下降,哇巴因刺激细胞24 h后,可观察到NKAα1、OPN (如图 3)表达峰值(NKAα1:对照组vs哇巴因10 nmol/L组,1.0±0.0 vs 2.5±0.2;OPN:对照组vs哇巴因10 nmol/L组,1.0±0.0 vs 2.9±0.3)。
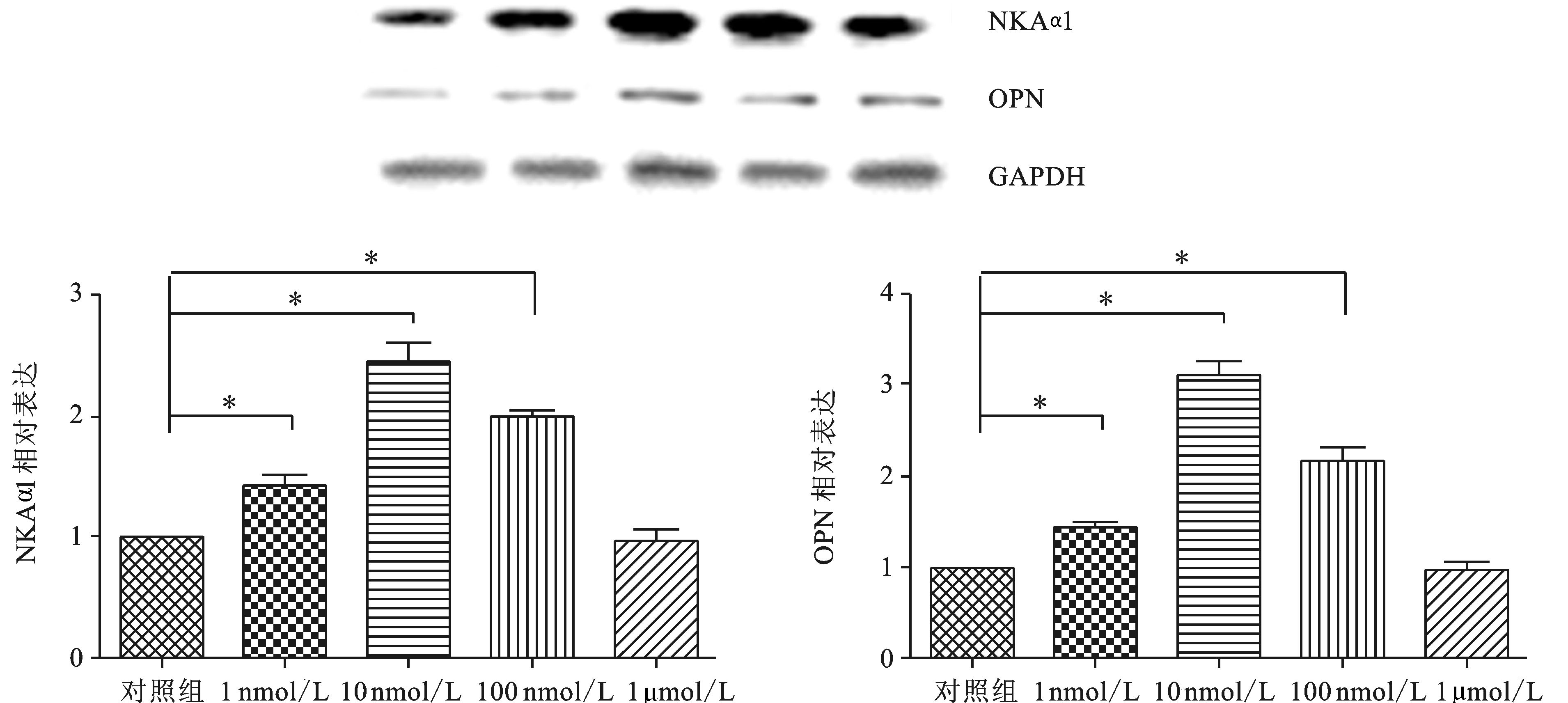
|
图 3 NKAα1参与哇巴因诱导VSMC钙化(Western Blot) A. 哇巴因刺激细胞24 h后,可观察到NKAα1表达上调;B. 哇巴因刺激细胞24 h后,可观察到OPN表达上调;哇巴因组分别与正常对照组比较,*P<0.05 |
给予蒲黄干预哇巴因刺激组细胞7 d后哇巴因所诱导的VSMC钙化程度减弱,如图 4所示,黑色结节显著下调,阳性细胞百分比明显下降(阳性细胞百分比:蒲黄组vs哇巴因10 nmol/L组:2.4±0.8 vs 1.5±0.3);蒲黄72 h干预后能下调VSMC中NKAα1及OPN的表达,如图 5(蒲黄组vs哇巴因10 nmol/L:NKAα1:2.3±0.2 vs 1.6±0.2;OPN:3.0±0.3 vs 1.7±0.2)。
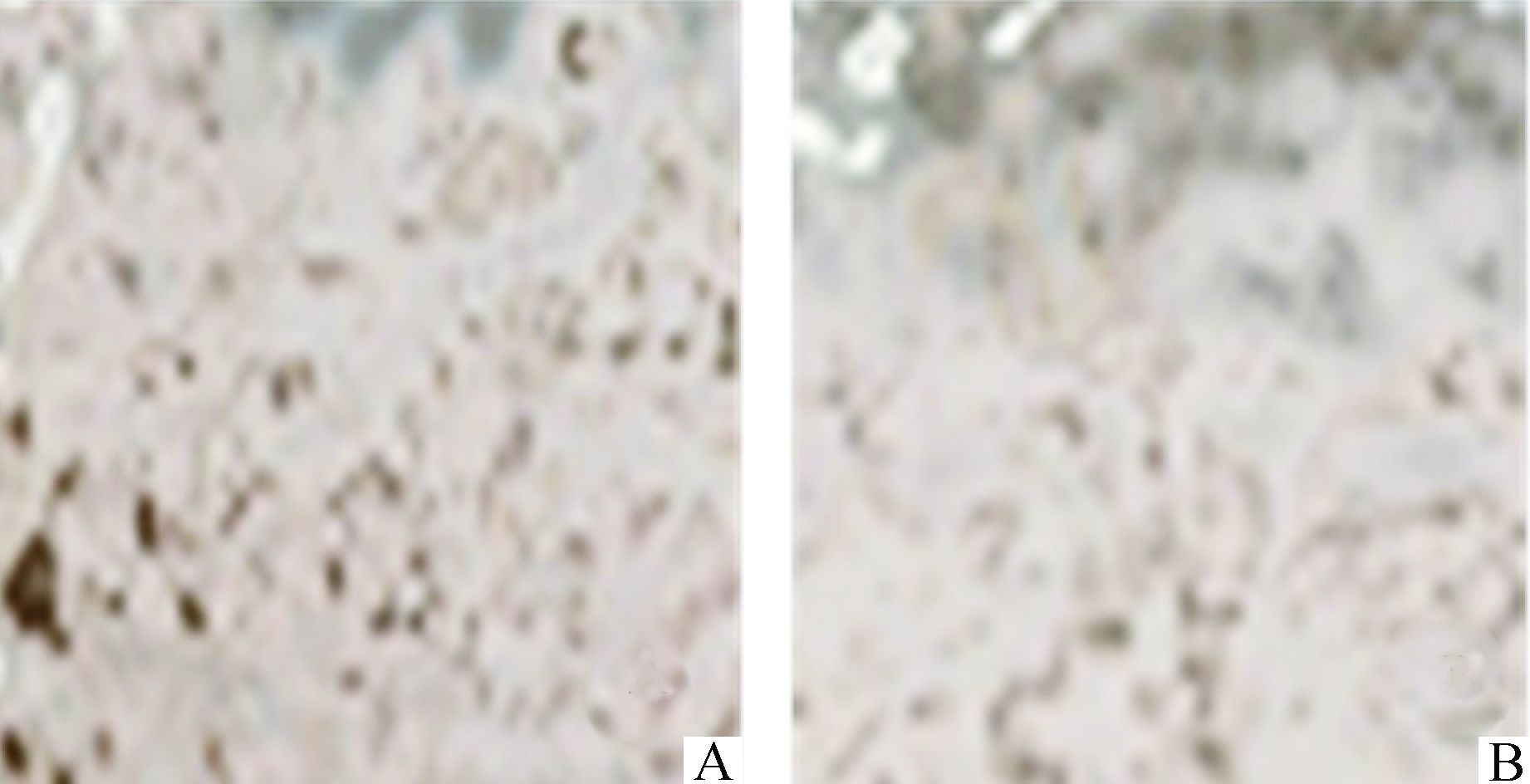
|
图 4 蒲黄阻断VSMC钙化(Von Kossa法) A.哇巴因10 nmol/L组体外刺激VSMC细胞7 d后行Von Kossa染色;B.哇巴因10 nmol/L+蒲黄体外培养7 d后Von Kossa染色 |
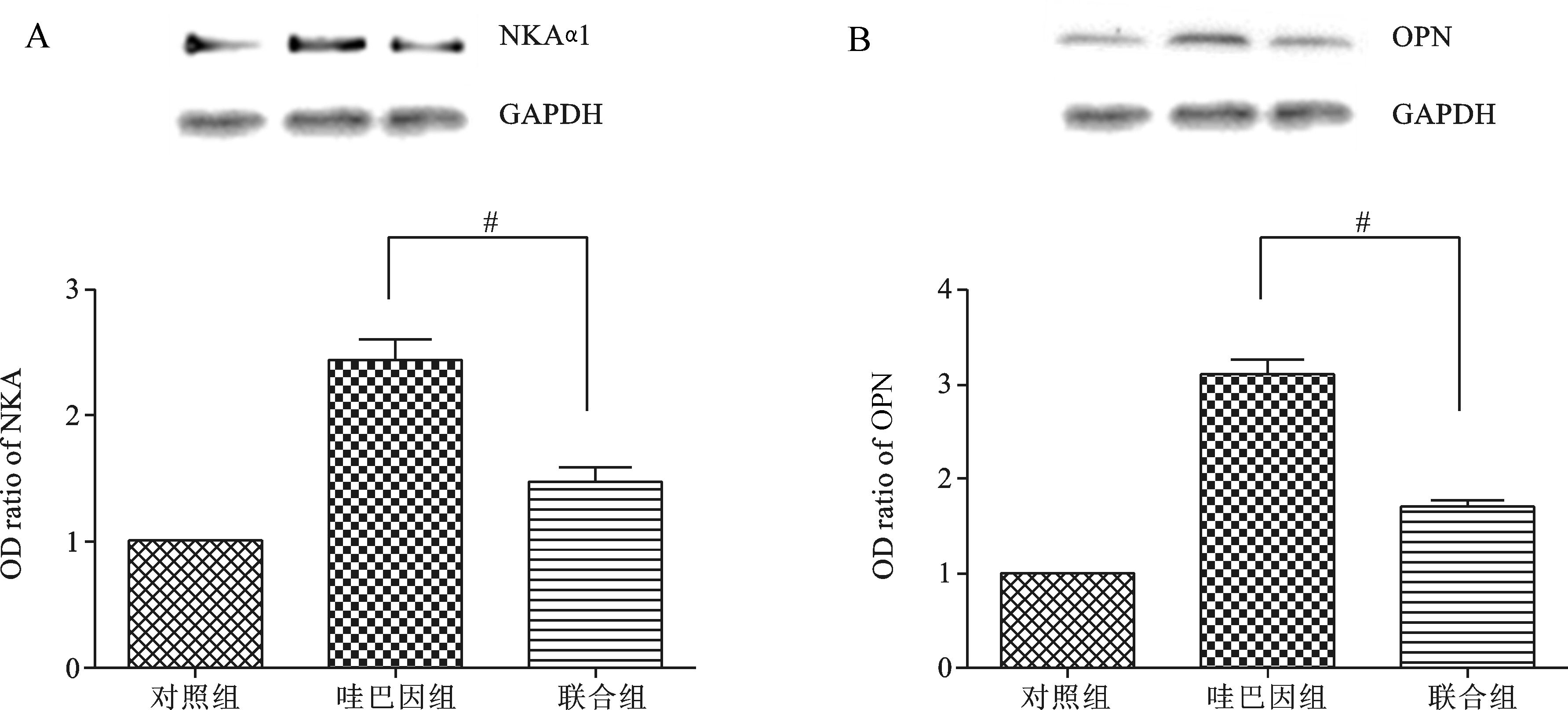
|
图 5 蒲黄抑制NKAα1活化阻断VSMC钙化发生(Western Blot) A. 蒲黄干预哇巴因刺激的细胞72 h后,可观察到NKAα1表达下调;B. 蒲黄干预哇巴因刺激的细胞72 h后,可观察到OPN表达下调;#P<0.05 |
1957年Skou[5]证实钠泵不仅是存在于细胞质膜上的载体蛋白,也是一种P2型ATP酶,它通过水解ATP,释放ADP,磷酸化自身改变蛋白构型。NKA通常由α、β两种亚基组成,它们以1∶1的比例形成二聚体发挥功能。其中α亚基有三种亚型,分别是α1、α2、α3,β亚基为跨膜一次的高度糖基化蛋白,包含有β1、β2、β3三种亚型,此外,在有些组织中还能检测到γ亚基的存在,它的作用是通过和亚基羧基末端的相互作用,调节NKA与ATP、钠钾离子的亲和力。α1亚基在各种组织中均存在,尤以肾脏中最多。强心甾类(CTS)物质又称洋地黄类物 质,包括植物来源的地高辛(digoxin)、哇巴因(ouabain)和动物来源的布法林(bufalin)、海蟾蜍毒(marinobufagenin,MBG)等,它们均是源于自然界的外源性NKA抑制剂[6]。我们的前期研究已经证实MBG在尿毒症心肌病变中表达上调,NKA的量决定细胞存活和凋亡的方向[7]。Fedorova等发现,MBG能诱导猪肾小管上皮细胞发生EMT[8]。另有报道显示,在部分肾切除所模拟的慢性肾衰竭模型中,可以检测到外周血中MBG的浓度升高,并出现类似于尿毒症性心肌病的病理表现,并可见心室舒张功能的异常和左室肥厚。然而改变胞浆内钠离子的浓度,并不能引起CTS合成增加[9],说明钠泵本身具有信号转导功能[10]。但是关于内源性的洋地黄物质在血管内皮细胞和平滑肌细胞上的研究目前尚不清。基于以上的研究基础,我们设计了此课题,在我们的实验结果中哇巴因可以诱导人血管平滑肌细胞的钙化形成,不同浓度的哇巴因刺激VSMC 7 d后可观察到钙结晶的形成,免疫印记法可以检测到骨桥蛋白的表达增加,同时我们也检测到了NKAα1的表达增加,基于慢性肾脏病患者即血液透析患者体内可以检测到内源性的哇巴因含量上升,我们的研究则证实了哇巴因可以诱导这些患者血管壁的钙化,可能是这类患者血管硬化的原因之一。
蒲黄,始载于《神农本草经》,又名蒲花、水烛花粉。蒲黄为临 床常用中药,具有活血化瘀、止血、止痛,通淋的功效。另外蒲黄还具有抗炎、促凝血、镇痛、增强心肌收缩力、抗动脉粥样硬化、降血脂等功能;我们通过制备含有蒲黄的动物血清干预哇巴因诱导的血管平滑肌细胞的钙化,意图证明蒲黄可能对慢性肾脏病患者,尤其是血液透析患者的血管钙化有抑制功能,我们在实验结果中观察到了蒲黄加入到哇巴因刺激组后,人血管平滑肌细胞的钙化程度得到了显著抑制,VSMC细胞经过蒲黄干预后7 d可观察到钙结晶显著减少,免疫印记法可以检测到骨桥蛋白的表达较哇巴因组降低,同时我们也检测到了NKAα1的表达减少,因此,我们的实验证实了蒲黄对哇巴因诱导的人血管平滑肌的钙化具有显著抑制作用。
我们的实验研究仅在体外实验中进行了部分机制探讨,并未涉及体内部分,因此我们还不能证实在有血管钙化风险的患者中,口服蒲黄煎剂能够达到延缓甚至逆转血管钙化的作用,不过这也是我们接下来需要深入研究的部分,然而,毋庸置疑的是我们为延缓此类患者的血管钙化寻找到了一种新型的药物干预的可能。
| [1] | Sprague SM, Bellorin-Font E, Jorgetti V, et al. Diagnostic accuracy of bone turnover markers and bone histology in patients with CKD treated by dialysis[J]. Am J Kidney Dis, 2016, 67(4): 559-566. DOI: 10.1053/j.ajkd.2015.06.023. |
| [2] | Yan Y, Haller S, Shapiro A, et al. Ouabain-stimulated trafficking regulation of the Na/K-ATPase and NHE3 in renal proximal tubule cells[J]. Mol Cell Biochem, 2012, 367(1-2): 175-183. DOI: 10.1007/s11010-012-1331-x. |
| [3] | Holthouser KA, Mandal A, Merchant ML, et al. Ouabain stimulates Na-K-ATPase through a sodium/hydrogen exchanger-1 (NHE-1)-dependent mechanism in human kidney proximal tubule cells[J]. Am J Physiol Renal Physiol, 2010, 299(1): F77-F90. DOI: 10.1152/ajprenal.00581.2009. |
| [4] | Wang W, Guo Z, Xu Z, et al. Effect of pollen typhae on inhibiting autophagy in spinal cord injury of rats and its mechanisms[J]. Int J Clin Exp Pathol, 2015, 8(3): 2375-2383. |
| [5] | Skou JC. The influence of some cations on an adenosine triphosphatase from peripheral nerves[J]. J Am Soc Nephrol, 1998, 9(11): 2170-2177. |
| [6] | Stanton DT, Ankenbauer J, Rothgeb D, et al. Identification and characterization of novel sodium/potassium-ATPase inhibitors by virtual screening of a compound database[J]. Bioorg Med Chem, 2007, 15(18): 6062-6070. DOI: 10.1016/j.bmc.2007.06.050. |
| [7] | Liu C, Bai Y, Chen Y, et al. Reduction of Na/K-ATPase potentiates marinobufagenin-induced cardiac dysfunction and myocyte apoptosis[J]. J Biol Chem, 2012, 287(20): 16390-16398. DOI: 10.1074/jbc.M111.304451. |
| [8] | Fedorova LV, Raju V, El-Okdi N, et al. The cardiotonic steroid hormone marinobufagenin induces renal fibrosis: implication of epithelial-to-mesenchymal transition[J]. Am J Physiol Renal Physiol, 2009, 296(4): F922-F934. DOI: 10.1152/ajprenal.90605.2008. |
| [9] | Haas M, Wang H, Tian J, et al. Src-mediated inter-receptor cross-talk between the Na+/K+-ATPase and the epidermal growth factor receptor relays the signal from ouabain to mitogen-activated protein kinases[J]. J Biol Chem, 2002, 277(21): 18694-18702. DOI: 10.1074/jbc.M111357200. |
| [10] | Tidow H, Aperia A, Nissen P. How are ion pumps and agrin signaling integrated[J]. Trends Biochem Sci, 2010, 35(12): 653-659. DOI: 10.1016/j.tibs.2010.05.004. |
 2017, Vol. 38
2017, Vol. 38

 ,
,