2. 湖南省急救医学研究所 急危重症代谢组学湖南省重点实验室;
3. 湖南省人民医院(湖南师范大学附属第一医院)急诊科
2. Hunan Provincial Institute of Emergency Medicine, Hunan Provincial Key Laboratory of Emergency and Critical Care Metabonomics, Changsha, China;
3. Emergency Department, Hunan Provincial People's Hospital(The first-affiliated hospital of Hunan normal university), Changsha, China
目前在全球暴发的新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)是由国际病毒分类委员会命名为严重急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)的新型冠状病毒所引起,该病毒是已知的冠状病毒家族中第7个能够感染人类的成员[1, 2]。SARS-CoV-2是主要通过呼吸道飞沫和接触传播,具有极强的传染性及致病力[3]。SARS-CoV-2感染的临床范围很广,包括无症状感染,轻度呼吸系统疾病和严重的肺炎,并伴有急性呼吸衰竭甚至死亡。感染性指标能有效协助临床判断疾病,应用最为广泛。每个指标均具有各自的临床及实验室特性,不同分层特征的COVID-19感染患者之间存有差异,利用现有临床检验资料对患者感染性指标进行分层分类,有利于更好的认知COVID-19及其防治。感染性指标在临床上应用最为广泛,每个指标均具有各自的临床及实验室特性,它们之间存在一定的相关性,本研究分析239例COVID-19患者的临床数据,研究常用感染性指标(白细胞计数、C反应蛋白、血沉)在COVID-19患者分层中的价值,以加深对该疾病的认识,为该疾病识别及诊治提供参考。
资料和方法 一、病例资料选取2020年1月至2020年3月期间入住长沙市公共卫生中心,经核酸检测为阳性的新冠肺炎患者239例,其中男118例,女121,年龄45.53±16.77岁。
二、方法收集所有患者入院时的一般情况、流行病学资料,基础疾病情况,症状体征。实验室检查包括血常规、C反应蛋白和血沉,患者的诊断标准、临床分型、诊疗规范及出院标准均参考国家卫生健康委员会制定的新型冠状病毒感染的肺炎诊疗方案(试行第5版)。根据其入院时的情况进行患者分层,按照流行病学分层后分为4组,湖北疫区居住者或返程者组、与湖北疫区者有接触史组、与长沙本地确诊者有接触史组和无明确流行病学接触史组;按照有无家族聚集情况分层后分为2组,有家族聚集情况组和无家族聚集情况组;按照有无基础疾病分层后分为2组,有基础疾病组和无基础疾病组;按临床严重程度分层后分为2组,将轻型、普通型纳入轻症组,重型及危重型纳入重症组;按照患者住院天数分层后分为4组,1周组、1-3周组,3周以上组;按照轻症患者在治疗过程中疾病变化分层后分为2组,病情好转组和病情加重组。
三、统计学方法使用SPSS 22.0软件进行统计分析,GraphPad Prism 5.0进行图形绘制。计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验;计数资料以频数/百分比表示,组间比较采用χ2检验、或Fisher确切概率法。
结果 一、新冠肺炎感染患者一般情况统计239例患者新冠病毒核酸检测均阳性,其中男118例(49.4%),女121(50.6%),平均年龄45.53±16.77岁。其中111例(46.4%)为湖北疫区居住者或返程者,30例(12.6%)与湖北疫区者有接触史,75例(31.4%)与长沙本地确诊者有接触史,23例(9.6%)无明确流行病学接触史。有家族聚集情况者145例(60.7%),无家族聚集情况者94例(39.3%)。从发病到确诊入院时间为6.1±4.8d。最常见的临床症状有发热161例(67.4%)、咳嗽139例(58.2%)、乏力81例(33.9%),其他症状还包括气促30例(12.6%)、咽痛27例(11.3%)、肌肉酸痛23例(9.6%)等。有基础疾病者167例(69.9%),有基础疾病者72例(30.1%),主要为高血压32例(13.4%)、糖尿病16例(6.7%)。入院时病情为轻症患者201例(84.1%),重症患者38例(15.9%),平均住院18.1±8.9d。
二、新冠肺炎感染患者入院时常用感染性指标情况239例新冠肺炎感染患者入院时WBC4.83±1.86×109/L、Neu%63.88±11.62%、Lymph%27.59±10.77%、CRP22.89±22.72ng/mL、ESR41.13±28.24ng/mL,见表 1。
| 表 1 新冠肺炎感染患者入院时常用感染性指标情况 |
相对于无明确流行病学接触史组患者,湖北疫区居住者或返程者组、与湖北疫区者有接触史组、与长沙本地确诊者有接触史组三组患者Neu%降低(P < 0.05),Lymph%升高(P < 0.05);湖北疫区居住者或返程者组、与长沙本地确诊者有接触史组两组患者CRP降低(P < 0.05),见图 1。
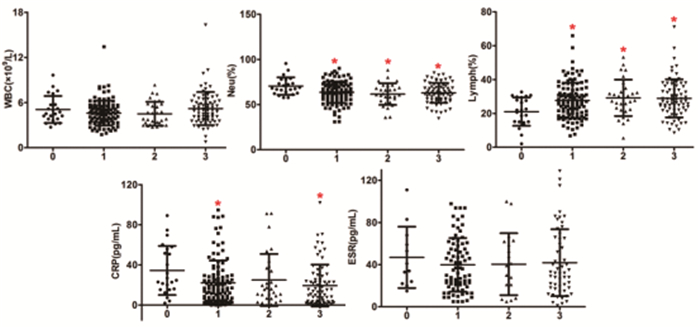
|
图 1 不同流行病学分层的新冠肺炎感染患者常用感染性指标情况(注:0:无明确流行病学接触史组;1:湖北疫区居住者或返程者组;2:与湖北疫区者有接触史组;3:与长沙本地确诊者有接触史组) |
有无家族聚集情况分层后两组常用感染性指标无明显差异(P>0.05),见图 2。
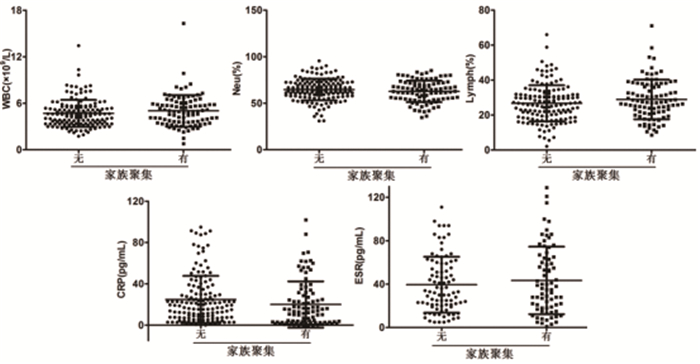
|
图 2 有无家族聚集情况分层的新冠肺炎感染患者常用感染性指标情况 |
按照有无基础疾病分层后,相比于无基础疾病组,有基础疾病组患者Neu%升高(P < 0.05),Lymph%降低(P < 0.05)、CRP升高(P < 0.05),见图 3。
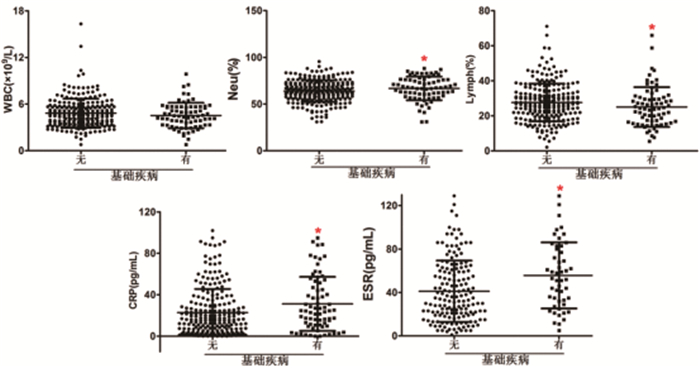
|
图 3 有无基础疾病分层的新冠肺炎感染患者常用感染性指标情况 |
按照有临床严重程度分层后,相比轻症组,重症组患者Neu%升高(P < 0.05),Lymph%降低(P < 0.05)、CRP和ESR升高(P < 0.05),见图 4。
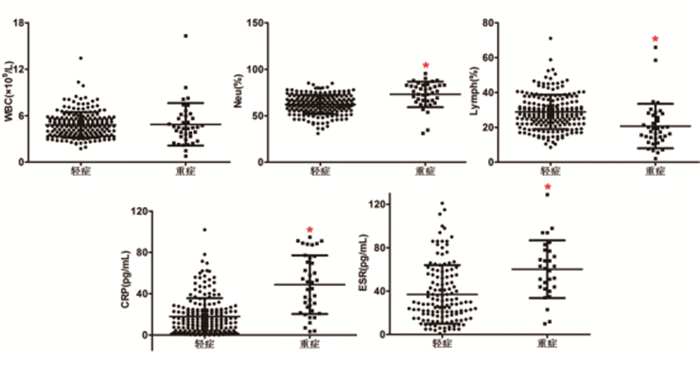
|
图 4 临床严重程度分层的新冠肺炎感染患者常用感染性指标情况 |
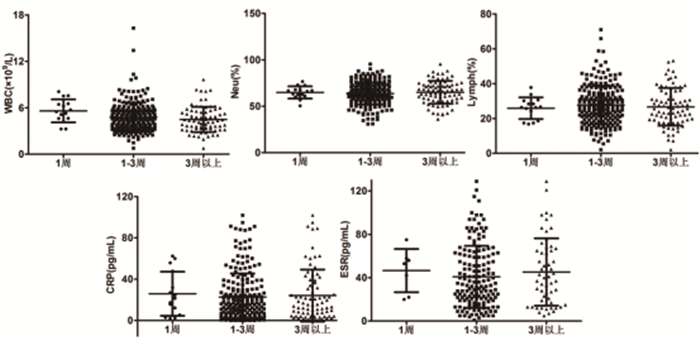
按照住院天数分层后各组常用感染性指标无明显差异(P>0.05),见图 5。
|
图 5 住院天数分层的新冠肺炎感染患者常用感染性指标情况 |
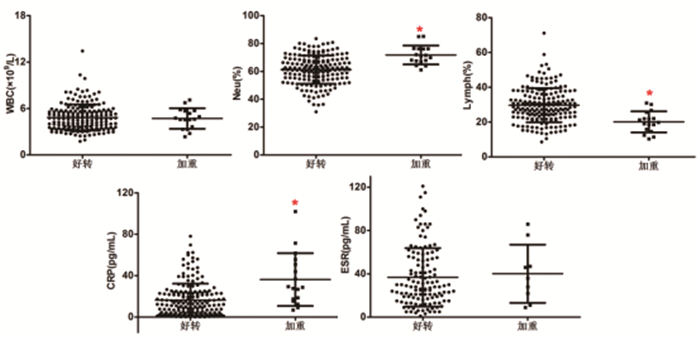
按照轻症患者在治疗过程中疾病变化分层后,相比于好转组,加重组患者Neu%升高(P < 0.05),Lymph%降低(P < 0.05)、CRP升高(P < 0.05),见图 6。
|
图 6 病情变化分层的新冠肺炎感染轻症患者常用感染性指标情况 |
近年来临床上提出了将WBC计数、Neu%、Lymph%、CRP及ESR水平作为诊断感染性疾病重要的炎症指标。CRP是一种急性感染性蛋白,患者出现感染情况后,体内的CRP数量会出明显升高[4]。而WBC则是一种免疫细胞,主要包括淋巴细胞与粒细胞,可以对患者体内的病菌起到抑制和消灭作用[5]。临床中通过快捷、简单、准确的方法对患者血液感染疾病进行诊断,是为治疗提供可靠依据的基础。本研究结果显示,通过不同的分层,COVID-19患者的Lymph%降低,Neu%和CRP升高。同时,本研究发现COVID-19患者的感染性指标在合并基础疾病的患者,重型患者和轻症患者病情加重中,指标变化较大,在病程中应注意合并细菌感染的可能。
本研究中患者多数来自武汉,或有报告确诊病例地区旅行史。大部分伴随有基础疾病者,主要为高血压与糖尿病。有研究发现具有基础疾患的老年人或免疫力低下人群,易感性较强,且合并高血压和糖尿病患者更易进展为危重症,与本研究相符[6, 7]。临床表现以呼吸系统症状为主,未见消化、神经系统等其他系统表现,主要症状为发热,其次为咳嗽与乏力,程度均较轻。根据入院时病情判断,大部分为轻症患者。说明大多数无合并(如高血压、糖尿病、肝、肾等)基础疾病的患者,多表现为轻型或普通型,而合并基础疾病更易出现重型病例[8]。
在临床诊疗过程中,对疑似病例首先进行血细胞计数分析。发病早期WBC计数正常或降低、淋巴细胞减少是目前作为临床诊断COVID-19或疑似COVID-19的重要依据之一。本研究发现治疗前大多数患者WBC、Lymph%降低,与之前研究结果一致[9],表明病毒颗粒通过呼吸道黏膜传播并感染其他细胞,在体内诱发细胞因子风暴,产生一系列免疫反应,并引起外周WBC和免疫细胞(如淋巴细胞)的变化,淋巴细胞总数的大幅减少表明SARS-CoV-2消耗了许多免疫细胞并抑制了人体的细胞免疫功能[10]。
血小板-单核细胞聚集(PMA)的形成是体内血小板活化的敏感标志[11, 12]。Matthew等人证明,PMA的形成可预测老年败血症患者的死亡率[13]。在我们的研究中,数据显示患有淋巴细胞减少症的COVID-19患者伴有血小板计数的减少。因此,我们推测PMA可能是COVID-19患者病程恶化的重要原因。
总之,本研究通过不同分层表明,Lymph%、Neu%与CRP可作为伴有基础疾病的重症患者的重要指标,为临床诊断和治疗提供的参考价值。
| [1] |
Zhu N, Zhang DY, Wang WL, et al. A novel coronavirus from patients with pneumonia in China, 2019[J]. N Engl J Med, 2020, 382(8): 727-733. |
| [2] |
Ma YL. Research progress on the charecteristics of coronavirus and its pathogenesis to human[J]. Chin J Clin Infect Dis, 2018, 6(11): 305-315. |
| [3] |
Wang D, Hu B, Hu C, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China[J]. JAMA, 2020, 323(11): 1061-1069. |
| [4] |
李睿, 任然, 熊大迁. 多种检测指标对血液恶性肿瘤合并深部真菌感染患者的诊断价值[J]. 实用检验医师杂志, 2017, 9(2): 73-76. |
| [5] |
Zhou P, Yang XL, Wang XG, et al. A Pneumonia Outbreak Associated with A New Coronavirus of Probable Bat Origin[J]. Nature, 2020, 579: 270-273. |
| [6] |
Xu XW, Wu XX, Jiang XG, et al. Clinical findings in a group of patients infected with the 2019 novel coronavirus (SARS-Cov-2) outside of Wuhan, China:retrospective case series[J]. BMJ, 2020, 368: m606. |
| [7] |
中华预防医学会新型冠状病毒肺炎防控专家组. 新型冠状病毒肺炎流行病学特征的最新认识[J]. 中国病毒病杂志, 2020, 2(10): 86-92. |
| [8] |
Zhu N, Zhang DY, Wang WL, et al. A novel coronavirus from patients with pneumonia in China, 2019[J]. The New England Journal of Medicine, 2020, 382(8): 727-733. |
| [9] |
Xu Z, Shi L, Wang Y, et al. Pathological findings of COVID-19 assciated with acute respiratory distress syndrome[J].Lancet Respir Med, 2020, doi: 10.1016/S2213-2600(20)30076-X, (Epub ahead of print).
|
| [10] |
Wang F, Nie JY, Wang HZ, et al. Characteristics of Peripheral Lymphocyte Subset Alteration in COVID-19 Pneumonia[J]. J Infect Dis, 2020, 221(11): 1762-1769. |
| [11] |
Michelson AD, Barnard MR, Krueger LA, et al. Circulating monocyte-platelet aggregates are a more sensitive marker of in vivo platelet activation than platelet surface P-selectin:studies in baboons, human coronary intervention, and human acute myocardial infarction[J]. Circulation, 2001, 104(13): 1533-1537. |
| [12] |
Rondina MT, Grissom CK, Men S, et al. Whole blood flow cytometry measurements of in vivo platelet activation in critically-Ⅲ patients are influenced by variability in blood sampling techniques[J]. Thromb Res, 2012, 129(6): 729-735. |
| [13] |
Matthew TR, McKenzie C, Tamra F, et al. Platelet-Monocyte Aggregate Formation and Mortality Risk in Older Patients With Severe Sepsis and Septic Shock[J]. J Gerontol A Biol Sci Med Sci, 2015, 70(2): 225-231. |
 2020, Vol. 4
2020, Vol. 4

