急性主动脉夹层(acute aortic dissection, AAD)是一种常见的心血管急危重症,与壁间血肿(intramural haematoma, IMH)、穿透性溃疡(penetrating atherosclerotic ulcer, PAU)、主动脉瘤破裂(rupture of aortic aneurysm, RAA)和外伤性主动脉离断(traumatic aortic injury, TAI)共同组成了急性主动脉综合征(acute aortic syndromes, AAS),其中以AAD最为常见。AAD具有临床表现多样、发病凶险、病死率高的特点,但在最终确诊AAD的病人当中,一开始便怀疑AAD的病人占不到一半[1, 2]。早期怀疑并采取恰当、有效的筛查手段是急诊诊治AAD的关键环节。主动脉CT血管造影(computed tomography angiography, CTA)是AAD的确诊检查,但因其价格昂贵、有放射性及造影剂副作用等原因,不适合大规模用于病人的初筛。近年来,D-二聚体作为体内交联纤维蛋白水解的标志性产物,其在AAD早期诊断中的高度敏感性及阴性预测能力得到普遍认可,参照肺栓塞(pulmonary embolism, PA)排除标准,文献多以D-二聚体低于500ng/mL作为AAD的排除标准[3, 4]。但在临床上却经常见到D-二聚体低于500ng/mL的AAD;而另一方面,很多临床情况会引起D-二聚体升高,只要D-二聚体大于500ng/mL便行CTA检查明显不合理。2010年ACC/AHA《胸主动脉疾病诊治指南》提出了主动脉夹层的高危特征[5],2014年ESC《主动脉疾病诊治指南》将上述特征进行量化,提出主动脉夹层检测评分(the Aortic Dissection Detection Risk Score, ADD-RS)系统[6]。作者收集近5年在北京大学人民医院急诊科怀疑AAD并行CTA检查的病例,分析其临床资料,探讨AAD-RS联合D-二聚体在AAD初筛中的应用价值。
资料和方法 一、资料收集收集自2014年至今在本院急诊科怀疑AAD的病例,入选标准:①年龄大于16岁;②病程小于14d;③同意行CTA检查及D-二聚体检查;④有5例猝死患者,虽未行CTA检查,但经胸超声心动图提示AAD,亦入组。记录患者来诊时的临床资料,包括主诉、既往史、就诊时血压(双上肢)、D-二聚体水平、CTA结果等。共入选412例,排除资料记录不完整的22例,核实病史超过14d的3例,最终入选387例。进一步根据最终诊断分为AAS组和非AAS组。未破裂的主动脉瘤、非穿透性主动脉溃疡及主动脉粥样硬化均归为非AAS组。AAD的临床分型采用Stanford分型:夹层累及升主动脉及主动脉弓者为A型,夹层仅累及胸降主动脉及其远端者为B型。
二、质量控制由接诊医生根据患者的临床情况确定可疑的AAS对象,并为其安排D-二聚体及CTA检查。符合入选标准者入组,由一名固定的医生记录其临床情况及后续D-二聚体和CTA的结果,再由另一名医生对结果进行复核,两人结果进行一致性评价。后期由另外一名对D-二聚体和CTA结果不知情的医生根据患者临床情况计算ADD-RS分值。评分系统见表 1。
| 表 1 AAS-RS评分系统 |
D-二聚体的检测方法为乳胶增强免疫比浊法,仪器及试剂采用美国IL公司的ACL-TOP-700血凝仪及原装试剂,单抗为MA-8D3,正常范围为0~243ng/mL。
四、统计学方法应用SPSS 23.0进行统计学分析。计数资料以构成比或百分比表示,计量资料采用x±s(正态分布数据)或中位数及四分位数(非正态分布数据)表示。差异性分析采用t检验(正态分布计量数据)、非参数检验(非正态分布计量数据)或卡方检验(计数资料或分类变量)。P<0.05为差异有统计学意义。
结果 一、基本资料AAS组共161例,包括AAD151例(93.79%),壁间血肿5例(3.11%),主动脉溃疡3例(1.86%),腹主动脉瘤破裂2例(1.24%)。AAD中Stanford A型占71例(47.02%),Stanford B型占80例(52.98%)。非AAS组共226例,包括急性冠脉综合征54例(ST段抬高型心梗11例,非ST段抬高型心梗20例,不稳定型心绞痛23例),肺栓塞9例,消化系统疾病49例(急性胰腺炎13例,急性胆囊炎7例,急性胃肠痉挛19例,缺血性肠病7例,消化道穿孔3例),胸膜炎/肺炎7例,肌肉骨骼相关性疾病12例,诊断不明确95例。AAS组及非AAS组的基本资料对比(见表 2)。
| 表 2 AAS组及非AAS组的基本资料对比 |
在ADD-RS=0中,AAS占9.20%(8/87);在ADD-RS=1中,AAS占47.04%(127/268);在ADD-RS>1中,AAS占81.25%(26/32)。在AAS组内,ADD-RS=0、ADD-RS=1及ADD-RS>1分别占4.97%(8/161)、78.88%(127/161)及16.15%(26/161)。ADD-RS1诊断ASS的敏感性为95.0%,特异性为35.0%,见图 1。
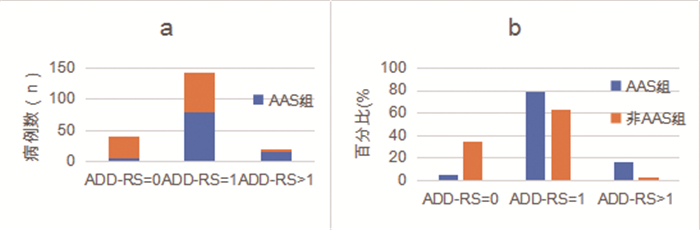
|
图 1 不同ADD-RS分值中AAS组及非AAS组的分布(a)及两组内不同ADD-RS分值的百分比(b) |
AAS组及非AAS组的D-二聚体均呈正偏态分布,最小值为62ng/mL,最大值为115000ng/mL,D-二聚体的中位数在AAS组及非AAS组分别为1533ng/mL和918.76ng/mL(P < 0.05)。D-二聚体阳性(243ng/mL)诊断AAS的敏感性为90.7%,特异性为26.1%;而D-二聚体>5000ng/mL诊断AAS的敏感性为22.4%,特异性为95.1%。15例AAS患者D-二聚体低于243ng/mL。
四、ADD-RS联合D二聚体ADD-RS=0联合D二聚体 < 243ng/mL排除AAS的敏感性为100%,特异性为9.7%。ADD-RS>1联合D二聚体>5000ng/mL提示AAS的敏感性为100%,特异性为5.0%(见表 3)。8例ADD-RS=0的AAD患者的诊断思路(见表 4)。
| 表 3 AAS组及非AAS组中ADD-RS联合D二聚体的分布情况 |
| 表 4 ADD-RS=0的AAD患者的诊断思路(共8例) |
在研究D-二聚体对于AAD的诊断价值时,多数文献将界值设定为500ng/mL,最终得出的敏感性却相差很大。究其原因与未考虑到D-二聚体的检测原理有关。D-二聚体检测的基本原理是基于抗原抗体反应,自1983年Rylatt等最先报道了D-二聚体的单克隆抗体后,目前已有20多种D-二聚体单抗相继研发问世[7]。检测方法目前临床上常用的是快速ELISA法(VIDAS)及乳胶增强免疫比浊法(latex-enhanced photometric immunoassays,LPIA)[8]。不同的检测方法对D-二聚体的检测效率有所不同,即便检测方法相同,不同厂家、不同试剂所采用的单克隆抗体也可能不同,对同一份血浆中的D-二聚体片段的结合能力及结合部位也不同。因此造成同一份标本,用不同的检测方法得出的D-二聚体的值差别很大。FACT试验对39份标本同时应用23种方法检测D-二聚体水平,检测的D-二聚体中位数最小值为0.41ug/mL,最大值为5.15 ug/mL[8]。因此,各实验室得出的D-二聚体值不能横向比较,更不应统一采用500ng/mL作为D-二聚体的界值,而应参照各自所在实验室的D-二聚体参考值[9]。本文未采用文献中普遍采用的500ng/mL,而是采用作者所在医院的参考值(243ng/mL)进行分析,即便将界值降低,仍有15例患者(15/161,9.32%)表现为D-二聚体阴性。因此,不能仅根据D-二聚体阴性排除夹层诊断。而另一方面,临床上很多情况均可导致D-二聚体升高,D-二聚体阳性涵盖的群体太大,势必要根据病人临床特征进一步筛选来进行确诊检查。
ADD-RS评分系统中列举了5种AAD的高危因素,本研究结果显示,既往病史中有马凡综合征、夹层或主动脉瘤病史的出现率在AAS组及非AAS组无显著差别,分析其原因可能为对于此类人群,临床医师的诊断意识较高,从而更容易进行大动脉CTA检查。值得注意的是,AAS组中合并高血压的几率明显高于非AAS组,在临床诊断中应给予重视。AAS的典型症状为突发(患者通常会描述症状发作的具体时间点)、程度剧烈(常伴大汗)、撕裂样、转移性疼痛。疼痛部位除了常见的胸背痛或腹痛,其他部位的疼痛也应引起重视,如腰痛及下肢疼痛。另外,非疼痛性AAD(如表现为不明原因休克、胸闷或憋气、晕厥等)在临床上误诊率极高,应仔细鉴别。临床医生通常会认为双侧血压不对称是诊断夹层的特异性表现。本研究结果表明,AAD合并双侧血压不对称的几率极低,且与非AAS组无差异。其原因为只有当AAD累及某侧锁骨下动脉导致双上肢供血不对称时才会出现双上血压不对称,而不累及锁骨下动脉或累及范围相同时患者的双侧血压是对称的。因此双侧血压不对称不是提示夹层的敏感指标。而疼痛发作时血压升高或不明原因低血压对夹层更有提示意义。与国外研究相比[10],本研究中AAS组ADD-RS>1的比例偏低,考虑其原因可能如下:①国内AAS患者的高危因素分布与国外不同。合并高血压病史、且平时血压控制不佳是国内AAS患者的主要危险因素;②体格检查不够细致。如排查局灶神经病变、主动脉瓣区听诊及检查脉搏搏动在临床上容易忽视,应引起高度重视。
ADD-RS联合D-二聚体可以提高临床排除或诊断AAD的准确性。2014年ESC《主动脉疾病诊治指南》联合了ADD-RS和D-二聚体,并结合患者血流动力学情况,对AAD的诊断流程进行了梳理[6]。指南强调了TTE在血流动力学不稳定或A型夹层诊断中的应用价值,而对于低度可能(ADD-RS1分)的患者,如果D-二聚体阴性,则认为夹层的可能性极小,可以不再进行夹层的确诊性检查。综上所述,主动脉夹层临床表现多样、病情凶险、医疗风险高,早诊断、早治疗是决定患者预后的决定性因素。主动脉夹层风险评分及D-二聚体检测在临床上均简单易得,适合在急诊科,尤其是基层医院作为怀疑AAS患者的筛选检查。
| [1] |
Sullivan PR, Wolfson AB, Leckey RD, et al. Diagnosis of acute thoracic aortic dissection in the emergency departmentp[J]. Am J Emerg Med, 2000, 18(1): 46-50. DOI:10.1016/S0735-6757(00)90047-0 |
| [2] |
Hansen MS, Nogareda GJ, Hutchison SJ. Frequency and inappropriate treatment of acute aortic dissection[J]. Am J Cardiol, 2007, 99(6): 852-856. DOI:10.1016/j.amjcard.2006.10.055 |
| [3] |
Sodeck G, Domanovits H, Schillinger M, et al. D-dimer in ruling out acute aortic dissection:a systematic review and prospective cohort study[J]. Eur Heart J, 2007, 28(24): 3067-3075. DOI:10.1093/eurheartj/ehm484 |
| [4] |
Suzuki T, Distante A, Zizza A, et al. Diagnosis of acute aortic dissection by D-dimer:the intemational Registry of Acute Aortic Dissection Substudy on Biomarkers(IRAD-Bio) experience[J]. Circulation, 2009, 119(20): 2702-2707. DOI:10.1161/CIRCULATIONAHA.108.833004 |
| [5] |
Hiratzka LF, Bakris GL, Beckman JA, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM guidelines for the diagnosis and management of patients with Thoracic Aortic Disease:a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Thoracic Surgeons, and Society for Vascular Medicine[J]. Circulation, 2010, 121(13): e266-e369. |
| [6] |
Erbel R, Aboyans V, Boileau C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases:Document covering acute and choronic aortic diseases of the thoracic and abdominal aorta of the adult The Task Force for the Diagnosis and Treament of Aortic Diseases of the European Society of Cardiology(ESC)[J]. Eur Heart J, 2014, 35(41): 2873-2926. DOI:10.1093/eurheartj/ehu281 |
| [7] |
Rylatt DB, Blake AS, Cottis LE, et al. An immunoassay for human D-dimer using monoclonal antibodies[J]. Thromb Res, 1983, 31: 767-778. DOI:10.1016/0049-3848(83)90108-1 |
| [8] |
Carl-Erik D, Sybille Z, Hanimsah E, et al. The Fibrin Assay Comparison Trial (FACT)Evaluation of 23 Quantitative D-dimer Assays as Basis for the Development of D-dimer Calibrators[J]. Thromb Haemost, 2001, 85(4): 671-678. DOI:10.1055/s-0037-1615652 |
| [9] |
杨军, 王烁, 李春盛. 检测D-二聚体对快速筛查主动脉夹层的临床意义[J]. 中华全科医师杂志, 2010, 9(11): 769-771. DOI:10.3760/cma.j.issn.1671-7368.2010.11.014 |
| [10] |
Riccardo G, Raimund Erbel, Philipp Kahlert, et al. Accuracy of a diagnostic strategy combining aortic dissection detection risk score and D-dimer levels in patients with suspected acute aortic syndrome[J]. Eur Heart J Acute Cardiovasc Care, 2017, 6(5): 371-378. DOI:10.1177/2048872615594497 |
 2020, Vol. 4
2020, Vol. 4

