2. 湖南省急救医学研究所 急危重症代谢组学湖南省重点实验室
2. Hunan Provincial Institute of Emergency Medicine, Hunan Provincial Key Laboratory of Emergency and Critical Care Metabonomics, Changsha, China
脓毒症是感染所导致的机体生理生化反应失衡,是急危重症患者致死的主要原因[1],脓毒症指南要求尽早启用抗生素治疗。生物标志物能够辅助脓毒症的识别和判断[2],使患者能从脓毒症诊疗中获益。肝素结合蛋白(Heparin-binding protein,HBP)是一种中性粒细胞分泌的颗粒蛋白,被认为是脓毒症早期诊断的一种新的生物标志物[3]。本研究拟通过盲肠结扎穿刺(cecal ligation and puncture,CLP)制备脓毒症大鼠模型,观察大鼠死亡率、严重程度评分、血液细菌数量、血浆HBP含量等,评估不同严重程度脓毒症大鼠HBP的情况以及抗生素应用对HBP的影响,以期为HBP的临床应用提供基础理论依据。
资料和方法 一、实验动物与分组6~8周龄雄性SD大鼠,体重220~250g,由湖南斯莱克景达实验动物有限公司提供。饲养于湖南省人民医院SPF级动物房,温度23±2℃,正常昼夜循环。按随机数字表随机分为正常组(N组)、假手术组(S组)、轻度脓毒症模型组(CLP-M组)、重度脓毒症模型组(CLP-S组)、抗生素治疗(A组)。
二、模型操作通过CLP制备脓毒症模型[4],大鼠术前12h禁食不禁水。10%水合氯醛0.3mL/100g腹腔麻醉,取仰卧位沿腹正中线作长2~3cm切口,游离肠系膜和盲肠,用4-0丝线结扎盲肠的回盲瓣残端(轻度:结扎25%,重度:结扎75%),18G针头对合穿孔盲肠末端2次,挤出少许肠内容物,以酒精棉球拭净后逐层关腹。S组仅游离盲肠末端,不进行结扎穿孔操作。A组在重度脓毒症模型组大鼠造模术后,立即给予青霉素钠20万U/kg肌肉注射,所有大鼠均给予皮下注射生理盐水20mL/kg。
三、标本采集每组小鼠取8只小鼠,术后24h麻醉后心脏穿刺取血,取0.1mL血液进行细菌数量检测,剩余血液2 000r/min离心10min收集血浆,置-80℃保存备用。
四、检测指标1.大鼠生存率观察:每组取20只小鼠,术后每间隔12h观察并记录生存情况,连续观察7d生存情况并计算生存率。
2.脓毒症大鼠模型严重程度评分:术后24h采用改良的评分标准[5]进行评分,观察指标包括一般情况、肠管情况、腹水情况、结扎盲肠情况、病灶包裹情况和肺干湿重比。
3.血液细菌数量检测:无菌条件下收集大鼠血液,10倍梯度稀释后置于血琼脂平板进行细菌培养,进行菌落计数。
4.血浆肝素结合蛋白检测:取大鼠血浆,采用免疫荧光干式定量法(中翰盛泰生物技术股份有限公司)检测HBP含量,具体操作按试剂盒说明书进行。
五、统计学分析数据用均数±标准差表示,采用SPSS 20.0软件进行数据统计分析,Graph Prism 5软件进行数据图片绘制,采用Kaplan-Meier法进行生存率分析,组间分析采用单因素方差分析(One-way ANOVA),两两比较采用LSD-t法,采用pearson相关进行数据相关性分析,P<0.05为差异有统计学意义。
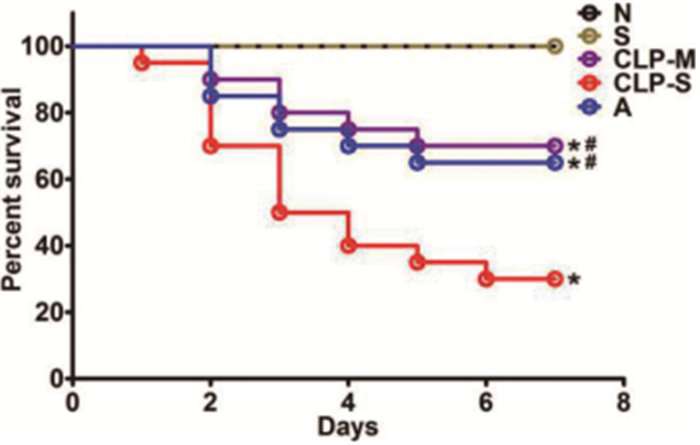
结果 一、各组大鼠生存率情况N组和S组无大鼠死亡,7d生存率为100%。CLP-M组、CLP-S组和A组7d生存率分别为70%、30%和65%。与S组比较,各模型组大鼠7d生存率显著降低(P<0.05),与CLP-S组相比,CLP-M组和A组大鼠7d生存率显著升高(P<0.05),而CLP-M组和A组两组间大鼠7d生存率无明显差异(P>0.05),见图 1。
|
图 1 各组大鼠7d生存率结果(注:*P<0.05 vs S组;#P<0.05 vs CLP-S组) |
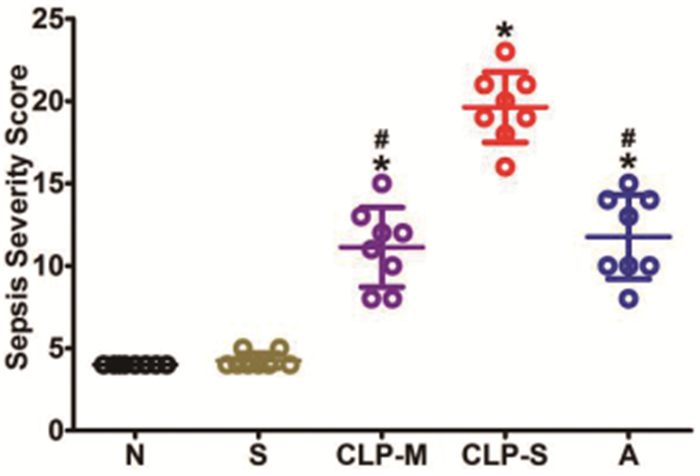
正常组和假手术组大鼠各项评分指标无明显异常,各脓毒症大鼠出现不同程度的活动度降低、进食减少、腹水、肠管充血水肿扩张、缺血坏死、肺充血渗出等。与CLP-S组相比,CLP-M组和A组大鼠严重程度评分明显降低(P<0.05),CLP-M组和A组两组间大鼠严重程度评分无明显差异(P>0.05)。见图 2。
|
图 2 各组大鼠严重程度评分果(注:*P<0.05 vs S组;#P<0.05 vs CLP-S组) |
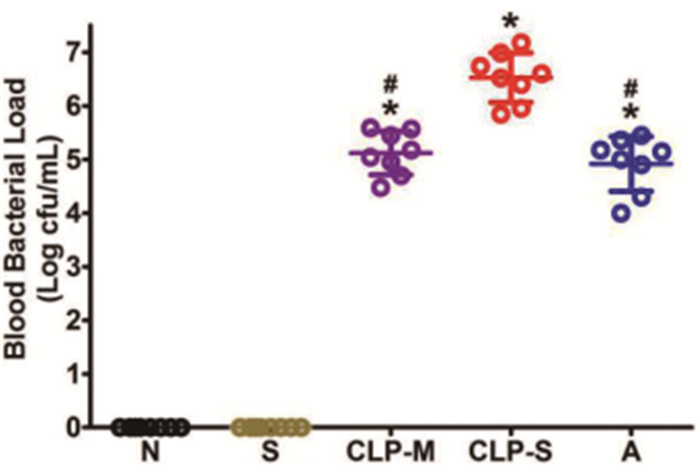
N组和S组大鼠血液中未检出菌落。各脓毒症组均有细菌检出,与CLP-S组相比,CLP-M组和A组大鼠血液细菌数量明显减少(P<0.05),CLP-M组和A组两组间大鼠血液细菌数量无明显差异(P>0.05)。见图 3。
|
图 3 图 3各组大鼠血液细菌数量(注:*P<0.05 vs S组;#P<0.05 vs CLP-S组) |
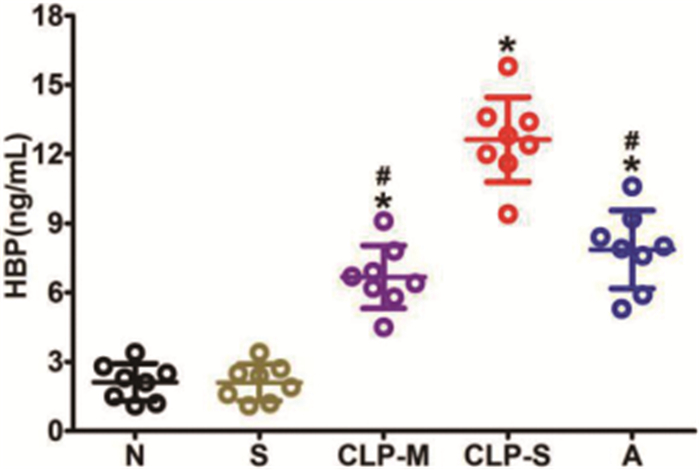
与N组相比,S组大鼠血浆HBP含量无明显差异(P>0.05);与S组相比,各脓毒症组大鼠血浆HBP含量明显增加,且与CLP-S组相比,CLP-M组和A组大鼠血浆HBP含量较低(P<0.05),而两组之间无明显差异(P>0.05)。见图 4。
|
图 4 各组大鼠血浆HBP含量(注:*P<0.05 vs S组;#P<0.05 vs CLP-S组) |
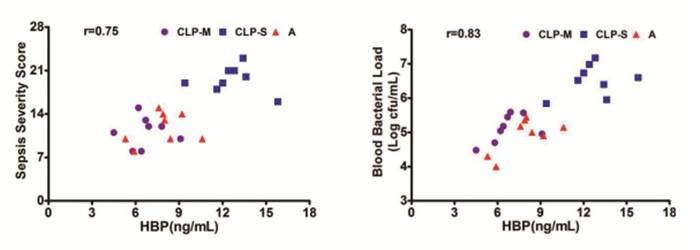
相关性分析显示脓毒症大鼠血浆HBP含量与严重程度评分/血液细菌数量均呈现正相关,pearson相关系数分别是0.75和0.83,P<0.01,见图 5。
|
图 5 脓毒症大鼠血浆HBP含量与严重程度评分/血液细菌数量的相关性分析 |
脓毒症是一种临床症状呈现非特异性的异质性疾病,且其早期症状通常不典型,20%~30%的患者在入院时未显示明显临床迹象,但在48h内发展为严重程度不同的脓毒症[6]。早期识别脓毒症的严重程度,及时有效地开展脓毒症患者的诊疗和管理,可降低严重脓毒症或脓毒性休克的发生率,对脓毒症患者的预后至关重要。同时,脓毒症的集束化治疗指南推荐诊断脓毒症后1h内应用抗生素[7],越晚使用抗生素,脓毒症死亡率会逐渐攀升。但在现阶段的临床诊疗过程中,对于脓毒症的病情评估和演变缺乏特异性的评判指标。
尽管已有超过100种生物标志物用于脓毒症的评估研究,但到目前为止能应用于临床工作的仍属凤毛麟角[8]。肝素结合蛋白是中性粒细胞受到外界刺激所释放的一种颗粒蛋白,中性粒细胞作为血液中最丰富的白细胞,也是脓毒症时最早被感染的细胞,其释放的HBP可能能够反映机体的炎症免疫状态[9]。但HBP能否作为脓毒症严重程度及抗生素应用评价的指标目前尚缺乏实验和理论支持。
本研究结果显示,假手术组和正常对照组大鼠血浆HBP含量无明显差异(P>0.05);与假手术组相比,各脓毒症组大鼠血浆HBP含量明显增加;与重度脓毒症组相比,轻度脓毒症组大鼠血浆HBP含量较低(P<0.05)。同时这两种严重程度脓毒症大鼠的症状体征评分和血液细菌数量与HBP表达呈现正相关性,提示HBP有望成为监测脓毒症严重程度的重要指标。HBP具有以下特征和作用:首先,HBP位于中性粒细胞的分泌囊泡中,感染应答发生的早期即可分泌释放;其次,HBP是血管渗漏的强有力诱导物;此外,HBP激活多种细胞类型,能够导致一系列的下游事件的产生[10]。这使得其存有作为脓毒症早期预警和评估的候选生物标志物的生物学合理性。临床上严重脓毒症常伴有器官功能障碍,HBP被认为是与器官功能损伤有关[11]。HBP作用的第一个靶标是内皮细胞,通过损害内皮屏障功能导致血管渗漏和水肿形成的炎症反应的特征[12],而血管渗漏能造成循环衰竭和低血压等[13]。发生急性肺损伤的脓毒症患者HBP水平高于无ALI的脓毒症患者,HBP直接注射到小鼠体内能诱导肺损伤表现[14]。另外,HBP同样也能影响肾血管渗漏和灌注不足而导致急性肾损伤[15]。提示HBP确实能够介导器官功能损伤而影响脓毒症的严重程度。此外,我们给予重度脓毒症组大鼠给予抗生素治疗后,发现血浆HBP含量、症状体征评分和血液细菌数量均降低(P<0.05),提示HBP还有望成为脓毒症时体液中细菌感染及抗生素应用效果的重要指标。细菌感染时,中性粒细胞和单核细胞/巨噬细胞被募集至感染部位并伴随着HBP的释放。Linder等报道化脓性链球菌引起的皮肤感染,皮损组织活检能检测到HBP,而未感染的组织则检测不到[16]。提示抗生素有效使用后能减少血液中细胞数量,从而减少对中性粒细胞的刺激,导致HBP分泌产生减少。
本研究的不足之处:一方面,本研究仅选择CLP术后24h时间点采集样本进行观察和检测,缺乏HBP的动态变化情况;另一方面,本研究采用CLP所致的脓毒症大鼠模型,由于临床脓毒症患者的异质性更为明显,研究结果还有待大样本多中心的临床研究进一步验证。
综上所述,本研究显示,作为中性粒细胞释放的一种颗粒蛋白,血清HBP含量与脓毒症大鼠的症状体征评分和血液细菌数量呈正相关,HBP有望成为监测脓毒症严重程度及抗生素应用的重要指标。
| [1] |
Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] |
Sandquist M, Wong HR. Biomarkers of sepsis and their potential value in diagnosis, prognosis and treatment[J]. Expert Rev Clin Immunol, 2014, 10(10): 1349-1356. DOI:10.1586/1744666X.2014.949675 |
| [3] |
Fisher J, Linder A. Heparin-binding protein:a key player in the pathophysiology of organ dysfunction in sepsis[J]. J Intern Med, 2017, 281(6): 562-574. DOI:10.1111/joim.12604 |
| [4] |
Rittirsch D, Huber-Lang MS, Flierl M A, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4(1): 31-36. DOI:10.1038/nprot.2008.214 |
| [5] |
邵义明, 姚华国, 梁小仲, 等. 高迁移率族蛋白B1表达水平与大鼠脓毒症严重程度及预后关系的实验研究[J]. 中国危重病急救医学, 2006, 18(11): 668-672. |
| [6] |
Glickman SW, Cairns CB, Otero RM, et al. Disease Progression in Hemodynamically Stable Patients Presenting to the Emergency Department With Sepsis[J]. Acad Emerg Med, 2010, 17(4): 383-390. DOI:10.1111/j.1553-2712.2010.00664.x |
| [7] |
Levy MM, Evans LE, Rhodes A. The Surviving Sepsis Campaign Bundle:2018 Update[J]. Crit Care Med, 2018, 46(6): 997-1000. DOI:10.1097/CCM.0000000000003119 |
| [8] |
Prucha M, Bellingan G, Zazula R. Sepsis biomarkers[J]. Clinica Chimica Acta, 2015, 440(440): 97-103. |
| [9] |
Fisher J, Linder A. Heparin-binding protein:a key player in the pathophysiology of organ dysfunction in sepsis[J]. J Intern Med, 2017, 281(6): 562-574. DOI:10.1111/joim.12604 |
| [10] |
Huttunen R, Syrjänen J. Heparin-binding protein:a potential biomarker in sepsis?[J]. Clin Infect Dis, 2010, 50(2): 283-285. |
| [11] |
Linder A, Arnold R, Boyd JH, et al. Heparin-Binding Protein Measurement Improves the Prediction of Severe Infection With Organ Dysfunction in the Emergency Department[J]. Crit Care Med, 2015, 43(11): 2378-2386. DOI:10.1097/CCM.0000000000001265 |
| [12] |
Gautam N, Olofsson AM, Herwald H, et al. Heparin-binding protein (HBP/CAP37):a missing link in neutrophil-evoked alteration of vascular permeability[J]. Nat Med, 2001, 7(10): 1123-1127. DOI:10.1038/nm1001-1123 |
| [13] |
Linder A, Kesson P, Inghammar M, et al. Elevated plasma levels of heparin-binding protein in intensive care unit patients with severe sepsis and septic shock[J]. Crit Care, 2012, 16(3): R90. DOI:10.1186/cc11353 |
| [14] |
Bentzer P, Fisher J, Kong HJJ, et al. Heparin-binding protein is important for vascular leak in sepsis[J]. Intensive Care Med Exp, 2016, 4(1): 33. DOI:10.1186/s40635-016-0104-3 |
| [15] |
Tydén J, Herwald H, Hultin M, et al. Heparin-binding protein as a biomarker of acute kidney injury in critical illness[J]. Acta Anaesthesiol Scand, 2017, 61(7): 797-803. DOI:10.1111/aas.12913 |
| [16] |
Linder A, Johansson L, Thulin P, et al. Erysipelas Caused by Group A Streptococcus Activates the Contact System and Induces the Release of Heparin-Binding Protein[J]. J Invest Dermatol, 2010, 130(5): 1365-1372. DOI:10.1038/jid.2009.437 |
 2019, Vol. 3
2019, Vol. 3

