脓毒性休克是常见危重病,是急救抢救室患者死亡最主要的原因之一,病死率高[1~3]。心血管系统异常在脓毒性休克中占据重要原因; 包括外周血管功能障碍可导致微循环血流异常,常诱发心肌抑制,且发生率在40%以上,增加脓毒症患者死亡的风险[4]。近期有研究表明,糖皮质激素的应用对脓毒性休克患者的预后有保护性作用,但是临床医师对此意见不一致,给临床用药带来困扰。TnI是表达在心肌细胞胞浆内的特异性抗原,TnI在正常心肌组织中均匀分布;心肌损伤时,TnI容易从心肌细胞中释放入血[5]。一项动物实验研究显示,低剂量氢化可的松降低兔脓毒症模型中cTnI水平,延缓心肌功能下降,从而对心肌起保护作用[6]。早期亦有研究发现低剂量的氢化可的松通过恢复脓毒性性休克患者血流动力学,发挥心血管保护作用[7]。PGI2发挥扩张血管、抑制血小板聚集、来维持血管内皮细胞完整性和抗动脉粥样硬化等保护作用。本研究建立脓毒性休克早期(6h)模型,研究小剂量氢化可的松对脓毒性休克早期的治疗作用。
资料和方法 一、实验动物24只健康雄性SD大鼠,8周龄,体重190g~220g,由广西医科大学实验动物中心提供。随机分为3组:正常对照组、脓毒性休克组、低剂量氢化可的松组。正常对照组等量的生理盐水静脉注射代替LPS;脓毒性休克组和低剂量氢化可的松组静脉注射LPS;低剂量氢化可的松组在造模成功后,予以氢化可的松5mg/kg股静脉注射。建模成功后6h股静脉采血,血浆检测PGI2的浓度,取大鼠心尖组织,10%甲醛固定24h,石蜡包埋行组织切片染色观察。
二、试剂PGI2 Elisa试剂盒(武汉云克隆)、兔单克隆抗体cTnI(美国Abcom,货号ab209809)、二抗(PV-6001,北京中杉金桥)、DAB显色剂(迈新试剂公司)。
三、动物模型建立大鼠均以20%的乌拉坦腹腔麻醉,剔除大鼠右侧大腿毛发,剪开其皮肤后,钝性分离肌肉组织,分离出右股动脉,右股静脉;通过PE-50管插入右股动脉、右股静脉,留置三通管,连接BL240生物换能系统,监测大鼠血压心率。置管成功后,观察大鼠基础血压值稳定20min后,记录大鼠的基础血压值。以大鼠平均动脉血压值较其基础值,下降20%~30%并持15min~30min,模型建立成功。
四、标本检测1.Elisa操作步骤严格按照Elisa试剂盒步骤,测定血浆中PGI2水平。
2.HE和IHC取固定好的石蜡包埋切片,切成厚度3μm切片,脱蜡,水化,行HE染色和IHC计算机图像处理系统由CMOS及软件Image-Pro Plus组成。根据阳性免疫反应的图像,以人机交互方式测定阳性免疫染色强度及面积。由计算机计算出所测阳性反应物相对积分光密度及面积。
五、统计学处理采用SPSS 22.0统计软件分析,计量资料采取均数±标准差(x±s)表示;组间比较采用单因素方差分析,P<0.05表示统计学有差异。
结果 一、脓毒性休克早期模型建立大鼠在静脉注射LPS后约60min左右,大鼠的MAP下降到基础值的20%~30%,且持续一段时间,脓毒性休克早期模型建立成功。大鼠出现毛发竖立,呼吸不均匀,逐渐出现眼角及鼻孔有分泌物流出,精神状态萎靡。休克时,与正常对照组相比,脓毒性休克组与低剂量氢化可的松组休克时的MAP、SBP、DBP均有统计学意义(P<0.05)。
| 表 1 各组大鼠休克时血压值(mmHg)变化(x±s;n=8) |
HE染色:正常对照组无明显改变;脓毒性休克组出现明显的炎性浸润及细胞水肿,细胞轮廓不清;低剂量氢化可的松组细胞尚规整,无明显细胞肿胀。见图 1。
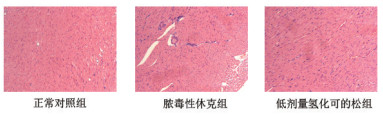
|
图 1 建模后大鼠心肌组织病理切片结果(×200) |
IHC结果提示,与正常对照组相比,脓毒性休克组的cTnI表达水平明显下降(P<0.05),低剂量氢化可的松干预后cTnI表达水平上升(P<0.05),见图 2。
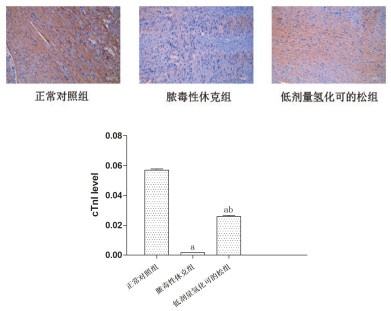
|
图 2 建模后大鼠心肌组织中cTn Ⅰ表达水平(免疫组化,200倍)注:与正常对照组相比,aP<0.05,与脓毒性休克组相比,bP<0.05 |
脓毒性休克组的PGI2含量与正常对照组相比较显著上升{(0.67±0.17) vs(2.10±0.41),P<0.05},与脓毒性休克组相比较, 低剂量氢化可的松组PGI2(1.33±0.39)含量明显下降(P<0.05),见图 3。
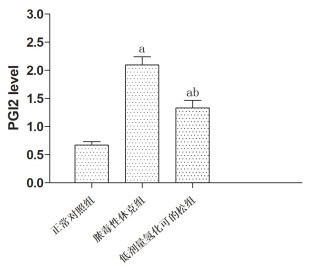
|
图 3 建模后大鼠血浆中PGI2含量(注:与正常对照组相比,aP<0.05,与脓毒性休克组相比,bP<0.05) |
脓毒症伴心功能障碍的患者,是重症监护病房患者死亡的主要原因之一,病死率在70%以上[8]。糖皮质激素应用于临床脓毒性休克患者的治疗,已有几十年的历史,但是其利弊争议一直未断,但是糖皮质激素在脓毒性休克早期的研究鲜有报道[9]。本研究通过检测cTnI及PGI2的变化,研究低剂量氢化可的松对脓毒性休克早期的治疗作用。
严重脓毒症/脓毒性休克模型,存在心肌损伤。cTnI是目前公认提示心肌损伤程度敏感度和特异度都很高的指标[10]。Sheyin等一项荟萃分析显示,心肌肌钙蛋白的升高与脓毒性休克患者的病死率显著相关[11]。有动物实验研究表明,经腹腔注射LPS5mg/kg的小鼠,出现心肌损伤,导致心功能障碍[12]。本研究中结果与国内外报道相符,IHC结果提示,在脓毒性休克早期应用小剂量氢化可的松后,cTnI的阳性细胞数明显上升,心肌损伤减轻。本研究结果也发现,大鼠在注射LPS后,血压值呈现下降趋势,约1h左右,MAP下降到基础值20%~30%,提示大鼠的血流动力学改变,心脏的收缩和舒张功能可能受损。病理结果提示,脓毒性休克组大鼠心肌组织出现大量炎性细胞浸润,细胞间隙增宽;小剂量氢化可的松干预后,炎性细胞浸润减少,细胞间隙变窄。与文献报道的脓毒症时期出现心肌组织病理学的改变,心肌细胞出现大量炎性细胞浸润,变性、坏死等结果相符[13]。
内皮细胞产生的PGI2,作为血管舒张因子,在维持屏障功能的生理状态和保护屏障免受环境损伤和促炎细胞因子的破坏方面发挥着重要作用[14]。PGI2在血管系统中也发挥重要作用,抑制血小板聚集、血管收缩和平滑肌细胞增殖[15]。然后,当脓毒症发生时,在内毒素的刺激下,前列环素过度生成,冠状动脉血流异常,加重冠状动脉微循环障碍[16]。本研究中进入休克后6h大鼠,PGI2在血浆中的浓度相比正常对照组,明显升高,然而小剂量的氢化可的松干预后,大鼠血浆中的PGI2明显下降。提示,低剂量氢化可的松对脓毒性休克早期发挥保护作用。
总之,本研究表明脓毒性休克组中出现cTnI表达水平低,PGI2浓度高,早期应用低剂量氢化可的松后,cTnI表达水平明显上升,PGI2浓度下降。因此推测小剂量氢化可的松干预脓毒性休克早期,是通过抑制心肌损伤和心肌微循环发挥保护作用。
| [1] |
Kaukonen KM, Bailey M, Suzuki S, et al. Mortality related to severe sepsis and septic shock among critically ill patients in Australia and New Zealand, 2000-2012[J]. JAMA, 2014, 311(13): 1308-1316. DOI:10.1001/jama.2014.2637 |
| [2] |
Dobson GP. Addressing the global burden of sepsis:importance of a systems-based approach[J]. Crit Care Med, 2014, 42(12): 797-798. DOI:10.1097/CCM.0000000000000595 |
| [3] |
Salluh JI, Póvoa P. Corticosteroids in Severe Sepsis and Septic Shock:A Concise Review[J]. Shock, 2017, 47(1S Suppl1): 47-51. |
| [4] |
Fernandes CJ Jr, de Assuncao MS. Myocardial Dysfunction in Sepsis:A Large, Unsolved Puzzle[J]. Crit Care Res Pract, 2012, 2012(7): 896430. |
| [5] |
Tiwari R P, Jain A, Khan Z, et al. Cardiac Troponins I and T:Molecular Markers for Early Diagnosis, Prognosis, and Accurate Triaging of Patients with Acute Myocardial Infarction[J]. Mol Diagn Ther, 2012, 16(6): 371-381. DOI:10.1007/s40291-012-0011-6 |
| [6] |
冯恩民, 孙华, 夏延贞. 氢化可的松对兔脓毒症早期心肌功能的影响[J]. 中国危重病急救医学, 2009, 21(12): 719-721. |
| [7] |
Keh D, Boehnke T, Weber-Cartens S, et al. Immunologic and hemodynamic effects of "low-dose" hydrocortisone in septic shock:a double-blind, randomized, placebo-controlled, crossover study[J]. Am J Respir Crit Care Med, 2003, 167(4): 512-520. DOI:10.1164/rccm.200205-446OC |
| [8] |
金善子, 王胜. 线粒体通透性转换孔在脓毒症心肌抑制发生过程中的作用[J]. 中华危重病急救医学, 2016, 28(8): 747-751. DOI:10.3760/cma.j.issn.2095-4352.2016.08.018 |
| [9] |
廖如意, 赵会民. 糖皮质激素对脓毒性休克的影响及机制[J]. 实用休克杂志(中英文), 2019, 3(2): 109-111, 119. |
| [10] |
Sachdeva A, Paul B. Newer cardiac biomarkers in myocardial necrosis[J]. J Assoc Physicians India, 2014, 62(10): 83-84. |
| [11] |
Sheyin O, Davies O, Duan W, et al. The prognostic significance of troponin elevation in patients with sepsis:a meta-analysis[J]. Heart Lung, 2015, 44(1): 75-81. |
| [12] |
Wang H, Bei Y, Huang P, et al. Inhibition of miR-155 Protects Against LPS-induced Cardiac Dysfunction and Apoptosis in Mice[J]. Mol Ther Nucleic Acids, 2016, 5(10): e374. |
| [13] |
Zhang T, Yan T, Du J, et al. Apigenin attenuates heart injury in lipopolysaccharide-induced endotoxemic model by suppressing sphingosine kinase 1/sphingosine 1-phosphate signaling pathway[J]. Chem Biol Interact, 2015, 233: 46-55. DOI:10.1016/j.cbi.2014.12.021 |
| [14] |
Chu LY, Liou JY, Wu KK. Prostacyclin protects vascular integrity via PPAR/14-3-3 pathway[J]. Prostaglandins Other Lipid Mediat, 2015, 118-119: 19-27. DOI:10.1016/j.prostaglandins.2015.04.006 |
| [15] |
Chen S, Xie S, He W, et al. Beneficial Effect of Beraprost Sodium Plus Aspirin in the Treatment of Acute Ischemic Stroke[J]. Med Sci Monit, 2017, 23: 4401-4407. DOI:10.12659/MSM.902825 |
| [16] |
李昕原, 吴彩军, 郭楠, 等. 脓毒症心肌病的研究进展[J]. 中国中西医结合急救杂志, 2019, 26(3): 373-378. DOI:10.3969/j.issn.1008-9691.2019.03.030 |
 2019, Vol. 3
2019, Vol. 3

