2. 东港市中心医院重症医学科
2. Intensive Care Unit, Donggang Center Hospital, Dalian, China
脓毒症(Sepsis)是严重创伤、休克、感染、外科大手术患者常见的并发症,进一步发展可导致脓毒性休克、多器官功能障碍综合征,是临床危重患者最主要的死亡原因之一[1]。心肌损害是脓毒症中最严重的并发症之一,也是重症监护病房内主要死因之一,改善脓毒症患者心功能至关重要。研究表明炎症因子浸润,导致血管内皮细胞损伤是导致脓毒症时心肌损害主要原因之一。然而目前对脓毒症合并心肌损害的治疗仍无有效方法。现有研究认为他汀类药物除调脂作用外,尚具有改善内皮功能、抑制炎症反应、抗氧化、影响凝血机制等作用,近年来有报道认为他汀类药物可以降低脓毒症的死亡率[2~4]。肿瘤坏死因子α (TNF-α)被认为是在脓毒症发病中的重要促炎介质,它可诱发IL-1、IL-6、IL-8以及继发性炎症介质的产生。脓毒症初期即可出现心肌损害,心肌肌钙蛋白I(cTnI)是反映心肌损害特异性指标心,脓毒症合并心肌损害时提示脓毒症患者预后不良。本实验采用盲肠结扎穿孔术(cecal ligation and puncture,CLP)建立脓毒症大鼠模型,动态观察TNF-α和cTnI的变化以及阿托伐他汀对它们的影响,探讨他汀类调脂药的对于脓毒症临床治疗的应用价值。
资料和方法 一、仪器设备迈瑞MR96A酶标仪,西门子Dimension RXL Max HM全自动生化仪,DS-88型电子秤(武汉自动化仪表厂),TG16WS高速台式离心机(长沙科学仪器厂),HH-W21-600电热恒温水浴箱(上海医用恒温设备厂)。
二、试剂和材料阿托伐他汀(立普妥),20mg/片,大连辉瑞制药有限公司生产,批号081128。麻醉剂:3%戊巴比妥钠。制作模型的耗材:爱惜康(黑色)编织非吸收性缝线,15×60cm,由Johnson公司生产。KGERC102a凯基大鼠TNF-α ELISA试剂盒,由南京凯基生物科技发展有限公司生产。
三、实验动物分组及给药100只健康雄性SD(Sprague-Dawley)大鼠,体重184~202g,购于大连医科大学实验动物中心。在实验室内饲养,环境温度22~25℃,空气湿度40~70%。每5只大鼠置一笼(475×300×200mm),在笼内自由活动,摄取全价配合饲料(大连医科大学实验动物中心提供)并自由饮水,自然长度的昼夜循环。
按照随机排列表法分为对照组,脓毒症组,阿托伐他汀低剂量组,阿托伐他汀高剂量组,每组25只。对照组用淀粉40mg·kg-1·d-1加入2mL生理盐水制成混悬液灌胃5d,术前禁食12h,腹腔注射3%戊巴比妥钠45mg·kg-1麻醉,无菌条件下取下腹正中切口2cm,翻动盲肠后还纳腹腔,逐层缝合切口,置笼内活动,不禁饮食。脓毒症组术前灌胃与对照组相同,阿托伐他汀组低剂量和高剂量组用研钵粉碎阿托伐他汀,分别以20和40mg·kg-1·d-1加入2mL生理盐水制成混悬液连续灌胃5d,采用CLP制作脓毒症大鼠模型。大鼠的给药量参照刘福英,刘田福主编的《实验动物学》[5]。
四、盲肠结扎穿孔术(CLP)术前禁食12h,腹腔注射3%戊巴比妥钠45mg·kg-1麻醉,无菌条件下取下腹正中切口2cm,暴露盲肠,用丝线结扎盲肠总长度的30%,注意避开系膜血管,9号注射针头在盲肠游离端选2个相距3mm点分别刺孔穿透盲肠,然后将盲肠还纳腹腔,逐层缝合切口,即刻皮下注射生理盐水3mL·100g-1体重以补充术中丢失的液体[6]。术后置笼内活动,不禁饮食。
五、大鼠脓毒症严重程度评分标准采用改良的评定标准进行评分[7]。
六、标本收集各组分别在术后0,3,6,12,24h各取五只大鼠麻醉后,剪去一侧颈部外侧被毛,剪开皮肤,剥离组织,找到颈静脉或颈动脉后,使用注射器采血,在采血管中静置30min,4℃以4 000r.min离心15min,分离出血浆后于-80℃冰箱中保存。
七、标本检测TNF-α应用凯基大鼠TNF-α ELISA试剂盒测定。cTnI应用西门子Dimension RXL Max HM全自动生化仪检测。
八、组织病理观察各组分别在术后取0,3,6,12,24h心脏标本及术后0,24h空肠标本,置10%甲醛溶液中固定,依次进行常规脱水、石蜡包埋、制成切片、苏木精-伊红(HE)染色后,光镜下检查组织病理学改变。
九、统计学处理采用SPSS 22.0软件包进行统计学处理,计量资料以均数±标准差表示,正态分布变量多组间的比较用方差分析,非正态分布变量用秩和检验,四个处理组之间均数两两比较用LSD-t检验法,以P<0.05为差异具有统计学意义。
结果 一、大鼠一般情况脓毒症组大鼠活动少,不再扎堆取暖,冷漠,皮毛失去光泽,停止饮水,竖毛,有些大鼠呼吸快,眼睛变双环,在脓毒症晚期,对被动仰卧无反抗,感觉迟钝,短期内死亡。腹腔肠系膜充血肠管显著扩张、结扎盲肠坏死、血性腹水、病灶处大网膜包裹不佳、肝肿大、肺表面充血明显等。低剂量组出现厌食、竖毛、活动少甚至不活动等情况,肠管轻-中度扩张,腹水微臭,坏死盲肠被大网膜及周围肠管包裹完好,但局部可见坏死,高剂量组亦出现厌食、竖毛、活动少等情况,肠管轻度扩张,腹水减少,坏死盲肠被大网膜及周围肠管包裹明显,对照组没有相关表现。各组大鼠脓毒症严重程度评分见表 1。
| 表 1 四组大鼠脓毒症严重程度评分比较 |
0h各组血浆TNF-α浓度比较差异无显著性意义(P=0.672,P>0.05)。对照组血浆TNF-α浓度变化不明显,在3h、6h、12h、24h脓毒症组和对照组、阿托伐他汀低剂量组、阿托伐他汀高剂量组比较差异均有显著性意义(P<0.01)。脓毒症组血浆TNF-α浓度在术后3h显著升高,6h达到峰值(49.88±4.73 ng·mL-1)之后逐渐下降。阿托伐他汀组血浆TNF-α浓度同样在术后3h显著升高,在6h达到峰值(低剂量组34.42±1.72 ng·mL-1,高剂量组27.06±0.84ng·mL-1),较脓毒症组明显降低(P低=0.001,P高=0.001,P<0.01),具有显著性差异。12h阿托伐他汀高剂量组较阿托伐他汀低剂量组血浆TNF-α浓度明显降低(P=0.002,P<0.01),具有显著性差异。24小时阿托伐他汀高剂量组较阿托伐他汀低剂量组血浆TNF-α浓度也有明显降低(P=0.046,P<0.05),具有显著性差异,见表 2。
| 表 2 阿托伐他汀对脓毒症大鼠血浆肿瘤坏死因子的影响(单位:ng·mL-1) |
0h各组血浆cTnI浓度比较差异无显著性意义(P=0.771,P>0.05)。对照组血浆cTnI浓度变化不明显,在3h、6h、12h、24h脓毒症组和对照组、阿托伐他汀低剂量组、阿托伐他汀高剂量组比较差异均有显著性意义(P<0.01)。脓毒症组血浆cTnI浓度在术后3h显著升高,6h达到峰值(0.82±0.04ng·mL-1)之后逐渐下降。阿托伐他汀组血浆cTnI浓度同样在术后3h显著升高,在6h达到峰值(低剂量组0.58±0.02ng·mL-1,高剂量组0.49±0.08 ng·mL-1),较脓毒症组明显降低(P低=0.001,P高=0.001,P<0.01),具有显著性差异。12h阿托伐他汀高剂量组较阿托伐他汀低剂量组血浆cTnI浓度明显降低(P=0.014,P<0.05),具有差异。24h阿托伐他汀高剂量组较阿托伐他汀低剂量组血浆cTnI浓度无明显降低(P=0.0722,P>0.05),见表 3。
| 表 3 阿托伐他汀对脓毒症大鼠血浆心肌肌钙蛋白I的影响(单位:ng·mL-1) |
对照组肠粘膜正常。脓毒症组肠粘膜部分上皮脱落,重度炎症。阿托伐他汀组肠粘膜中度炎症。高剂量组较低剂量组轻, 见图 1。
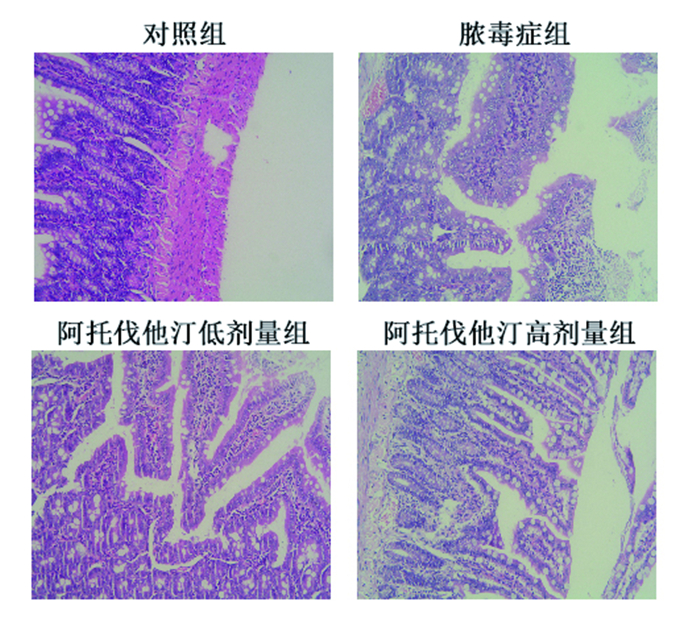
|
图 1 大鼠小肠24h病理改变(HE 200倍) |
0h对照组、脓毒症组、阿托伐他汀低剂量组、阿托伐他汀高剂量组心脏病理无异常改变。3h脓毒症组心脏病理可见少量炎症细胞浸润,阿托伐他汀低剂量组、阿托伐他汀高剂量组心脏病理无异常改变。6h脓毒症组心脏病理可见炎症细胞浸润及心肌变性,间质水肿;阿托伐他汀低剂量组心脏病理炎症细胞浸润,中性粒细胞居多,心肌水肿;阿托伐他汀高剂量组心脏病理仅见到炎症细胞浸润。12h脓毒症组心脏病理可见心肌纤维变性水肿,局部心肌细胞浆呈空泡状改变,少量心肌脂肪变性,心肌间质充血、水肿;阿托伐他汀低剂量组心脏病理心肌纤维断裂,微灶性出血,间质炎症细胞浸润;阿托伐他汀高剂量组心脏病理心肌正常,间质充血,炎症细胞浸润。24h脓毒症组心脏病理可见心肌变性,胞浆呈空泡状改变,心肌间质充血,炎症细胞浸润;阿托伐他汀低剂量组心脏病理心肌变性,炎症细胞浸润;阿托伐他汀高剂量组心脏病理小血管炎细胞渗出,心肌局部微灶性出血, 见图 2。
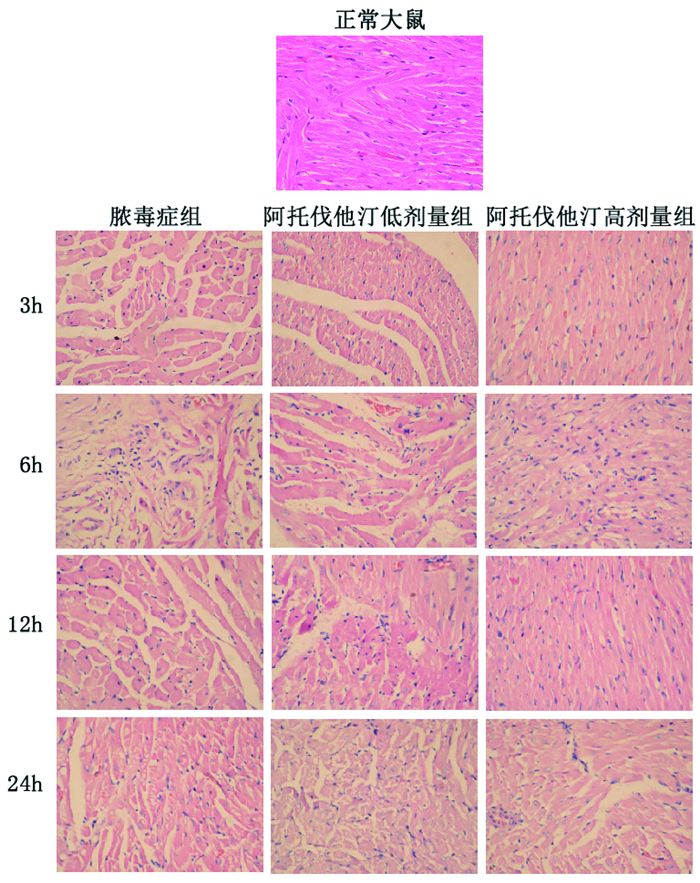
|
图 2 大鼠心肌HE染色(HE 400倍) |
脓毒症相关性心肌损伤是影响严重脓毒症患者预后的最主要因素之一。严重脓毒症病情发展的主要原因为体内炎症介质及细胞因子反应失调, 其中以血管内皮细胞功能紊乱为主。脓毒症时可产生多种细胞因子,其中,肿瘤坏死因子α(TNF-α)和白细胞介素(IL)作为脓毒症发展过程中的中心介质可直接或通过其他方式对心肌造成损伤。当严重脓毒症发生时, 细菌的直接损伤、自身毒素分泌以及由此引发的炎症反应影响可导致心肌细胞线粒体功能障碍, 细胞器泵衰竭, 心肌细胞凋亡, 最终导致心脏收缩及舒张功能障碍。有研究表明, 血管内皮细胞功能的调节失衡是炎性反应的中枢环节[8]。
TNF-α是一种具有多种生物学效应的促炎因子, 是机体受到有害刺激后最初分泌,起关键始动作用的细胞因子,其核心作用是在炎症反应中激活细胞因子级联反应,它是脓毒症过程中最重要的细胞因子之一。有研究显示阿托伐他汀可以降低脓毒症早期TNF-α等炎症介质水平[9, 10]。本实验证实脓毒症组大鼠盲肠结扎术后3、6、12、24h血浆TNF-α含量均高于对照组,在6h达到高峰,之后逐渐下降。
cTnI具有高度的心肌特异性,能很好反映心肌的损伤。Ammann等证实,脓毒症和脓毒性休克能引起血清cTnI升高[11, 12]。Labugger等的研究发现,在脓毒症过程中,心肌细胞损害多为细胞亚微结构的改变,心肌内肌钙蛋白裂解为较小片段,心肌细胞膜通透性增加,从而导致血浆肌钙蛋白水平的升高[13]。本实验结果显示脓毒症组大鼠盲肠结扎术后3、6、12、24h血浆cTnl含量均高于对照组,在6h达到高峰,之后逐渐下降。
心肌细胞膜上存在TNF-α的受体,心肌既是TNF-α作用的靶器官,又是合成TNF-α的场所。TNF-α不仅可直接抑制心肌收缩功能,还参与心肌组织结构的破坏,可增加心脏前负荷,破坏心肌钙稳态。研究发现,严重烧伤后脓毒症的患者血清TNF-α水平呈显著升高,且与血清心肌酶及血浆cTnT的变化正相关,提示脓毒症后大量产生的TNF-α在心肌损伤中起着重要的作用[14]。本实验结果可见脓毒症组大鼠盲肠结扎术后3、6、12、24h血浆TNF-α及血浆cTnl含量均高于对照组,在6h达到高峰,之后逐渐下降,两者的变化存在相关性,进一步证实在脓毒症的过程中TNF-α在心肌损伤中起着重要的作用,促进cTnI的表达。
阿托伐他汀钙属于选择性3-羟基-3甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂, 是目前临床上应用广泛的强效血管内皮细胞稳定剂。同时早在2000年Ando等首先在动物模型中证实他汀类药物对脓毒症的影响,作者用腹腔注射脂多糖(lipopolysaccharide, LPS)建立脓毒症大鼠模型,2h后血清中的肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1β)上升,随后硝酸盐水平也明显升高;而事先用西立伐他汀(Cerivastatin)干预后TNF-α、IL-1β、硝酸盐水平明显下降[15]。对照组大鼠7d生存率为26.7%,而西立伐他汀干预组7d生存率为73.3%, P=0.016(P<0.5)。他汀类药物可能通过抑制炎症因子的释放而改善试验大鼠的生存率。阿托伐他汀能够提高高密度脂蛋白(HDL)的水平,阻断内毒素与CD14的结合,降低内毒素对CD14细胞的刺激,使其释放TNF、IL-1等多种细胞因子的能力明显下降,调节促炎因子,并通过抗氧化应激反应以及改善内皮细胞功能等机制来达到抗脓毒症效果,还可通过下调脓毒症时心肌的β1受体改善左室功能,减少脓毒症所致的心肌细胞凋亡[16~25]。近年来有研究显示阿托伐他汀能改善微血管功能障碍,减轻脓毒症神经炎症反应,阻止长期认知衰退的发展[26]。
由于他汀类药物具有稳定血管内皮细胞、抗炎作用,可抑制炎症因子的释放。因而,人们设想其可对脓毒症中所发生的炎症反应产生影响[27, 28]。本实验阿托伐他汀组肿瘤坏死因子-α(TNF-α)及cTnl均低于脓毒症组,尤其在大鼠盲肠结扎术后3h、6h存在显著性差异(P<0.05),并且对于炎症细胞因子的抑制作用与剂量呈正相关性,高剂量组的肿瘤坏死因子-α(TNF-α)及cTnl均低于低剂量组,尤其在大鼠盲肠结扎术后3h、6h存在显著性差异(P<0.05)。证实阿托伐他汀能够调节促炎因子,并通过抗氧化应激反应以及改善内皮细胞功能等机制保护心肌,减少cTnl的表达。
脓毒症心肌病理变化距离术后时间越长,病变越严重,表现为心肌坏死变性越严重,病变越广泛。对于炎症细胞,渗出越多越严重。病理学变化滞后于cTnI的升高,脓毒症早期cTnI的升高能更及时的反应心肌损害的程度。应用阿托伐他汀干预组心肌病理炎症表现出现的时间延迟、程度明显减轻,这一变化与剂量呈正相关性。
本实验结果提示,脓毒症组肿瘤坏死因子-α(TNF-α)及cTnl较阿托伐他汀组均明显升高,并且高剂量组的肿瘤坏死因子-α(TNF-α)及cTnl均低于低剂量组,与剂量呈正相关性。进一步证实阿托伐他汀的抗脓毒症作用。心肌病理学变化较酶学变化滞后,大鼠脓毒症模型组在6h后即出现炎症改变并逐渐加重,阿托伐他汀组较脓毒症组炎症反应程度减轻,其中阿托伐他汀高剂量组较低剂量炎症反应更轻,证实阿托伐他汀对于脓毒症大鼠心肌具有保护作用。尽管我们对于脓毒症的研究不断取得进步,但是其确切的发病机制仍不明确,导致治疗上局限。阿托伐他汀抗脓毒症作用多在动物试验中研究,相关理论仍需要通过临床治疗观察来进一步证实,希望将来能为脓毒症提供一个新的治疗方法和思路。
| [1] |
Kumana CR, Cheung BM, Lauder IJ. Simvastatin reduced mortality and vascular events in high-risk patients[J]. ACP J Club, 2003, 138(1): 2-3. |
| [2] |
Ascan W, Sabine GZ, Thomas M. Should Treatment of Sepsis Include Statins[J]. Circulation, 2005, 111(14): 1735-1737. |
| [3] |
Yaniv A, Alexander S, Victor N. Prior Statin Therapy Is Assodated With a Decreased Rate of Severe Sepsis[J]. Circulation, 2004, 110(7): 880-885. DOI:10.1161/01.CIR.0000138932.17956.F1 |
| [4] |
Lee CC, Lee MG, Hsu TC, et al. A Population-Based Cohort Study on the Drug-Specific Effect of Statins on Sepsis Outcome[J]. Chest, 2018, 153(4): 805-815. DOI:10.1016/j.chest.2017.09.024 |
| [5] |
刘福英, 刘田福. 实验动物学[M]. 北京: 中国科学技术出版社, 2005: 209-210.
|
| [6] |
燕晓雯, 李维勤, 黎介寿, 等. 通过改变盲肠结扎长度制造不同感染程度的大鼠盲肠结扎穿孔模型[J]. 中华实验外科杂志, 2007, 24(12): 1340. |
| [7] |
Wichteman KA, Baue AE, Chaudry IH. Sepsis and septic shock:a review of laboratory models and proposal[J]. Surg Res, 1980, 29: 189-201. DOI:10.1016/0022-4804(80)90037-2 |
| [8] |
李登辉, 胡德林, 李亚南, 等. 脓毒症早期炎症因子变化与心肌损伤的相关性研究[J]. 安微医学, 2014, 35(12): 1627-1628. |
| [9] |
Jing F, Li M, Ren H, et al. Effects of atorvastatin combined with low-molecular-weight heparin on plasma inflammatory cytokine level and pulmonary pathophysiology of rats with sepsis[J]. Experimental and therapeutic medicine, 2016, 12(2): 1048-1054. DOI:10.3892/etm.2016.3372 |
| [10] |
Wang XQ, Luo NS, Chen ZQ, et al. Atorvastatin attenuates TNF-alpha production via heme oxygenase-1 pathway in LPS-stimulated RAW264.7 macrophages[J]. Biomedical and Environmental Sciences, 2014, 27(10): 786-793. |
| [11] |
Ammann P, Fehr T, Minder El, et al. Elevation of troponins I in sepsis and septic shock[J]. Intensive Care Med, 2001, 27(6): 965-969. DOI:10.1007/s001340100920 |
| [12] |
Ver elst KM, Spapenh D, Nguyen DN, et al. Cardiac troponins I and T are biological markers of left ventricular dysfunction in septic shock[J]. Clin Chem, 2000, 46(5): 650-657. |
| [13] |
Labugger R, Organ L, Collier C, et al. Extensive troponins I and T modification detected in serum from patients with AMI[J]. Circulation, 2000, 102: 1221-1226. DOI:10.1161/01.CIR.102.11.1221 |
| [14] |
万福生. 严重烧伤后心肌损害的研究进展[J]. 江西医学院学报, 2004, 44(4): 107-110. DOI:10.3969/j.issn.1000-2294.2004.04.048 |
| [15] |
Ando h, Takamura T, Ota T, et al. Cerivastatin improves survival of mice with lipopolysaccharid-induced sepsis[J]. J Pharmacol ExpTher, 2000, 294(3): 1043-1046. |
| [16] |
Knopp Rh. Drug treatment of lipid disorders[J]. N End J Med, 1999, 341(7): 498-511. |
| [17] |
Wright SD, Ramos RA, Tobias PS, et al. CD14, a receptor for complexes of lipopolysaccharide (LPS) and LPS binding protein[J]. Science, 1990, 249(4975): 1431-1433. DOI:10.1126/science.1698311 |
| [18] |
李文华, 宋志芳, 单慧敏. 乌司他丁对大鼠脓毒症肺损伤的保护作用[J]. 中华急诊医学杂志, 2007, 16(2): 132-137. DOI:10.3760/j.issn:1671-0282.2007.02.005 |
| [19] |
刑金燕, 韩小宁, 孙运波, 等. 乌司他丁对重度脓毒症患者淋巴细胞亚群的影响[J]. 中华急诊医学杂志, 2006, 5: 441-443. DOI:10.3760/j.issn:1671-0282.2006.05.016 |
| [20] |
Lekkou A, Karakantza M, Mouzaki. A cytokine productian and monocyte HLA-DR expression as predictors of outcome for patients withcommunity-acquired severe infections[J]. Clinical and giagnostic laboratory immunology, 2004, 11(1): 161-167. |
| [21] |
Meduri GU, Headley S, Tolley E, et al. Plasma and BAL cytokine response to corticosteroid rescue treatment in late ARDS[J]. Chest, 1995, 108(5): 1315-1325. |
| [22] |
Choudhury S, Kannan K, Addison MP, et al. Combined treatment with atorvastatin and imipenem improves survival and vascular functions in mouse model of sepsis[J]. Vascular pharmacology, 2015, 71: 139-150. DOI:10.1016/j.vph.2015.03.012 |
| [23] |
Coldewey SM, Thiemermann C. Pleiotropic effects of atorvastatin in experimental sepsis:Preservation of β1-adrenoreceptor signaling in the heart[J]. Shock, 2014, 41(5): 458-459. DOI:10.1097/SHK.0000000000000154 |
| [24] |
Thangamalai R, Kandasamy K, Sukumarn SV, et al. Atorvastatin prevents sepsis-induced downregulation of myocardial β1-adrenoceptors and decreased cAMP response in mice[J]. Shock, 2014, 41(5): 406-412. DOI:10.1097/SHK.0000000000000138 |
| [25] |
Buerke U, Carter J M, Schlitt A, et al. Apoptosis contributes to septic cardiomyopathy and is improved by simvastatin therapy[J]. Shock, 2008, 29(2): 497-503. |
| [26] |
Reis PA, Alexandre PCB, D'Avila JC, et al. Statins prevent cognitive impairment after sepsis by reverting neuroinflammation, and microcirculatory/endothelial dysfunction[J]. Brain, behavior, and immunity, 2017, 60: 293-303. DOI:10.1016/j.bbi.2016.11.006 |
| [27] |
普思权, 张勇洪. 普伐他汀对不稳定性心绞痛患者凝疑血纤溶活性和炎性细胞因子的影响[J]. 中山大学学报:医学科学版, 2006, 27(35): 104-106. |
| [28] |
黄爱蓉, 金益梅, 杨好妹. 血浆生长抑素水平测定在儿童脓毒症中的临床价值——附50例报告[J]. 新医学, 2009, 40(2): 99-101. DOI:10.3969/j.issn.0253-9802.2009.02.011 |
 2019, Vol. 3
2019, Vol. 3

