2. 湖南省急救医学研究所 急危重症代谢组学湖南省重点实验室;
3. 湖南省人民医院(湖南师范大学附属第一医院)急诊科
2. Hunan Provincial Institute of Emergency Medicine, Hunan Provincial Key Laboratory of Emergency and Critical Care Metabonomics;
3. Department of Emergency Medicine, The First Affiliated Hospital of Hunan Normal University(Hunan Provincial People's Hospital), Changsha, China
百草枯(PQ,parequat)是一种剧毒的季铵盐类除草剂,因其广谱性、非选择性且环境友好型的特点而被广泛用于农业[1]。经管如此,百草枯对动物及人类有相当大的毒性,研究表明,人口服百草枯致死量为30~40mg/kg, 病死率高达60%~80%[2]。因此,开展有必要开展百草枯中毒机制的研究。
代谢组学作为系统生物学新兴发展起来的一门技术,主要针对不同种类的低分子量(MW<1500Da)代谢物进行分析,反映了酶浓度、细胞调节、信号通路途径的控制、遗传变异、分解代谢和合成代谢的改变,可以整体分析机体在疾病过程中的代谢过程,能最直接地反映机体的表型、生理和分子状态,在系统生物学中发挥着重要的作用[3]。已有研究提示HPLC-MS/MS能够快速能快速、准确、可靠检测急诊百草枯中毒患者血浆的百草枯水平,对患者的治疗具有指导意义[4]。本研究旨在利用HPLC-Q-TOF-MS/MS技术对百草枯中毒大鼠的肺泡灌洗液进行检测,筛选出差异代谢物与相关代谢通路,为研究PQ中毒致肺损伤的作用机制以及治疗提供线索与方向。
资料和方法 一、百草枯致肺纤维化大鼠模型的建立SD大鼠,体重200~220g。将这些大鼠置于22.2℃、50%~60%湿度条件,12h/12h光照/黑暗暗循环的环境下,均可自由取水和饲料。适应三天后,将大鼠随机抽样,分为NC组和PQ组。PQ组大鼠一次性灌胃15mg/kg PQ后正常饲养至4周,进行肺泡灌洗液和肺组织的样本提取[5]。
二、HE和MASSON染色本实验收集各组老鼠的肺组织,每个肺组织在含有4%多聚甲醇的PBS溶液中固定,嵌入石蜡中,再切成4μm厚的玻片后进行HE与MASSON染色,最后让对实验细节不知情的病理学家在同等倍数(X200)的光镜下观察染色结果[6]。
三、样品上样前预处理取200ul肺泡灌洗液,加入600ul预冷(-20℃)的甲醇,涡旋混匀后,在-20℃冰箱放置1h。再在低温高速离心机中以4℃,14 000rpm条件下,离心15min。然后,转移上清至新的EP管中,放入-80℃超低温冷藏箱中保存或者直接上样。上样前,吸取200ul上清,用PTEF过滤至进样小瓶进样检测。
四、UPLC-Q-TOF-MS/MS检测(一)仪器条件
色谱条件:Acclaim TM RSLC120-C18色谱柱(100×2.1mm,2.2μm, 120A),柱温:30℃,流速:0.2mL/min,进样体积:15μL。。两种流动相是:A相为0.1%甲酸铵水溶液(含2mmol/L甲酸铵),B相为乙腈[7]。使用以下梯度洗脱程序,流速为2μL/ min:0.00→2.00min,98%→98% A;2.00min→12.00min,98%→50%A;12.00min→30.00min,50%→10% A;30.00min→35.00min,10%→98% A;B用于柱重新平衡,总色谱正常运行。
(二)质谱条件:电喷雾离子源ESI以正模式(ESI+)和负离子(ESI-)运行,离子喷射电压4 500V,终板偏移电压500V,干燥气:氮气,温度为200℃,气体流量为8.0L/min;MS/MS碰撞能量为20~50eV;质谱数据采集质荷比(m/z)范围为20至1 000,扫描时间为8.00Hz,扫描间延迟为0.1s。为避免可能的污染并保持信号稳定并确定精确分子量,在每个样品在进样前均使用甲酸钠溶液进行校正,以获得最佳准确度和重现性。
五、数据分析 (一) 数据提取将UPLC-Q-TOF-MS/MS检测出的数据导入布鲁克公司开发的Metaboscape 3.0版本分析软件,对所有样本进行峰值检测和对齐。在被识别和对齐后,我们将每个离子的强度用每个色谱图中的总离子总强度进行标准化。我们通过布鲁克公司自带的标准品数据库、下载的HMDB数据库以及在线搜索数据库对二级质谱图进行鉴定,得到相应的化合物。最后在三维矩阵信息中,包含保留时间(RT)、质荷比(m/z)、离子强度信息(变量)以及化合物名称。
(二) 数据的预处理及质量控制将提取出来的数据分别导入SIMCA-P 14.1软件、MetaboAnalyst 4.0软件中进行分析前预处理以及质量控制,具体操作如下:①MetaboAnalyst 4.0软件:将原始数据按照满足导入格式以及信息完整性原则进行格式修改后,导入此软件,再缺失值估算,最后进行数据归一化处理,最终所得数据便于接下来样本之间比较的统计学方法分析。②SIMCA-P 14.1软件:将原始数据按照满足导入格式以及信息完整性原则进行格式修改后,导入此软件,再缺失值估算,进行数据归一化处理,最后进行数据自动拟合,最终所得的数据可以进一步进行代谢组学分析,如PCA、PLS-DA。质量控制:两个软件数据预处理保持一致,缺失值估算均采用缺失值以最小正值的一半代替,数据归一化处理里均采用UV处理(一种常用数据缩放的数学方法,便于数据间的比较);用SIMCA-P 14.1软件在PLS-DA模式下进行拟合模型置换测试,防止数据过拟合。
(三) 统计学分析将仪器检测出来的代谢信息数据使用MetaboAnalyst 4.0软件经相关预处理后进做t检验、Fold Change分析,得出P值以及FC值。再将仪器检测出来的代谢信息数据导入SIMCA-P 14.1软件经相关预处理后进行PLS-DA分析,得出VIP值,以FC<0.8或者FC>1.2,VIP值>1,P值<0.05为条件筛选出差异代谢物,进而进行热图聚类分析。将这些差异代谢物通过MetaboAnalyst 4.0软件进行通路分析。
结果 一、百草枯致肺组织炎性细胞浸润和肺纤维化损伤如图 1所示,在相同倍数(×200)的显微镜下,肺组织的HE染色可以明显看出:相对于NC组,PQ组中部分正常肺泡结构消失,肺泡间隔明显增厚,肺组织充血和水肿,还有大量炎症细胞浸润到间质和肺泡,并出现成纤维细胞增生(图 1)。同时在MASSON染色中:相对于正常组,PQ组可见大量胶原沉积和明显的肺纤维化(图 1)。这些结果均表明,本研究动物模型建立成功,其中相对于NC组,PQ组发生了炎症反应和肺纤维化。
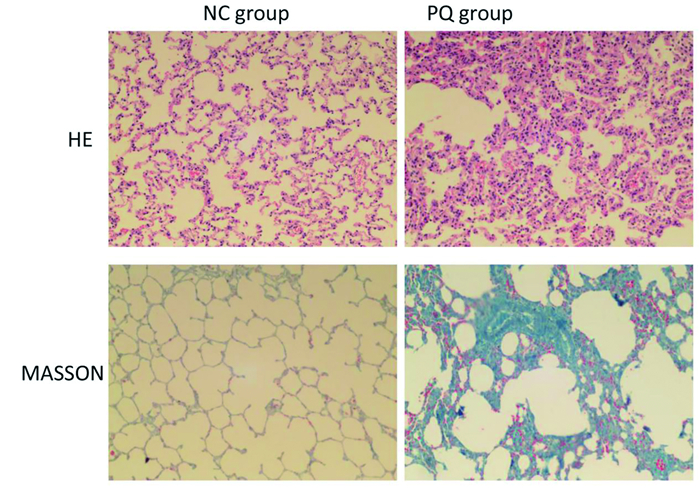
|
图 1 百草枯致大鼠肺损伤 |
通过布鲁克公司自带的标准品数据库、下载的HMDB数据库以及在线搜索数据库对二级质谱图进行鉴定,肺泡灌洗液共鉴定32个离子,将原始数据导出后用Origin2017版进行画图,得到如图 2所示的肺泡灌洗液样本总离子流图,从图中可以大致看出肺泡灌洗液各组间的代谢物特征基本相似,但部分离子峰存在差异,提示各组间部分代谢物可能存在差异。
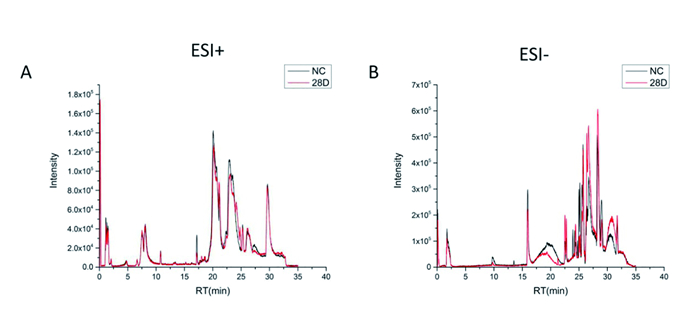
|
图 2 百草枯中毒大鼠肺泡灌洗液的正(A)负(B)离子总离子流图。NC代表对照组,28d代表百草枯染毒组(PQ组)。 |
将数据导入SMICA-P 14.1软件进行正负离子模式下的主成分分析(PCA),得到如图 3 A、C所示。结果显示虽然肺泡灌洗样本的NC组和PQ组之间分界线并不是很明显,组间部分有重叠,但仍能看出存在一定差异;两组之间完全分离,差异明显。为了能更直观的观察不同组之间的差异,我们进一步对数据进行偏最小二乘法(PLS-DA)分析,如图B所示:正负离子模式下的两组之间完全分离,提示组间代谢信息差异明显。另外,本模型经置换检验得到的R2Y和Q2都远低于右边的原始点,且所有置换的R2Y均低于实际数据1,Q2都低于0.4(图 3 E、F),表明模型并无过拟合现象,证明模型有效。
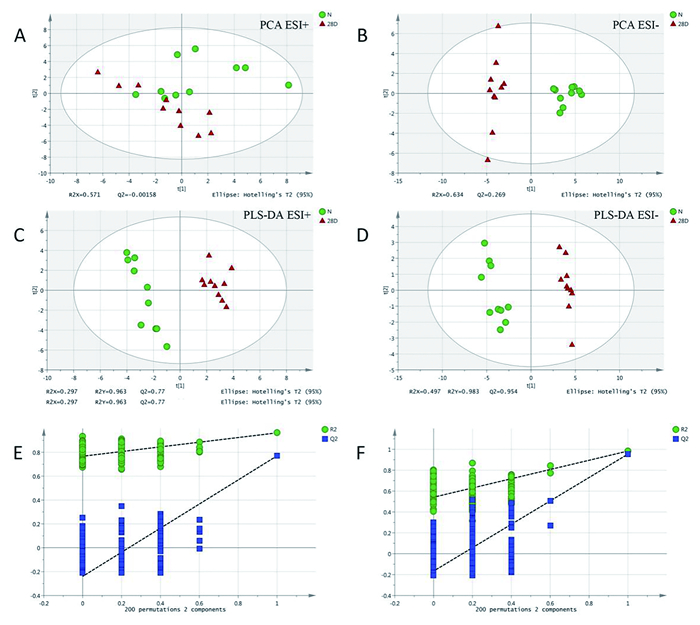
|
图 3 百草枯中毒大鼠肺泡灌洗液代谢轮廓的改变。百草枯中毒大鼠肺泡灌洗液中代谢物的PCA分析,A正离子模式下的PCA分析,B负离子模式下的PCA分析;百草枯中毒大鼠肺泡灌洗液中代谢物的PLS-DA分析,C、E分别是正离子模式下的PLS-DA分析和相应的置换检验,D、F分别是负离子模式下的PLS-DA分析和相应的置换检验。NC代表对照组,28d代表百草枯染毒组(PQ组)。 |
通过上述分析,我们明确了PQ与NC组间代谢轮廓存在显著性差异,将数据导入MetaboAnalyst 4.0,得出P值和FC值,再用SMICA-P 14.1软件,在PLS-DA模式下,分别算出肺组织和肺泡灌洗液样本的7D与NC组,PQ与NC组的差异权重贡献值(VIP),最后根据VIP值>1,P值<0.05,FC值<0.8或者>1.2,共筛选出差异代谢物L-谷氨酸等20种,如表 1所示。
| 表 1 百草枯中毒大鼠肺泡灌洗液中的差异代谢物 |
将上述肺泡灌洗液样本中PQ组和NC组比较得到的差异性代谢物导入MetaboAnalyst 4.0软件进行代谢通路分析,结果如图 4所示,根据Match Status≥2,-log(P)>2,Impact>0.1,筛选出筛选出丙氨酸/天冬氨酸/谷氨酸代谢通路、D-谷氨酰胺和D谷氨酸代谢通路、生物素代谢通路,可能与PQ中毒致大鼠肺损伤相关。
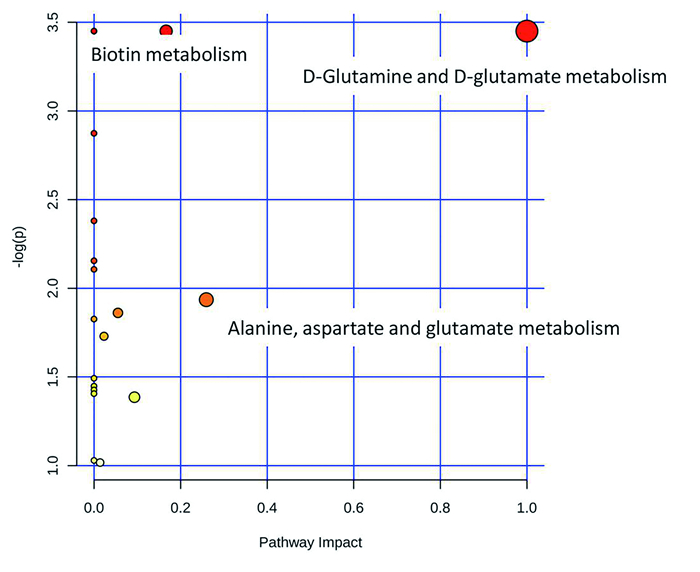
|
图 4 代谢通路分析 |
PQ被摄入后可造成体内多脏器功能损害[8],其中以肺纤维化和神经损害表现最常见。而PQ中毒中晚期主要表现为肺间质内大量纤维化生成[9],这与本研究HE和MASSON染色结果一致,说明本研究大鼠PQ中毒模型建立成功。
本研究采用UPLC-QTOF-MS/MS技术在肺泡灌洗液样品的PQ组与NC组比较中,筛选出了20种差异代谢物。本研究结果显示,其中VIP值最大的是溶血磷脂酰胆碱16:0(VIP=2.6143),与NC组相比,PQ组溶血磷脂酰胆碱16:0表达升高,差异具有统计学意义(P<0.05),而溶血磷脂酰胆碱是低密度脂蛋白(OX-LDL)的主要成分,某些种类的磷脂酰胆碱是炎症的重要生物标志物[10],磷脂代谢特征可以为炎症的诊断和预后提供有价值的证据,在炎症疾病中有重要作用,当浓度过高时会对细胞膜系统造成伤害[11]。氧自由基造成的直接损伤及成纤维细胞、炎性细胞造成的间接损伤可能是百草枯导致肺纤维化的主要原因[12]。由此表明PQ组发生了炎症发应,这同样与HE染色结果一致。
我们通过这些代谢物进一步得出丙氨酸/天冬氨酸和谷氨酸代谢、D-谷氨酰胺和D-谷氨酸代谢、生物素代谢这3条主要的代谢通路。前两条代谢通路属于氨基酸代谢。氨基酸在维持能量平衡方面发挥了重要作用,影响多种代谢和合成功能,包括蛋白质翻译、胰岛素信号转导[13, 14]。已有研究表明,在急性百草枯中毒后,许多氨基酸在代谢途中表达异常[15]。在本研究中氨基酸代谢紊乱主要涉及到丙氨酸、天冬氨酸、谷氨酸、D-谷氨酸。这些氨基酸代谢会调控机体自身严重损伤和感染后的氧化应激水平[16, 17],而氧化应激是PQ中毒后机体出现的首要反应。
综上所述,我们能够发现PQ中毒会改变大鼠体内20种代谢物,而这些差异代谢物与相关通路主要涉及到炎症和肺纤维化两种肺损伤,这为研究PQ中毒致肺损伤的病因和作用机制提供线索与方向。
| [1] |
Blanco-Ayala T, Anderica-Romero A C, Pedraza-Chaverri J. New insights into antioxidant strategies against paraquat toxicity[J]. Free radical research, 2014, 48(6): 623-640. DOI:10.3109/10715762.2014.899694 |
| [2] |
李海军, 赵兴勤, 谷琳琳, 等. 急性百草枯中毒的研究和治疗进展[J]. 医学综述, 2012, 18(2): 264-266. DOI:10.3969/j.issn.1006-2084.2012.02.037 |
| [3] |
Wojakowska A, Chekan M, Widlak P, et al. Application of metabolomics in thyroid cancer research[J]. Int J Endocrinol, 2015, 2015: 258763. |
| [4] |
艾娇, 樊晶, 陈维. HPLC-MS/MS检测急性百草枯中毒患者血浆的方法及意义[J]. 检验医学与临床, 2019, 17: 2478-2481. DOI:10.3969/j.issn.1672-9455.2019.17.015 |
| [5] |
Tuncer SK, Altinel S, et al. Poly-ADP-ribose polymerase inhibition provides protection against lung injury in a rat paraquat toxicity model[J]. Inflammopharmacology, 2016, 24(4): 155-161. DOI:10.1007/s10787-016-0268-1 |
| [6] |
Tang X, Li W, Wen X, et al. Transplantation of dental tissue-derived mesenchymal stem cells ameliorates nephritis in lupus mice[J]. Ann Transl Med, 2019, 7(7): 132. DOI:10.21037/atm.2019.02.41 |
| [7] |
Wang H, Liang S, Wang M, et al. Potential serum biomarkers from a metabolomics study of autism[J]. Journal of Psychiatry & Neuroscience Jpn, 2016, 41(1): 27-37. |
| [8] |
Bhardwaj N, Saxena R K. Elimination of young erythrocytes from blood circulation and altered erythropoietic patterns during paraquat induced anemic phase in mice[J]. PloS one, 2014, 9(6): e99364. DOI:10.1371/journal.pone.0099364 |
| [9] |
Kobayashi N, Takezaki S, Kobayashi I, et al. Clinical and laboratory features of fatal rapidly progressive interstitial lung disease associated with juvenile dermatomyositis[J]. Rheumatology, 2015, 54(5): 784-791. DOI:10.1093/rheumatology/keu385 |
| [10] |
Wu X, Cao H, Zhao L, et al. Metabolomic analysis of glycerophospholipid signatures of inflammation treated with non-steroidal anti-inflammatory drugs-induced-RAW264.7 cells using(1)H NMR and U-HPLC/Q-TOF-MS[J]. Journal of Chromatography B, 2016, 1028: 199-215. DOI:10.1016/j.jchromb.2016.06.032 |
| [11] |
苏联麟, 李平, 程雪, 等. 基于UPLC-Q/TOF-MS的醋制五味子对酒精性肝损伤大鼠胆汁代谢物的影响研究[J]. 中草药, 2017, 48(1): 114-120. |
| [12] |
张菊, 谢席胜. 百草枯中毒致肺纤维化机制的研究进展[J]. 中华劳动卫生职业病杂志, 2016, 34(3): 239-241. DOI:10.3760/cma.j.issn.1001-9391.2016.03.023 |
| [13] |
Jewell JL, Russell RC, Guan K L. Amino acid signalling upstream of mTOR[J]. Nature Reviews Molecular Cell Biology, 2013, 14(3): 133-139. DOI:10.1038/nrm3522 |
| [14] |
Lynch CJ, Adams SH. Branched-chain amino acids in metabolic signalling and insμLin resistance[J]. Nat Rev Endocrinol, 2014, 10: 723-736. DOI:10.1038/nrendo.2014.171 |
| [15] |
Wan X, Zhou C, Kang X, et al. Metabolic Profiling of Amino Acids Associated with Mortality in Patients with Acute Paraquat Poisoning[J]. Medical science monitor:international medical journal of experimental and clinical research, 2018, 24: 1397-1407. |
| [16] |
Longxiang S, Hua L, Aimei X, et al. Dynamic Changes in Amino Acid Concentration Profiles in Patients with Sepsis[J]. PLoS One, 2015, 10(4): e0121933. DOI:10.1371/journal.pone.0121933 |
| [17] |
Mattick JSA, Kamisoglu K, Ierapetritou MG, et al. Branched-chain amino acid supplementation:impact on signaling and relevance to critical illness[J]. Wiley Interdisciplinary Reviews:Systems Biology and Medicine, 2013, 5(4): 449-460. DOI:10.1002/wsbm.1219 |
 2019, Vol. 3
2019, Vol. 3

