2. 湖南省人民医院(湖南师范大学附属第一医院), 湖南省急救医学研究所
2. Hunan Provincial Institute of Emergency Medicine; The First Affiliated Hospital of Hunan Normal University(Hunan Provincial People's Hospital), Changsha, China
氧化应激是导致动脉粥样硬化斑块形成和破裂的重要病理生理过程,是引起急性心肌梗死(Acute myocardial infarction, AMI)的重要病理学基础。临床上,随着介入心脏病学和经皮冠状动脉成形术治疗的发展,可以快速有效地恢复缺血区域的血流,显著降低了AMI死亡率、发病率和并发症[1]。但矛盾的是,缺血区的恢复血供导致心肌细胞氧化应激反应,引起大量活性氧(Reactive Oxygen Species,ROS)的蓄积,继而ROS对生物分子产生快速和严重的损害,这种现象称为心肌缺血再灌注(Ischemic Reperfusion, I/R)损伤[2]。因此,如何减轻心肌I/R诱导的氧化应激损伤是AMI的重要治疗策略。
对氧磷酶-1(Paraoxonase-1, PON-1)是在肝脏中合成的具有芳基酯酶和对氧磷酶活性的血清酯酶,与高密度脂蛋白(high density lipoproteins, HDL)紧密结合。PON-1是维系HDL结构完整性和抗氧化功能的重要结构基础[3, 4]。血清低PON1活性可作为评估冠心病事件发生及严重程度的独立危险因素[5]。有研究证明,PON-1可通过抑制细胞因子如肿瘤坏死因α (TNF-α),白细胞介素-1(IL-1)和白细胞介素-6(IL-6)的扩散发挥抗氧化和抗炎的作用[6, 7]。Mackness等研究发现,PON1基因敲除小鼠体内氧化低密度脂蛋白(oxidative low density lipoprotein,ox-LDL)升高,血管壁动脉粥化的敏感性增高;而PON1高表达的转基因小鼠增强了其HDL抗氧化能力,明显降低动脉壁炎症状态及斑块形成及稳定性[8]。Kulah等在缺血再灌注损伤的大鼠肾模型中发现,大量的ox-LDL堆积在肾组织中,同时PON-1水平降低[9]。以上研究表明PON-1能够抵抗氧化应激损伤,但目前PON-1在心肌缺血再灌注损伤中的作用尚不清楚。本研究目的拟探讨PON-1是否通过改善心肌细胞的氧化还原状态从而对心肌缺血再灌注损伤产生保护作用。
资料和方法 一、主要试剂HSPB1抗体(ADI-SPA-801-D)购于Enzo公司;Glutathione reductase recycling检测试剂盒购于Cayman公司;Lipofectamine RNAiMAX(13778150)试剂购于Thermo Fisher公司;MTT细胞毒性检测试剂盒和LDH检测试剂盒购于碧云天。
二、细胞培养H9c2细胞在Dulbecco改良的Eagle培养基(含10%胎牛血清,100U/ml青霉素和100μg/ mL链霉素)于5%CO2,恒温37℃的细胞培养箱中孵育24h。用1mM PON-1预处理30min,用0.75mM H2O2处理不同时间后,收获细胞用于检测分析。
三、MTT检测收集处理好的H9c2细胞,加入PBS洗涤2~3次,每个孔加100 μl新培基和10μl MTT (5mg/mL),再继续培养4h。小心吸出所有培基,每个孔加150μl DMSO,在摇床上低速振荡10min,使蓝紫色结晶物全部溶解,测定490nm波长处各孔的吸光值。设置调零孔(含培基、MTT、DMSO,不加细胞),根据吸光值计算细胞存活率,并绘制细胞生长曲线。
四、LDH水平的检测H9c2细胞中加入基质缓冲液50ul和辅酶溶液10ul,轻轻混匀,37 ℃,孵育15min;孵育完成后,加入2,4-二硝基苯溶液50ul,充分混匀,37 ℃,孵育15min;加入0.4 mol/ L NaOH 500ul,酶标仪440nm处读取吸光度值。
五、GSH和GSSG检测H9c2细胞1×MES buffer,4℃,10 000g离心15min;在上清液中加入MPA试剂(MPA与上清液体积1:1混合;用来去除蛋白质)振荡混匀,常温下放置5min后,4℃,2 000g离心2min;在上清液中加入TEAM试剂(TEAM与上清液体积1:20混合)振荡混匀;配制检测的混合物:混合物:标准品(或样品)= 150ul:50ul(3:1);用排枪向96孔板中的每个标准品和样品各加入90ul的混合物后,加盖避光在摇床上混匀5~10 min。用酶标仪每5min检测一次,共30min,波长为405~414nm。
六、Western-blot检测将H9c2细胞用用冰PBS洗涤两次后,1×SDS Buffer裂解液(含罗氏蛋白酶抑制剂)提取细胞蛋白质。用RARP抗体、Caspase3抗体、HSPB1抗体和Actin或GAPDH抗体按照说明书建议浓度配置好一抗,4℃孵育轻摇过夜;常温孵育二抗2h。用ECL发光仪检测蛋白质的表达情况。
七、统计学方法数据表示采用均数±标准误(mean±SEM);采用GraphPad Prism 6软件分别进行数据分析和图表绘制。根据数据资料类型选择统计学方法:两组均数比较,两总体方差相等时,选用成组t检验。方差不齐时,采Cochran&Cox近似t检验。对于多组组间两两比较,采用Tukey检验和单项方差分析。所有统计学分析以P<0.05判定为差异具有统计学意义。
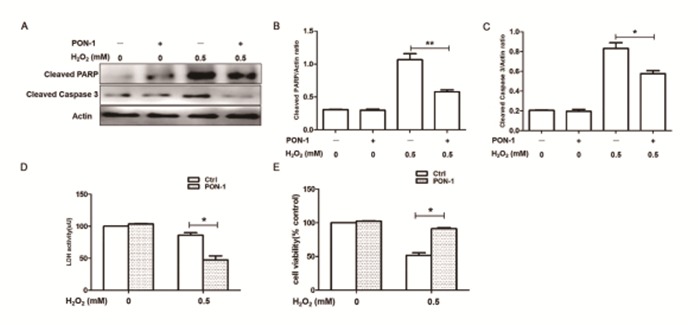
结果 一、PON-1对H2O2诱导H9c2细胞氧化应激损伤的影响为了探讨PON-1是否影响心肌氧化应激损伤,我们首先用PON-1预处理H9c2细胞30min后,0.5mM H2O2诱导细胞氧化应激损伤。然后采用MTT法测量细胞的活性,并检测细胞上清的乳酸脱氢酶(LDH)水平以及细胞中聚A核糖聚合酶(poly-ADP-ribose polymerase,PARP)和凋亡蛋白酶-3(Caspase3)的剪切。研究结果显示,PON-1能够抑制H2O2诱导的PARP和Caspase3蛋白的剪切(图 1A-C),减少乳酸脱氢酶的释放(图 1D),提高氧化应激时H9c2细胞的存活率(图 1E)(*P<0.05;**P<0.01;***P<0.001)。以上这些结果证明,PON-1对H9c2细胞氧化应激损伤有保护作用。
|
图 1 PON-1减轻H2O2诱导的H9c2细胞损伤(n>6,*P<0.05;**P<0.01;***P<0.001) |
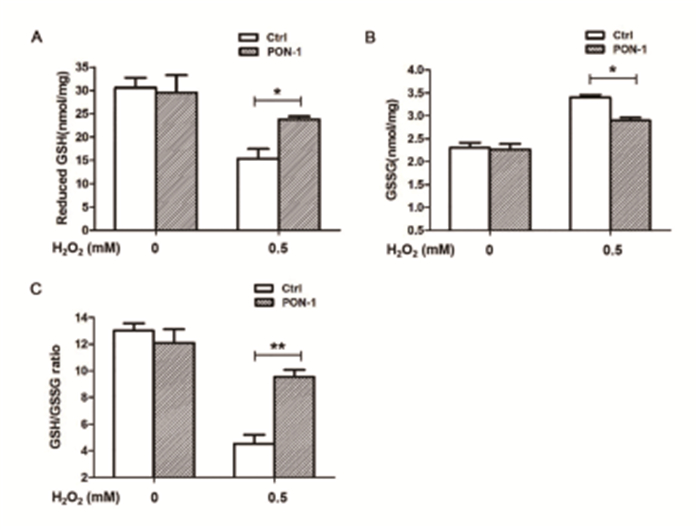
为了阐明PON-1抗氧化损伤作用的机制,我们接下来观察PON-1对心肌细胞氧化应激中主要氧化还原调节剂谷胱甘肽(Glutathione, GSH)水平的影响。在H9c2细胞中,用PON-1预处理细胞30min后,0.5mM H2O2处理细胞24h,采用GSH测量试剂盒检测细胞内总GSH和GSSG的含量,用总GSH和GSSG的值计算还原型GSH的水平。图 2表明,PON-1提高了还原型GSH水平(图 2A),GSSG水平明显降低(图 2B),还原型GSH/GSSG比值显著降低(图 2C,*P<0.05;**P<0.001)。这些结果表明,PON-1参与调节细胞内氧化还原状态,与改善GSH抗氧化通路的氧化还原状态有关。
|
图 2 PON-1维持氧化应激时细胞内的还原水平(n>6,*P<0.05;**P<0.01) |
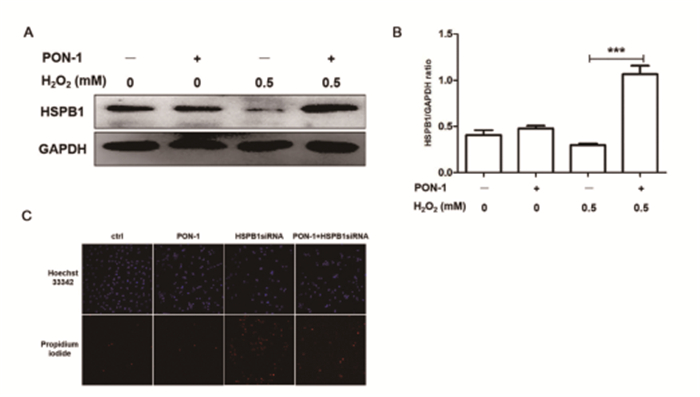
小分子热休克蛋白B1(Small Heat Shock Protein 1,HSPB1)在心肌细胞表达比较丰富,在抵抗氧化应激损伤的中有重要作用[10]。我们研究已经证明,在心肌细胞氧化应激损伤时,HSPB1通过维持胞浆中GSH抗氧化通路的还原功能,维持细胞胞浆的还原状态,减少细胞凋亡[11]。我们以上结果证明PON-1也能够改善GSH的氧化还原状态,因此,我们考虑PON-1是否通过HSPB1实现抗氧化应激损伤的功能。我们首先观察PON-1在H2O2诱导的H9c2细胞氧化应激时,对HSPB1蛋白质表达的影响。如图 3A, B所示,与H2O2单独处理组比较,PON-1预处理后,HSPB1表达明显增高(***P<0.001)。
|
图 3 PON-1上调HSPB1的表达(n>6,***P<0.001) |
为了进一步证实PON-1通过HSPB1来发挥抗氧化的功能,我们用HSPB1siRNA干扰HSPB1表达后,PI染色观察PON-1对细胞凋亡的影响。如图 3C所示,HSPB1siRNA单独处理组,细胞凋亡显著增加;而HSPB1siRNA和PON-1双处理组并没有明显改善细胞的凋亡。以上研究结果表明,PON-1能够通过上调HSPB1的表达维持细胞GSH抗氧化途径的还原功能,减轻H2O2诱导的心肌细胞氧化应激损伤。
讨论心肌I/R常见于体外循环下行开心直视手术、心脏移植、冠状动脉搭桥术、经皮腔内冠状动脉血管成形术和心肌梗塞溶栓治疗等,它的发生机制主要涉及ROS增多、钙超载、线粒体通透性转换孔开放、能量代谢障碍、白细胞活化和浸润、炎症反应等方面[2]。近年来的研究也表明血清PON-1活性与冠心病、心肌梗塞、糖尿病等动脉硬化性相关疾病的发病机制有关[12, 13]。本研究显示,在过氧化氢诱导的氧化应激损伤的H9c2细胞中,PON-1可降低ROS和GSSG的产生,增加还原型GSH和GSH/GSSG比值,减轻氧化应激损伤和减少细胞凋亡,这与PON-1增加HSPB1表达有关。
PON-1是对氧磷酶家族中成员之一,相对分子量为43~45 kDa,与血液循环中中HDL紧密结合的钙依赖性酯酶。PON-1的空间结构呈六叶螺旋体状,螺旋体的中央通道可结合2个钙离子,分别维系PON-1的结构稳定性及催化活性;螺旋结构的顶部有3个α-单环,其中2个单环在活性位点上形成1个独特的帽子结构,使PON-1准确地与细胞膜或与HDL结合[14]。Tavori等研究发现,PON-1的第284位半胱氨酸(Cys284)的游离巯基可能是其抗氧化酶活性的关键位点[15]。本研究已经证实,在氧化应激损伤的心肌细胞中,PON-1能够维持GSH抗氧化通路的还原功能,我们推测这可能与PON-1的Cys284有关。因此,我们目前的研究是通过非还原免疫变性分析法检测PON-1在氧化应激损伤时,PON-1的氧化应激状态的改变,进一步揭示PON-1在急性心血管事件中的作用机制。
HSPB1普遍表达于人体组织中的小分子热休克蛋白,尤其在成年心肌细胞中表达最丰富[16],在细胞适应氧化应激和抗凋亡中有重要的作用[17, 18]。HSPB1可抵抗肿瘤坏死因子α和紫外线诱导的非心肌源性细胞的损伤[19]。刘莉等发现,HSPB1可显著抑制H2O2介导的大鼠心肌细胞急性损伤和凋亡;同时,HSPB1高表达可通过稳定线粒体膜和减少ROS的产生,抵抗氧化应激诱导的心肌心态学变化[20, 21]。氧化应激损伤时,HSPB1减少了细胞内ROS和一氧化氮(nitric oxide,NO)水平;通过维持还原型GSH水平,从而稳定了线粒体膜电位(ΔΦm)[22, 23]。此外,HSPB1巩固了通过降低细胞内铁水平细胞内氧化还原稳态[24]。周齐艳等研究发现,急性冠状动脉综合征(acute coronary syndromes, ACS)患者的血清PON-1活性与疾病的严重程度呈负相关[25]。PON-1能将脂质过氧化物分解成羧酸和乙醇,继而降低脂蛋白的氧化修饰,在这个过程中需要血小板活化因子-乙酰水解酶的协调。Reddy等综述报道,在急性心肌损伤的情况下,HSPB1可分泌至细胞外质,血清和脑脊液中,且外泌性HSPB1可激活免疫细胞发挥抗炎作用。有趣的是,外泌性HSPB1也可发挥抗血小板反应的作用,同时也会增强HSPB1抗氧化的功能[26]。基于我们研究结果已经证实PON-1可通过HSPB1的表达,我们推测在急性心血管事件中,PON-1与HSPB1均可作为重要的分子标记物。
总之,本研究发现PON-1可通过HSPB1发挥抗氧化的功能,减轻心肌氧化应激损伤。本研究仅仅基于基础研究,但PON-1主要表达在HDL的表面,且HSPB1也可以分泌至血清中黏附于血小板,因此,进一步在急性心血管疾病患者血清中观察二者的变化,有更重要的临床意义。PON-1和HSPB1有可能成为急性心血管疾病氧化应激严重程度的指标,为急性心血管疾病提高新的治疗靶点。
| [1] |
Bainey KR, Armstrong PW. Clinical perspectives on reperfusion injury in acute myocardial infarction[J]. Am Heart J, 2014, 167: 637-645. DOI:10.1016/j.ahj.2014.01.015 |
| [2] |
Hausenloy DJ, Yellon DM. Myocardial ischemia-reperfusion injury:a neglected therapeutic target[J]. J Clin Invest, 2013, 123: 92-100. DOI:10.1172/JCI62874 |
| [3] |
Mackness M, Mackness B. Targeting paraoxonase-1 in atherosclerosis[J]. Expert Opin Ther Targets, 2013, 17(7): 829-837. DOI:10.1517/14728222.2013.790367 |
| [4] |
Legro RS. Polycsytic ovary syndrome and cardiovascular disease:a premature association?[J]. Endocrine Review, 2003, 24: 302-312. DOI:10.1210/er.2003-0004 |
| [5] |
Zhou C, Cao J, Shang L, et al. Reduced paraoxonase 1 activity as a marker for severe coronary artery disease[J]. Dis Markers, 2013, 35(2): 97-103. |
| [6] |
Mackness B, Mackness MI, Arrol S, et al. Effect of the human serum paraoxonase 55 and 192 genetic polymorphisms on the protection by high density lipoprotein against low density lipoprotein oxidative modification[J]. FEBS Letters, 1998, 423: 57-60. DOI:10.1016/S0014-5793(98)00064-7 |
| [7] |
Ferretti G, Bacchetti T, Moroni C, et al. Paraoxonase activity in high-density lipoproteins:a comparison between healthy and obese females[J]. The Journal of Clinical Endocrinology Metabolism, 2005, 90: 1728-1733. DOI:10.1210/jc.2004-0486 |
| [8] |
Mackness B, Quarck R, Verreth W, et al. Human paraoxonase-overexpression inhibits atherosclerosis in a mouse model of metabolic syndrome[J]. Arterioscler Thromb Vasc Biol, 2006, 26(7): 1545-1550. DOI:10.1161/01.ATV.0000222924.62641.aa |
| [9] |
Kulah E, Tascilar O, Acikgoz S, et al. Oxidized LDL accumulation in experimental renal ischemia reperfusion injury model[J]. Ren Fail, 2007, 29(4): 409-415. DOI:10.1080/08860220701274975 |
| [10] |
Terra LF, Wailemann RAM, Dos Santos AF, et al. Heat shock protein B1 is a key mediator of prolactin-induced beta-cell cytoprotection against oxidative stress[J]. Free Radic Biol Med, 2019, 134: 394-405. DOI:10.1016/j.freeradbiomed.2019.01.023 |
| [11] |
Xiehong Liu, Ke Liu, Caiyan Li, et al. Heat-shock protein B1 upholds the cytoplasm reduced state to inhibit activation of the Hippo pathway in H9c2 cells[J]. J Cell Physiol, 2019, 234: 5117-5133. DOI:10.1002/jcp.27322 |
| [12] |
Trpkovic A, Resanovic I, Stanimirovic J, et al. Oxidized low-density lipoprotein as a biomarker of cardiovascular diseases[J]. Crit Rev Clin Lab Sci, 2015, 52(2): 70-85. DOI:10.3109/10408363.2014.992063 |
| [13] |
Peng Shao, Dajun Qu, Ruiying Song, et al. Association between PON1 L55M polymorphism and ischemic stroke:a systematic review and meta-analysis[J]. Int J Clin Exp Med, 2015, 8(3): 3429-3437. |
| [14] |
Gugliucci A, Menini T. Paraoxonase 1 and HDL maturation[J]. Clin Chim Acta, 2015, 439: 5-13. DOI:10.1016/j.cca.2014.09.016 |
| [15] |
Tavori H, Aviram M, Khatib S, et al. Human carotid lesion linoleic acid hydroperoxide inhibits paraoxonase 1(PON-1) activity via reaction with PON-1 free sulfhydryl cysteine 284[J]. Free Radic Biol Med, 2011, 50(1): 148-156. DOI:10.1016/j.freeradbiomed.2010.10.708 |
| [16] |
Mymrikov EV, Seit-Nebi AS, Gusev NB. Large potentials of small heat shock proteins[J]. Physiological Reviews, 2011, 91: 1123-1159. DOI:10.1152/physrev.00023.2010 |
| [17] |
Arrigo AP. Hsp27:novel regulator of intracellular redox state[J]. IUBMB Life, 2001, 52: 303-307. DOI:10.1080/152165401317291156 |
| [18] |
Simon S, Dimitrova V, Gibert B, et al. Analysis of the dominant effects mediated by wild type or R120G mutant of alphaB-crystallin (HspB5) towards Hsp27(HspB1)[J]. PLoS One, 2013, 8: e70545. DOI:10.1371/journal.pone.0070545 |
| [19] |
Pallock M, Phaneuf S, Dirks A, et al. The role of HSPB1 in regulation apoptosis[J]. Apoptosis, 2003, 8: 61-70. DOI:10.1023/A:1021601103096 |
| [20] |
刘莉, 张小进, 陈蕴琳, 等. 人心肌热休克蛋白27基因克隆及其高表达对大鼠心肌细胞氧化损伤的保护作用[J]. 中华老年医学杂志, 2004, 23: 879-882. DOI:10.3760/j:issn:0254-9026.2004.12.011 |
| [21] |
刘莉, 姜苏蓉, 张小进, 等. 热休克蛋白B1对大鼠心肌细胞氧化应激性损伤的作用[J]. 中华老年医学杂志, 2006, 25: 371-374. DOI:10.3760/j:issn:0254-9026.2006.05.017 |
| [22] |
Hanschmann EM, Godoy JR, Berndt C, et al. Thioredoxins, glutaredoxins, and peroxiredoxins-molecular mechanisms and health significance:from cofactors to antioxidants to redox signaling[J]. Antioxidants & Redox Signaling, 2013, 19: 1539-1577. |
| [23] |
Liu S, Li J, Tao Y, et al. Small heat shock protein alphaB-crystallin binds to p53 to sequester its translocation to mitochondria during hydrogen peroxide-induced apoptosis[J]. Biochem Biophys Res Commun, 2007, 354(1): 109-114. DOI:10.1016/j.bbrc.2006.12.152 |
| [24] |
Arrigo AP, Virot S, Chaufour S, et al. Hsp27 consolidates intracellular redox homeostasis by upholding glutathione in its reduced form and by decreasing iron intracellular levels[J]. Antioxidants & Redox Signaling, 2005, 7: 414-422. |
| [25] |
周齐艳, 周娟, 蒋恒波. 急性冠状动脉综合征患者血清对氧磷酶1的活性及其临床意义[J]. 重庆医学, 2015, 36(44): 5119-5121. |
| [26] |
Reddy VS, Madala SK, Trinath J, Reddy GB. Extracellular small heat shock proteins:exosomal biogenesis and function[J]. Cell Stress Chaperones, 2018, 23(3): 441-454. DOI:10.1007/s12192-017-0856-z |
 2019, Vol. 3
2019, Vol. 3

