降钙素原(procalcitonin, PCT)是机体在全身炎症反应特别是细菌感染时释放的一种急性可溶性蛋白,是严重细菌感染和脓毒症的早期诊断标志物。近年来,血清PCT检测和临床应用已获得世界范围认同,广泛应用于感染性疾病的诊断与病情动态监测。临床实践中,即使是非常有经验的儿科医生,对于区分感染性质及程度仍是一个巨大挑战,尤其在早期诊断和抗菌药物应用上难以选择,甚至导致抗菌药物的滥用。正确掌握和规范血清PCT在儿科感染性疾病的临床应用具有十分重要的意义,为此,中华医学会儿科学分会医院感染控制专委会组织专家在综合大量国内外文献,特别是多中心研究的基础上,通过1年多时间共4轮讨论后制定本专家共识,目的是使儿科医师科学合理应用血清PCT检测,指导临床诊断和治疗。
一、PCT的生物学特征PCT是降钙素的前体物质,由114~116个氨基酸组成,是一种无激素活性糖蛋白,主要由神经内分泌细胞(包括甲状腺、肺和胰腺组织细胞)表达,经酶切分解为降钙素、羧基端肽和氨基端肽。PCT是一种免疫活性蛋白,其生物活性包括免疫调节和调节血管收缩等。PCT在人体内稳定性好,血清中浓度极低,半衰期为20~24h,血清PCT浓度常 < 0.1μg/L[1]。
微生物感染诱导11号染色体上CALC-Ⅰ基因表达普遍增加,促使肝脏巨噬细胞和单核细胞、肺及肠道组织淋巴细胞及内分泌细胞大量合成分泌PCT,尤其是在严重细菌感染或脓毒症时,PCT可以快速且特异性升高。在动物试验中,注射内毒素2h后血清PCT即可在血中被检测到,6h后显著上升,约12h达到高峰,2~3d下降至正常[2~3]。血清PCT升高常与疾病严重性和病死率相关,严重感染时血清PCT浓度可增至100μg/L甚至达到1 000μg/L,而在有效抗菌药物治疗后可迅速下降[4]。
建议一:血清PCT是早期、严重、侵袭性细菌感染的标志物,作为儿童细菌性感染疾病现有的可靠诊断指标,还可用于判断预后和指导抗菌药物应用;可作为判断感染性质的辅助检测,也可以与白细胞计数(WBC)、C反应蛋白(CRP)、白细胞介素6(IL-6)等联合应用,提高敏感度和特异度。
二、血清PCT检测用于细菌感染早期诊断1993年,法国学者Assicot等首先提出PCT可作为细菌感染标志物[5]。细菌感染时,机体释放的细胞因子促使PCT升高; 相反,病毒感染时,机体释放的干扰素γ将阻断PCT的产生。因此,血清PCT可用于临床细菌感染判断,且比CRP更具特异性[6~8],2013年一项Meta分析显示,血清PCT对脓毒症的早期识别灵敏度为77%,特异度79%[9]。
1.儿童脓毒症:血清PCT作为目前儿童全身严重细菌感染的最佳早期诊断标志物,灵敏度和特异度均较高,比CRP更具有可靠性。儿科重症监护病房(PICU)患儿入院第一天血清PCT > 2μg/L,提示发展为严重脓毒症或脓毒性休克的风险更高。由于脂多糖是革兰阴性菌(G-菌)细胞外膜的主要组成成分,诱导产生大量PCT,故血清PCT对于G-菌败血症具有更高特异度,且G-菌感染PCT水平显著高于革兰阳性菌(G+菌)感染[10]。如果血清PCT水平低,但患儿具有脓毒症临床症状,也应开始抗菌药物治疗,并应动态监测血清PCT直到明确诊断。诊断脓毒症时,血清PCT最佳截断值(cut-off值)为2μg/L。
建议二:血清PCT > 2μg/L时,高度怀疑全身细菌感染,尤其是G-菌感染,需考虑脓毒症并提示病情严重,提示临床医师及时将患儿收住PICU治疗,指导早期经验性抗菌药物选择与应用。
2.社区获得性肺炎(CAP):CAP的病原多样,包括细菌、病毒、非典型病原体和真菌等。研究显示血清PCT在区分细菌感染与病毒或支原体感染时具有更高的特异度和灵敏度[11],但在细菌性肺炎中血清PCT并不一定都升高[12~13],约50%的细菌性肺炎患者血清PCT < 0.5μg/L,故血清PCT正常或轻度增高不能排除细菌性肺炎。但低浓度血清PCT常提示低风险,预示较低的病死率[14~15]。
3.细菌性脑膜炎:细菌性脑膜炎患儿血清PCT浓度较病毒性感染时明显增高,通常 > 0.5μg/L,具有高灵敏度(95%~99%)和特异度(83%~97%),建议早期检测并积极给予抗菌药物治疗[16~17],早期诊断和有效抗菌药物治疗决定疾病的进展和预后。由于存在假阴性结果及局灶性细菌感染时PCT可以不升高,不能单纯以血清PCT阴性排除细菌性脑膜炎。脑膜炎球菌感染时,血清PCT > 10 μg/L常提示高病死率和高器官损害风险[18~19]。
4.细菌性心内膜炎:细菌性心内膜炎时血清PCT常有升高,但并不是其诊断的金指标[20]。对于伴有心脏疾病相关危险因素(如心脏瓣膜病变、心脏瓣膜置换术后、免疫力低下等)的患儿,当血清PCT升高而无任何其他疾病特异性临床症状时,需考虑诊断。研究发现,对于细菌性心内膜炎患儿,血清PCT > 0.5 μg/L时提示预后不良,其灵敏度为73%,特异度79%[21]。
5.泌尿系统感染:血清PCT检测有助于区分下尿路感染与急性肾盂肾炎[22]。伴有肾盂变化或膀胱输尿管反流的尿路感染患儿血清PCT水平比单纯尿路感染高;低水平血清PCT提示肾脏瘢痕形成风险较低,说明血清PCT与肾损害之间存在显著相关性[23~25]。泌尿系感染患儿血清PCT界值可能在0.5和1.0μg/L之间。同时,血清PCT < 0.25μg/L的泌尿系感染患儿较少存在严重反流现象[26]。
建议三:血清PCT > 0.5μg/L时,应当根据儿童不同器官系统的感染特征,结合临床表现,积极明确感染的存在,如CAP、细菌性脑膜炎、细菌性心内膜炎、泌尿系统感染等。但血清PCT正常或 < 0.5μg/L时,不能作为排除诊断的标准。
三、血清PCT检测用于鉴别疾病健康人血浆中PCT含量极少(< 0.1μg/L),稳定性好。细菌感染、真菌感染、病毒感染、寄生虫感染患儿血清PCT可有不同程度升高,特别是对全身细菌感染的诊断和排除均具有良好的灵敏度和特异度,可区分细菌感染和非细菌感染,而对无菌性炎症反应、肿瘤或自身免疫性疾病无反应或仅有轻度反应,故对儿科感染性疾病鉴别和临床思维具有很强的指导性。当然,临床诊断必须谨慎结合病史、体格检查和微生物评估等全面阐释试验结果。其鉴别诊断程序如图 1。
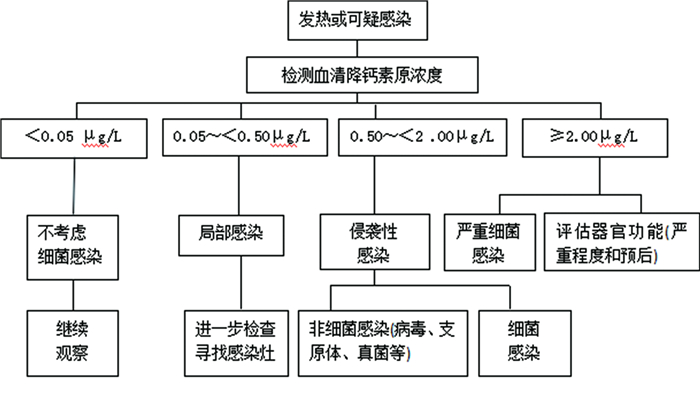
|
图 1 血清降钙素原用于感染相关疾病鉴别诊断程序图 |
1.局部感染:局部细菌感染或细菌定植通常不会诱导PCT的产生,如扁桃体炎、轻度软组织感染、脓肿、局部脑室引流感染,甚至单纯性阑尾炎或胆囊炎等。因此,血清PCT不能用于诊断局部感染[27~28]。低血清PCT水平患者死于器官功能障碍、脓毒症的风险非常低。
2.病毒感染:病毒感染性疾病包括肠道病毒、乙型脑炎病毒、腺病毒、呼吸道合胞病毒、流感病毒及副流感病毒感染等,血清PCT多不升高或仅稍有升高。严重病毒感染时可能出现血清PCT升高,但多不超过2ug/L[29~30]。
3.真菌感染:局灶性真菌感染或轻症真菌感染血清PCT很少升高;在侵袭性真菌感染时可升高[31~32],血清PCT居高不下或进行性增高提示预后不良[33]。
4.医院感染:对于呼吸机相关肺炎等院内感染性疾病,如治疗后数天内血清PCT快速下降提示预后较好[34]。对于术后存在持续高浓度血清PCT的患儿需考虑术后感染可能[35]。对于重症监护的危重患儿,有院内感染风险患儿,如接受长期机械通气、留置静脉或动脉导管、免疫抑制状态(肿瘤、器官移植、化疗、中性粒细胞减少等)、手术或创伤、烧伤等,建议动态监测PCT。在中性粒细胞减少合并感染时,由于血清PCT的诱导受到抑制可升高不明显,但与CRP相比较,血清PCT具有相对较高的特异度,其峰值通常出现在感染发生24h后,延迟或动态的血清PCT监测常能为临床提供更多的诊断信息[36]。
5.非感染性疾病:因为血清中PCT浓度升高与单核细胞的黏附与活化相关,故一些非感染性因素也可以导致血清PCT升高。严重创伤、休克、手术、烧伤、吸入性损伤和重症胰腺炎也可能通过脂多糖或其他细菌产物的肠易位致血清PCT水平升高[37]。严重肝肾疾病、多器官功能衰竭、器官移植、骨髓移植、部分自身免疫性疾病和血液系统疾病等情况下也可出现血清PCT升高,但通常血清PCT升高幅度较低或持续时间相对较短。
建议四:血清PCT < 0.05 μg/L时多不支持细菌感染;但局部感染如纵隔炎、脓胸或脓肿也可能发生假阴性。总体而言,在区别细菌性和病毒性感染时,PCT的特异度、灵敏度及预测值均优于其他炎症指标。但在PICU患儿中,可能存在多种因素所致的严重炎症反应,故不能单独依据PCT升高鉴别细菌感染或非细菌感染。
四、用于判断疾病严重程度血清PCT虽然是儿童严重侵袭性细菌感染的一个有效生物标志物,但不能作为金标准。血清PCT浓度因感染部位而异。目前认为血清PCT浓度 > 0.5μg/L,在排除其他可能原因后,全身性细菌感染和脓毒症的可能性大,同时需要密切随访和动态监测。随着血清PCT水平不断升高,提示感染严重程度进展;达到2μg/L,提示达到严重脓毒症;升高到10μg/L时,患儿常发生脓毒性休克[38]。重症患儿中,血培养阳性败血症与培养阴性败血症相比,前者血清PCT明显较高[39]。
由于血清PCT半衰期短,评价治疗效果和判断疾病预后时需动态观察病情变化,连续监测血清PCT。血清PCT持续低浓度或向正常水平下降(比如每天下降30%以上,持续至少3d),提示治疗有效和疾病预后良好;无法解释的血清PCT升高提示治疗失败或预后不良,当细菌性脓毒症患儿血清PCT持续增加时,常与多器官衰竭有关,病死率高[40]。
建议五:重症患儿血清PCT动态监测是必要的,可评估是否为严重侵袭性细菌感染,也可评估病情严重程度,同时可判断治疗效果。
五、指导抗菌药物治疗血清PCT随全身炎症损伤而迅速升高,峰值水平与刺激强度相关,半衰期短,随着炎症消退迅速下降,可用于帮助决定何时启用抗菌药物,临床改善后何时停止用药。研究表明,血清PCT比CRP更有利于区分急诊室患儿的细菌和病毒感染,尤其在发热12 h内[41]。因此,在门诊急诊中,血清PCT快速检测可以减少不必要的抗菌药物使用,可使抗菌药物处方率降低70%以上[42]。
由于严重细菌感染延迟治疗可能导致预后较差的严重后果,故快速诊断和治疗极为重要。血清PCT能够促进抗菌药物的合理启用和优化抗菌药物使用疗程,指导抗菌药物种类的调整及联合用药的判断,适应患儿个体化需求,包括明确适应证、个体化方案、效果评价及停药。抗菌药物的合理使用有利于减少细菌耐药的产生,减少并发症和医疗费用,并防止不必要的住院。
病情稳定、低风险的呼吸道感染患儿中,血清PCT < 0.25 μg/L可以不使用抗菌药物。即使已经使用抗菌药物的细菌感染者,当PCT < 0.25μg/L时,可尽早停用抗菌药物,这样可以减少47%的抗菌药物使用[43]。
应用抗菌药物时,如果选择在血清PCT峰值降低幅度≥ 80%时停药,抗菌药物平均持续时间可减少2~3d,而不良事件、入住PICU、复发性感染、死亡等并不增加[44~48]。对于怀疑败血症的PICU患者,临床医生难以选择停用抗菌药物时机,当血清PCT < 0.5μg/L或从峰值降低≥ 80%,停药是安全的;也有研究选择血清PCT < 0.1 μg/L或水平从峰值降低≥ 90%时停用抗菌药物,并不能进一步提高安全性[49~52]。
抗菌药物治疗通常超过建议的持续时间,抗菌药物使用过度促使耐药细菌出现,产生不必要的药物不良事件,导致艰难梭菌感染。怀疑感染时,临床医生多采用抗菌药物治疗,但40%或更多的败血症患者从未鉴定出病原体[53]。因此,应当结合血清PCT和临床资料进行综合判断,改善抗菌药物的治疗适应证和优化使用疗程。
建议六:为合理应用抗菌药物,血清PCT有助于明确或排除细菌感染,治疗过程中需动态监测确定抗菌药物的治疗适应证和优化使用疗程。当血清PCT < 0.25 μg/L排除细菌感染时不使用抗菌药物;治疗后当血清PCT < 0.5μg/L或峰值降低幅度≥ 80%,临床症状消失,病情稳定,建议考虑停用抗菌药物。
六、用于新生儿感染性疾病由于新生儿早期血清PCT生理性增加,其正常值与日龄有关,而且新生儿感染的症状与体征无特异性或缺乏,应用血清PCT判断新生儿感染更加复杂,另外参考值范围缺乏校正也可能影响血清PCT作为细菌感染标志物判断结果。健康新生儿血清PCT生后即生理性升高,24h达到高峰(0.1~20.0μg/L),42~48h逐渐下降,72h接近正常[54~55]。非感染性新生儿呼吸窘迫综合征、血流动力学衰竭、低氧血症、围生期窒息、气胸或复苏后、颅内出血等状况下新生儿血清PCT显著高于健康新生儿。产前和产时给药可能影响脐带中PCT浓度[6]。与CRP相比较,血清PCT不是新生儿败血症更好的早期标志物,但对新生儿严重侵袭性细菌感染具有较高的阴性预测值(87%~100%)[56]。
研究显示,依据新生儿早期的血清PCT生理特点,分别设置新生儿早发型脓毒症及晚发型脓毒症的截断值,可提高新生儿脓毒症诊断的精确度[57]。新生儿早发型脓毒症病死率在高收入国家为30%、低收入国家高达60%[58, 59]。在高收入国家,有4.0%~7.4%的足月儿和晚期早产儿因怀疑早发型脓毒症在出生后前3d接受静脉抗菌药物治疗,但实际上,其中经细菌培养证实的病例不足0.1%,这不但增加了新生儿不适和医疗费用,还可能干扰新生儿正常菌群,并导致如湿疹、过敏、炎症性肠病等疾病发生[60~61]。
根据围生期危险因素的初步评估、新生儿的临床体征和症状及常规实验室检查,结合血清PCT动态监测,有助于抗菌药物管理,帮助医生决定尽早停用抗菌药物治疗。通过血清PCT监测指导抗菌药物治疗,一般足月新生儿脓毒症抗菌药物治疗的平均使用时间为:血培养阳性者8d、血培养阴性者6d、排除脓毒症者4d。研究结果表明,应用血清PCT检测指导治疗,对感染风险低或中等的新生儿至少可提前停用抗菌药物9.9h,缩短了住院时间,且再感染率低[56, 62]。因此,血清PCT用于辅助指导新生儿早期脓毒症治疗,能降低抗菌药物的使用和入院率,缩短抗菌药物使用疗程。
建议七:虽然新生儿早期影响血清PCT的因素较多,但血清PCT作为细菌感染标志物,在指导抗菌药物应用方面具有价值。
七、血清PCT的检测与注意事项2005年,血清PCT检测被美国食品和药物管理局(FDA)批准作为败血症的辅助诊断指标,2016年进一步获准用于评估败血症进展和28d病死率风险。目前PCT检测在我国也已广泛应用于临床。
(一) 检查方法血清PCT检测方法很多,溯源性是检验结果准确性、不同检测系统可比性的关键所在。不同状态下血清PCT值的截断值见表 1。目前,血清PCT可通过定性、半定量和定量的方法检测。
| 表 1 新生儿及儿童不同状态下血清降钙素原浓度的截断值(μg/L) |
1.定性检测:方法主要为免疫层析法, 常用于床旁检测(POCT),其特点是机器小型便捷,样本周转时间短,但该方法的精密度相对较低。
2.半定量检测:方法主要为胶体金比色法(BRAHMS PCT-Q-半定量快速实验),操作简单、报告结果快、不需特殊仪器,但易受操作者主观因素的影响,尤其是接近阳性临界值时结果较难判断。可供医生或护士床边使用,30min内检测出血清PCT浓度。结果分段为 < 0.5μg/L, 0.5~ < 2μg/L,2~ < 10μg/L,≥10μg/L。
3.定量检测:方法主要有电化学发光法和酶联免疫荧光法。检测灵敏度和特异度均较高。电化学发光法是全自动检测,检测通量高,检测时间短;酶联免疫荧光法为半自动检测,检测通量较低,单次检测的时间相对较长。
(二) 标本处理与大多数细胞因子不同,PCT在血样中非常稳定。采血后室温放置24h,血清PCT浓度仅降低12%,如在4 ℃保存则仅下降6%。所有PCT血样无需特殊保存,仅在需要长期保存或长时间运输及需排除其他影响因素的研究中需要低温或冰冻保存血样。样品是否冰冻、是否使用抗凝剂、动脉或静脉血,对结果的影响都微乎其微。常规血清PCT检测方法并不适用于脑脊液或其他体液标本检测。
(三) 注意事项由于方法学或抗体特异性等原因,使用不同试剂对同一份样本进行检测可能会得到不同的检测结果,临床医生在进行对比时需注意数值是否具有溯源性。本共识所采用的截断值均来源于国际统一德国勃拉姆斯PCT可溯源试剂。针对不同个体的检验结果解释,由于受到不同个体免疫状态和不同疾病临床特征影响,血清PCT数值的判读需结合临床分析。
建议八:用于医院感染诊断或排除相关疾病、判断疾病严重程度时,定量检测的意义较大;在基层社区和床边快速检测用于初筛时,可以使用定性检测或半定量检测。建议检测血样标本,目前不推荐脑脊液或其他体液标本。
总之,血清PCT是目前临床广泛应用的一项判断感染的生物学指标,与其他生物学标志物比较而言,它对脓毒症及细菌感染具有更高的灵敏度和特异度。但它并不是一项完美的指标,也存在假阳性、假阴性,因此,在对血清PCT值进行判读时,需紧密结合临床和其他实验室指标,提高准确性;动态的血清PCT浓度监测,能为病情监测、抗菌药物治疗提供更精确可靠的指导。
(祝益民 黄寒 执笔)
本指南制定专家 (以单位及姓名拼音为序):包钢集团第三职工医院(刘利军);北京大学第一医院(汤泽中);北京大学人民医院(刘瑶);重庆医科大学附属儿童医院(许红梅);复旦大学附属儿科医院(王传清);甘肃省第二人民医院(滕爱兰);广东医科大学附属东莞市儿童医院(张应洪);广州市妇女儿童医学中心(赵丹洋);湖南省儿童医院(黄娇甜、肖政辉);湖南省娄底市中心医院(姜新萍);湖南省人民医院(黄寒、钟礼立、祝益民);华中科技大学同济医学院附属同济医院(刘伟);华中科技大学同济医学院附属协和医院(白燕);江西省儿童医院(陈修文);解放军总医院第七医学中心(花少栋);南京医科大学附属儿童医院(周凯);青岛市妇女儿童医院(李自普);青海大学附属医院(周玲);山东大学齐鲁医院(李文);上海交通大学医学院附属上海儿童医学中心(曹清);上海交通大学医学院附属新华医院(黄丽素);深圳市儿童医院(鲍燕敏);首都医科大学附属北京儿童医院(谢正德);四川大学华西第二医院(夏斌);苏州大学附属儿童医院(严向明);天津儿童医院(邹映雪);武汉大学人民医院(姚宝珍);西安市儿童医院(程玮、李亚绒);厦门市儿童医院(黄英);浙江大学医学院附属儿童医院(龚方戚);郑州大学第一附属医院(田培超);中国医科大学附属盛京医院(许巍);中国医学科学院北京协和医院(万伟琳);中山大学附属第一医院(唐雯)
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Gendrel D, Bohuon C. Procalcitonin, a marker of bacterial infection[J]. Infection, 1997, 25(3): 133-134. DOI:10.1007/BF02113598 |
| [2] |
Dandona P, Nix D, Wilson MF, et al. Procalcitonin increase after endotoxin injection in normal subjects[J]. J Clin Endocrinol Metab, 1994, 79(6): 1605-1608. |
| [3] |
Brunkhorst FM, Heinz U, Forycki ZF. Kinetics of procalcitonin in iatrogenic sepsis[J]. Intensive Care Med, 1998, 24(8): 888-889. DOI:10.1007/s001340050683 |
| [4] |
Viallon A, Guyomarc'h S, Marjollet O, et al. Can emergency physicians identify a high mortality subgroup of patients with sepsis:role of procalcitonin[J]. Eur J Emerg Med, 2008, 15(1): 26-33. DOI:10.1097/MEJ.0b013e3280ec539b |
| [5] |
Assicot M, Gendrel D, Carsin H, et al. High serum procalcitonin concentrations in patients with sepsis and infection[J]. Lancet, 1993, 341(8844): 515-518. DOI:10.1016/0140-6736(93)90277-N |
| [6] |
van Rossum AM, Wulkan RW, Oudesluys-Murphy AM. Procalcitonin as an early marker of infection in neonates and children[J]. Lancet Infect Dis, 2004, 4(10): 620-630. DOI:10.1016/S1473-3099(04)01146-6 |
| [7] |
Rey C, Los AM, Concha A, et al. Procalcitonin and C-reactive protein as markers of systemic inflammatory response syndrome severity in critically ill children[J]. Intensive Care Med, 2007, 33(3): 477-484. DOI:10.1007/s00134-006-0509-7 |
| [8] |
Fernández LA, Luaces CC, García GJJ, et al. Procalcitonin in pediatric emergency departments for the early diagnosis of invasive bacterial infections in febrile infants:results of a multicenter study and utility of a rapid qualitative test for this marker[J]. Pediatr Infect Dis J, 2003, 22(10): 895-903. DOI:10.1097/01.inf.0000091360.11784.21 |
| [9] |
Wacker C, Prkno A, Brunkhorst FM, et al. Procalcitonin as a diagnostic marker for sepsis:a systematic review and meta-analysis[J]. Lancet Infect Dis, 2013, 13(5): 426-435. DOI:10.1016/S1473-3099(12)70323-7 |
| [10] |
Müller B, Becker KL. Procalcitonin:how a hormone became a marker and mediator of sepsis[J]. Swiss Med Wkly, 2001, 131(41-42): 595-602. |
| [11] |
Nascimento-Carvalho CM, Cardoso MR, Barral A, et al. Procalcitonin is useful in identifying bacteraemia among children with pneumonia[J]. Scand J Infect Dis, 2010, 42(9): 644-649. DOI:10.3109/00365541003796775 |
| [12] |
Agnello L, Bellia C, Di GM, et al. Utility of serum procalcitonin and C-reactive protein in severity assessment of community-acquired pneumonia in children[J]. Clin Biochem, 2016, 49(1-2): 47-50. DOI:10.1016/j.clinbiochem.2015.09.008 |
| [13] |
Moulin F, Raymond J, Lorrot M, et al. Procalcitonin in children admitted to hospital with community acquired pneumonia[J]. Arch Dis Child, 2001, 84(4): 332-336. DOI:10.1136/adc.84.4.332 |
| [14] |
Huang DT, Weissfeld LA, Kellum JA, et al. Risk prediction with procalcitonin and clinical rules in community-acquired pneumonia[J]. Ann Emerg Med, 2008, 52(1): 48-58. DOI:10.1016/j.annemergmed.2008.01.003 |
| [15] |
Krüger S, Ewig S, Marre R, et al. Procalcitonin predicts patients at low risk of death from community-acquired pneumonia across all CRB-65 classes[J]. Eur Respir J, 2008, 31(2): 349-355. DOI:10.1183/09031936.00054507 |
| [16] |
Wei TT, Hu ZD, Qin BD, et al. Diagnostic accuracy of procalcitonin in bacterial meningitis versus nonbacterial meningitis:a systematic review and meta-analysis[J]. medicine (Baltimore), 2016, 95(11): e3079. DOI:10.1097/MD.0000000000003079 |
| [17] |
Henry BM, Roy J, Ramakrishnan PK, et al. Procalcitonin as a serum biomarker for differentiation of bacterial meningitis from viral meningitis in children:evidence from a meta-analysis[J]. Clin Pediatr (Phila), 2016, 55(8): 749-764. DOI:10.1177/0009922815606414 |
| [18] |
Mills GD, Lala HM, Oehley MR, et al. Elevated procalcitonin as a diagnostic marker in meningococcal disease[J]. Eur J Clin Microbiol Infect Dis, 2006, 25(8): 501-509. DOI:10.1007/s10096-006-0179-y |
| [19] |
Casado-Flores J, Blanco-Quirós A, Nieto M, et al. Prognostic utility of the semi-quantitative procalcitonin test, neutrophil count and C-reactive protein in meningococcal infection in children[J]. Eur J Pediatr, 2006, 165(1): 26-29. DOI:10.1007/s00431-005-1761-5 |
| [20] |
Yu CW, Juan LI, Hsu SC, et al. Role of procalcitonin in the diagnosis of infective endocarditis:a meta-analysis[J]. Am J Emerg Med, 2013, 31(6): 935-941. DOI:10.1016/j.ajem.2013.03.008 |
| [21] |
Cornelissen CG, Frechen DA, Schreiner K, et al. Inflammatory parameters and prediction of prognosis in infective endocarditis[J]. BMC Infect Dis, 2013, 13: 272. DOI:10.1186/1471-2334-13-272 |
| [22] |
Leroy S, Gervaix A. Procalcitonin:a key marker in children with urinary tract infection[J]. Adv Urol, 2011, 2011: 397618. |
| [23] |
Pecile P, Miorin E, Romanello C, et al. Procalcitonin:a marker of severity of acute pyelonephritis among children[J]. Pediatrics, 2004, 114(2): e249-254. DOI:10.1542/peds.114.2.e249 |
| [24] |
Nikfar R, Khotaee G, Ataee N, et al. Usefulness of procalcitonin rapid test for the diagnosis of acute pyelonephritis in children in the emergency department[J]. Pediatr Int, 2010, 52(2): 196-198. DOI:10.1111/ped.2010.52.issue-2 |
| [25] |
Drozdov D, Schwarz S, Kutz A, et al. Procalcitonin and pyuria-based algorithm reduces antibiotic use in urinary tract infections:a randomized controlled trial[J]. BMC Med, 2015, 13: 104. DOI:10.1186/s12916-015-0347-y |
| [26] |
Leroy S, Romanello C, Galetto-Lacour A, et al. Procalcitonin to reduce the number of unnecessary cystographies in children with a urinary tract infection:a European validation study[J]. J Pediatr, 2007, 150(1): 89-95. DOI:10.1016/j.jpeds.2006.08.066 |
| [27] |
Meisner M. Update on procalcitonin measurements[J]. Ann Lab Med, 2014, 34(4): 263-273. DOI:10.3343/alm.2014.34.4.263 |
| [28] |
陈杰华, 郑跃杰, 王姝, 等. 降钙素原和C-反应蛋白对儿童全身和局部细菌感染的诊断价值[J]. 中国循证儿科杂志, 2013, 8(2): 87-91. DOI:10.3969/j.issn.1673-5501.2013.02.002 |
| [29] |
Resch B, Gusenleitner W, Müller W. Procalcitonin, interleukin-6, C-reactive protein and leukocyte counts in infants with bronchiolitis[J]. Pediatr Infect Dis J, 2003, 22(5): 475-476. |
| [30] |
Matesanz JL, Fernández E, Fernández JM, et al. Plasma procalcitonin and C-reactive protein concentrations in pediatric patients with Epstein-Barr virus infection[J]. Clin Chem, 2003, 49(12): 2103-2104. DOI:10.1373/clinchem.2003.023499 |
| [31] |
Huber W, Schweigart U, Bottermann P. Failure of PCT to indicate severe fungal infection in two immunodeficient patients[J]. Infection, 1997, 25(6): 377-378. DOI:10.1007/BF01740823 |
| [32] |
Charles PE, Dalle F, Aho S, et al. Serum procalcitonin measurement contribution to the early diagnosis of candidemia in critically ill patients[J]. Intensive Care Med, 2006, 32(10): 1577-1583. DOI:10.1007/s00134-006-0306-3 |
| [33] |
Christofilopoulou S, Charvalos E, Petrikkos G. Could procalcitonin be a predictive biological marker in systemic fungal infections?Study of 14 cases[J]. Eur J Intern Med, 2002, 13(8): 493-495. DOI:10.1016/S0953-6205(02)00160-7 |
| [34] |
Seligman R, Meisner M, Lisboa TC, et al. Decreases in procalcitonin and C-reactive protein are strong predictors of survival in ventilator-associated pneumonia[J]. Crit Care, 2006, 10(5): R125. DOI:10.1186/cc5036 |
| [35] |
Varetto G, Castagno C, Trucco A, et al. Serum procalcitonin as a valuable diagnostic tool in the early detection of infectious complications after open abdominal aortic repair[J]. Ann Vasc Surg, 2016, 34: 111-118. DOI:10.1016/j.avsg.2016.01.012 |
| [36] |
Lin SG, Hou TY, Huang DH, et al. Role of procalcitonin in the diagnosis of severe infection in pediatric patients with fever and Neutropenia-a systemic review and meta-analysis[J]. Pediatr Infect Dis J, 2012, 31(10): e182-188. |
| [37] |
林泽鸿, 蔡晓莹, 林广裕, 等. 降钙素原在儿童非细菌感染性疾病诊断中的意义[J]. 中华儿科杂志, 2017, 55(11): 873-876. DOI:10.3760/cma.j.issn.0578-1310.2017.11.019 |
| [38] |
贺彬, 祝益民, 卢秀兰, 等. 血清降钙素原对重症儿童病情的预测[J]. 中华急诊医学杂志, 2013, 22(7): 755-759. DOI:10.3760/cma.j.issn.1671-0282.2013.07.014 |
| [39] |
Anand D, Das S, Bhargava S, et al. Procalcitonin as a rapid diagnostic biomarker to differentiate between culture-negative bacterial sepsis and systemic inflammatory response syndrome:a prospective, observational, cohort study[J]. J Crit Care, 2015, 30(1): 218.e7-12. DOI:10.1016/j.jcrc.2014.08.017 |
| [40] |
Jensen JU, Heslet L, Jensen TH, et al. Procalcitonin increase in early identification of critically ill patients at high risk of mortality[J]. Crit Care Med, 2006, 34(10): 2596-2602. DOI:10.1097/01.CCM.0000239116.01855.61 |
| [41] |
Gendrel D, Raymond J, Coste J, et al. Comparison of procalcitonin with C-reactive protein, interleukin 6 and interferon-alpha for differentiation of bacterial vs. viral infections[J]. Pediatr Infect Dis J, 1999, 18(10): 875-881. DOI:10.1097/00006454-199910000-00008 |
| [42] |
Briel M, Schuetz P, Mueller B, et al. Procalcitonin-guided antibiotic use vs a standard approach for acute respiratory tract infections in primary care[J]. Arch Intern Med, 2008, 168(18): 2000-2007. DOI:10.1001/archinte.168.18.2000 |
| [43] |
Christ-Crain M, Jaccard-Stolz D, Bingisser R, et al. Effect of procalcitonin-guided treatment on antibiotic use and outcome in lower respiratory tract infections:cluster-randomised, single-blinded intervention trail[J]. Lancet, 2004, 363(9409): 600-607. DOI:10.1016/S0140-6736(04)15591-8 |
| [44] |
Schuetz P, Christ-Crain M, Thomann R, et al. Effect of procalcitonin-based guidelines vs standard guidelines on antibiotic use in lower respiratory tract infections:the ProHOSP randomized controlled trial[J]. JAMA, 2009, 302(10): 1059-1066. DOI:10.1001/jama.2009.1297 |
| [45] |
Schuetz P, Wirz Y, Sager R, et al. Procalcitonin to initiate or discontinue antibiotics in acute respiratory tract infections[J]. Cochrane Database Syst Rev, 2017, 10: CD007498. |
| [46] |
Schuetz P, Briel M, Christ-Crain M, et al. Procalcitonin to guide initiation and duration of antibiotic treatment in acute respiratory infections:an individual patient data meta-analysis[J]. Clin Infect Dis, 2012, 55(5): 651-662. DOI:10.1093/cid/cis464 |
| [47] |
Baer G, Baumann P, Buettcher M, et al. Procalcitonin guidance to reduce antibiotic treatment of lower respiratory tract infection in children and adolescents (ProPAED):a randomized controlled trial[J]. PLoS One, 2013, 8(8): e68419. DOI:10.1371/journal.pone.0068419 |
| [48] |
萨日娜, 王爱琼, 孟红, 等. 降钙素原在儿童下呼吸道感染初始治疗中指导抗生素使用的意义[J]. 中国当代儿科杂志, 2014, 16(2): 211-213. |
| [49] |
Bouadma L, Luyt CE, Tubach F, et al. Use of procalcitonin to reduce patients' exposure to antibiotics in intensive care units (PRORATA trial):a multicentre randomised controlled trial[J]. Lancet, 2010, 375(9713): 463-474. DOI:10.1016/S0140-6736(09)61879-1 |
| [50] |
Shehabi Y, Sterba M, Garrett PM, et al. Procalcitonin algorithm in critically ill adults with undifferentiated infection or suspected sepsisl. A randomized controlled trial[J]. Am J Respir Crit Care Med, 2014, 190(10): 1102-1110. DOI:10.1164/rccm.201408-1483OC |
| [51] |
Pierce R, Bigham MT, Giuliano JS. Use of procalcitonin for the prediction and treatment of acute bacterial infection in children[J]. Curr Opin Pediatr, 2014, 26(3): 292-298. DOI:10.1097/MOP.0000000000000092 |
| [52] |
de Jong E, van Oers JA, Beishuizen A, et al. Efficacy and safety of procalcitonin guidance in reducing the duration of antibiotic treatment in critically ill patients:a randomised, controlled, open-label trial[J]. Lancet Infect Dis, 2016, 16(7): 819-827. DOI:10.1016/S1473-3099(16)00053-0 |
| [53] |
Phua J, Ngerng W, See K, et al. Characteristics and outcomes of culture-negative versus culture-positive severe sepsis[J]. Crit Care, 2013, 17(5): R202. DOI:10.1186/cc12896 |
| [54] |
Chiesa C, Panero A, Rossi N, et al. Reliability of procalcitonin concentrations for the diagnosis of sepsis in critically ill neonates[J]. Clin Infect Dis, 1998, 26(3): 664-672. DOI:10.1086/cid.1998.26.issue-3 |
| [55] |
Stocker M, Fontana M, El HS, et al. Use of procalcitonin-guided decision-making to shorten antibiotic therapy in suspected neonatal early-onset sepsis:prospective randomized intervention trial[J]. Neonatology, 2010, 97(2): 165-174. DOI:10.1159/000241296 |
| [56] |
马莉, 刘翠青, 刘智慧, 等. 可溶性细胞间黏附分子-1、降钙素原在新生儿败血症诊断中的价值[J]. 中华儿科杂志, 2004, 42(9): 654-658. DOI:10.3760/j.issn:0578-1310.2004.09.004 |
| [57] |
Pontrelli G, De Crescenzo F, Buzzetti R, et al. Accuracy of serum procalcitonin for the diagnosis of sepsis in neonates and children with systemic inflammatory syndrome:a meta-analysis[J]. BMC Infect Dis, 2017, 17(1): 302. DOI:10.1186/s12879-017-2396-7 |
| [58] |
Stoll BJ, Hansen NI, Sánchez PJ, et al. Early onset neonatal sepsis:the burden of group B Streptococcal and E. coli disease continues[J]. Pediatrics, 2011, 127(5): 817-826. DOI:10.1542/peds.2010-2217 |
| [59] |
Thaver D, Zaidi AK. Burden of neonatal infections in developing countries:a review of evidence from community-based studies[J]. Pediatr Infect Dis J, 2009, 28(1 Suppl): S3-9. |
| [60] |
Escobar GJ, Puopolo KM, Wi S, et al. Stratification of risk of early-onset sepsis in newborns ≥ 34 weeks' gestation[J]. Pediatrics, 2014, 133(1): 30-36. DOI:10.1542/peds.2013-1689 |
| [61] |
Fjalstad JW, Stensvold HJ, Bergseng H, et al. Early-onset Sepsis and Antibiotic Exposure in Term Infants:A Nationwide Population-based Study in Norway[J]. Pediatr Infect Dis J, 2016, 35(1): 1-6. |
| [62] |
Stocker M, van Herk W, El HS, et al. Procalcitonin-guided decision making for duration of antibiotic therapy in neonates with suspected early-onset sepsis:a multicentre, randomised controlled trial (NeoPIns)[J]. Lancet, 2017, 390(10097): 871-881. DOI:10.1016/S0140-6736(17)31444-7 |
 2019, Vol. 3
2019, Vol. 3
